制备波棱瓜子总木脂素纳米混悬剂
2015-01-13李娟娟沈成英宋启瑞袁海龙
沈 刚, 李娟娟, 程 玲, 沈成英, 宋启瑞, 韩 晋 , 袁海龙
(1. 成都中医药大学药学院,四川 成都611137;2. 中国人民解放军第302 医院,北京100039)
波棱瓜子系葫芦科植物波棱瓜Herpetospermum caudigerum Wall 的干燥成熟种子,为常用藏药。《中华人民共和国卫生部药品标准(藏药标准)》1995 年版记载,其味苦,性寒,能清腑热、胆热,具有清热解毒、去火降热、助消化的作用,用于治疗肝热、黄疸性传染型肝炎等症[1]。本课题组前期研究表明,波棱瓜子抗肝炎的有效部位为总木脂素,主 要 由 herpetrione、herpetin、herpetetrone、herpetotriol、herpetal 等成分组成[2-3]。然而,由于木脂素类成分的水溶性较差,导致其口服生物利用度低,制约了抗肝炎的临床疗效。
纳米混悬剂(nanosuspensions,NS)作为难溶性药物的新型给药系统,能显著改善难溶性药物的口服生物利用度,从而提高疗效[4]。其中,高压均质技术作为纳米混悬剂制备的常用方法,具有工艺简单、重复性好、可实现产业化等优点[5]。但是,当药物颗粒过大时,往往存在堵塞高压均质机限流缝隙的风险,同时其硬度过大时也不易形成纳米尺寸,而沉淀法联合高压均质能降低该技术的能耗和堵塞风险[6]。
波棱瓜子总木脂素(total lignans from Herpetospermum caudigerum,HTL)中的大部分化合物都含有酚羟基结构[3],其溶解度受pH 影响。据此性质,本实验采用pH 依赖的溶解-沉淀法代替溶剂沉淀法联合高压均质技术,用于制备波棱瓜子总木脂素纳米混悬剂,并利用Box-Behnken 设计-响应面法来优化处方,同时对其冻干粉进行理化性质表征和体外溶出行为考察。
1 仪器与材料
Nano DeBEE 超高压均质机(美国必宜DeBEE公司);S-4800 扫描电镜(日本日立公司);Winner801 纳米激光粒度仪(济南微纳颗粒仪器股份有限公司);D/Max 2500PC X 射线衍射仪(日本Rigaku 公司);LGJ-18 冷冻干燥机(北京四环科学仪器厂);RC-3 溶出度测试仪(天津市新天光分析仪器技术有限公司);LC-20A 岛津液相色谱仪(日本岛津公司);85-2 恒温磁力搅拌器(常州国华电器有限公司)。
波棱甲素对照品(自制,纯度大于98%,批号121205);波棱瓜子总木脂素原料药(本实验室制备,以波棱甲素计,总木脂素的质量分数为82.34%,波棱甲素的质量分数为18.8%);十二烷基硫酸钠(SDS)、聚维酮K30 (PVP K30)、甘露醇(北京凤礼精求商贸有限责任公司)。乙腈为色谱纯 (德国Merck 公司);其他试剂均为分析纯。
2 方法与结果
2.1 原料药中总木脂素的测定[7]精密称取波棱甲素对照品10.00 mg,置于25 mL 量瓶中,加甲醇超声溶解,并稀释至刻度线,即得到0.4 mg/mL的对照品溶液。
精密吸取上述对照品溶液80、100、150、200、250、300 μL,分别置于10 mL 量瓶中,加入10%变色酸水溶液1 mL 和浓硫酸6 mL,蒸馏水定容,沸水浴中放置30 min 后取出,用流水冷却,以相应的试剂为空白对照。按照紫外-可见分光光度法(《中国药典》2010 年版一部附录VA),在570 nm 波长处测定吸光度,以吸光度为纵坐标(A)、质量浓度(mg/mL)为横坐标(C),绘制标准曲线,得回归方程A =0.044 3C -0.015 9,r =0.999 3,表明在3.2 ~12.0 μg/mL 范围内线性关系良好。
精密称取原料药细粉5.0 mg,置于10 mL 量瓶中,加甲醇超声溶解,并稀释至刻度线,再精密吸取1 mL,置于50 mL 量瓶中,加入10%变色酸水溶液5 mL 和浓硫酸30 mL,蒸馏水定容,沸水浴中放置30 min 后取出,用流水冷却,以相应的试剂为空白对照。然后,测定吸光度值,根据标准曲线计算溶液中波棱甲素的含有量,结果测得原料药中总木脂素的质量分数(以波棱甲素计)为82.34%。
2.2 波棱瓜子总木脂素纳米混悬剂的制备 取原料药10 ~20 mg,溶于0.1 mol/L NaOH 溶液(5 mL)和乙醇(5 mL)的混合溶剂中,超声溶解,然后将上述溶液在800 r/min 磁力搅拌条件下,缓慢注入到含SDS (2 ~4 mg)和PVP K30 (2 ~4 mg)的水溶液(90 mL)与0.1 mol/L HCl 溶液(5 mL)的混合溶液中。接着,将上述混悬液转入高压均质机,1 000 bar 压力下循环10 次,即得。
2.3 Box-Behnken 设计-响应面法优化波棱瓜子总木脂素纳米混悬剂制备的处方 经前期试验考察,选择药物质量浓度(X1)、SDS 质量浓度(X2)和PVP K30 质量浓度(X3)为参考因素,其水平和编码见表1。然后,以波棱瓜子总木脂素纳米混悬剂平均粒径(Y)为响应值,采用3 因素3 水平的Box-Behnken 设计-响应面法优化波棱瓜子总木脂素纳米混悬剂制备处方,设计安排及结果见表2。
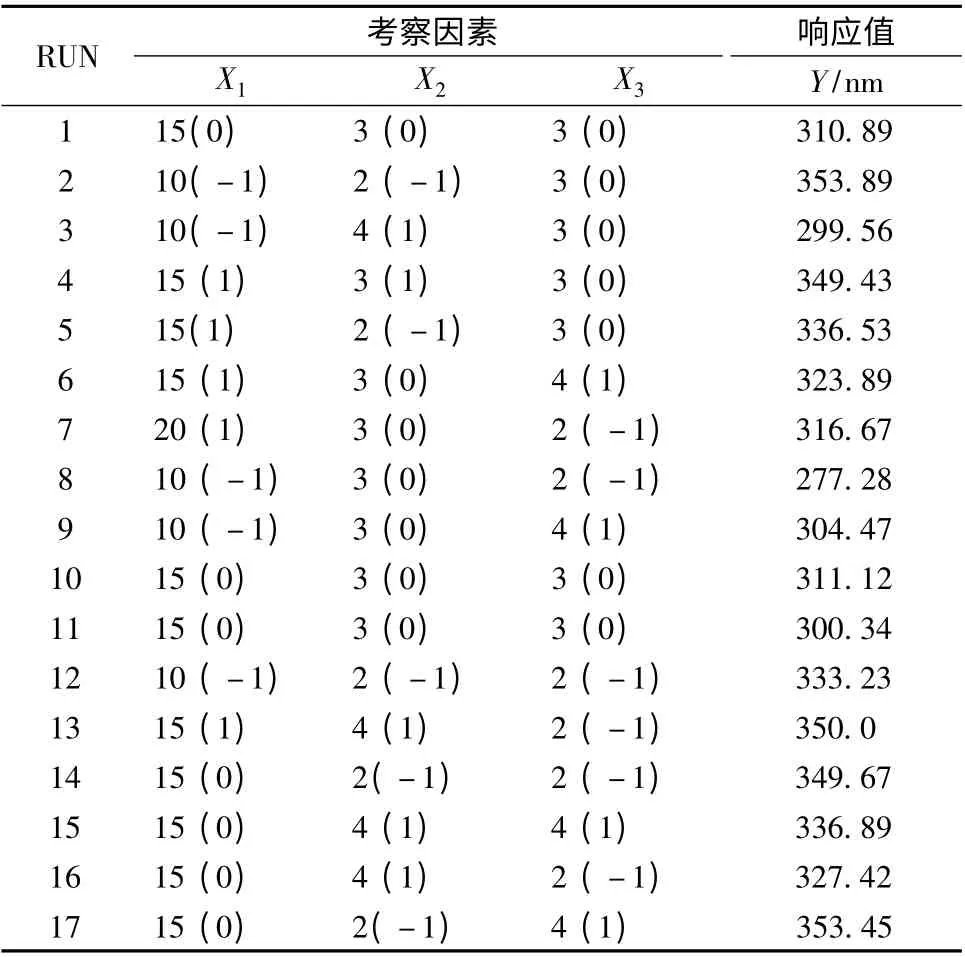
表2 Box-Behnken 设计安排及结果Tab.2 Arrangement and result of Box-Behnken design
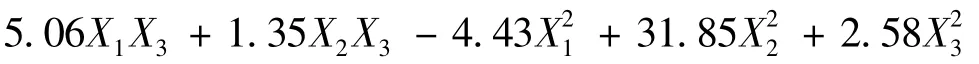
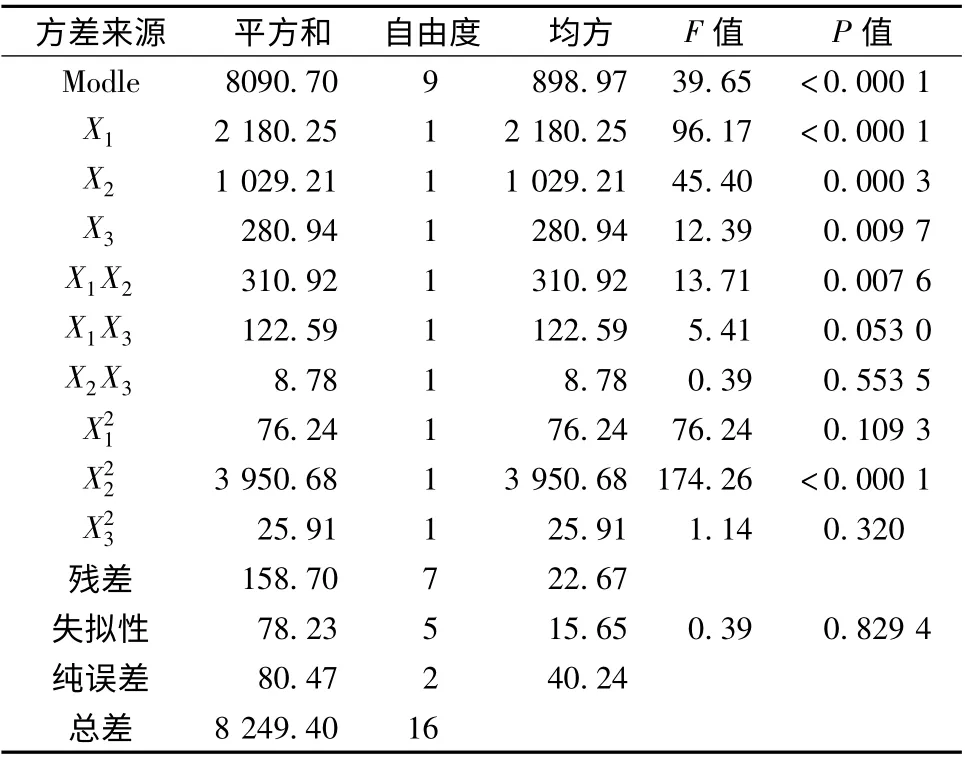
表3 统计分析结果Tab.3 Statistical analysis result
2.3.2 效应面优化与预测 应用Design-Expert 8.0.7.1 软件,绘制不同影响因素的效应面图(图1),可知波棱瓜子总木脂素纳米混悬剂的粒径受到药物、SDS 和PVP K30 三者的共同影响,粒径随着PVP K30 用量的增加,先降后升,而随着药物和SDS 用量的增加,呈非线性增加。根据Box-Behnken 响应面实验设计结果,得到优化后的处方为X1=10,X2=3.3,X3=2.1。按照此优化处方,制备了3 批波棱瓜子总木脂素纳米混悬剂,并测定其粒径,结果测得实测值为(306.15 ±7.06)nm,和预测值277.06 nm 较接近,表明该模型的预测性良好。

图1 各因素对响应值影响的三维效应曲面图Fig.1 3D response surface plot for the effects of each factor on response value
2.4 波棱瓜子总木脂素纳米混悬剂冻干粉的制备与验证 将按优化处方制得的波棱瓜子总木脂素纳米混悬剂中加入5%甘露醇,-80 ℃冰箱中预冷冻24 h,再置于压力0.10 mbar,温度-50 ℃冷冻干燥机中冷冻72 h 后取出,即得冻干粉。然后,按处方比例称取原辅料适量,验证波棱瓜子总木脂素纳米混悬剂及其冻干粉的制备工艺,得到疏松的浅黄色冻干粉,结果见表4。
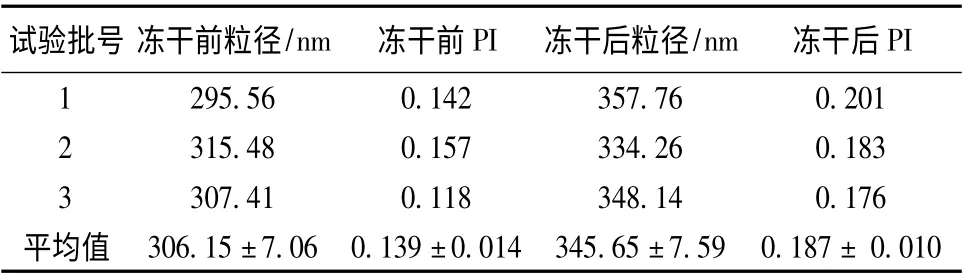
表4 波棱瓜子总木脂素纳米混悬剂冻干前后的粒径和多分散度指数(PI)Tab.4 Particle sizes and polydispersity indices (PI)of HTL-NS before and after lyophilization
2.5 波棱瓜子总木脂素物理混合物的制备 称取干燥至恒定质量的波棱瓜子总木脂素原料药适量,并按制备其纳米混悬剂的处方比例称取辅料适量,加蒸馏水混匀,再加5%甘露醇,在“2.4”项条件下冷冻干燥,即得。
2.6 波棱瓜子总木脂素纳米混悬剂的表征
2.6.1 粒径分析 分别称取波棱瓜子总木脂素纳米混悬剂和冻干粉适量,加蒸馏水稀释至适宜的浓度,Winner-801 纳米激光粒度仪测定其粒径及多分散度指数(PI),共3 批,每批测定3 次,取平均值,结果见表4。由表可知,波棱瓜子总木脂素纳米混悬剂冻干粉复溶后的平均粒径为(345.05 ±7.59)nm,PI 为0.187 ±0.010,较冻干前变化不大,表明该冻干工艺的固化效果和再分散性能良好。
2.6.2 形态观察 取波棱瓜子总木脂素原料药和其纳米混悬剂冻干粉适量,于扫描电镜(SEM)下观察其形态并拍摄照片,结果见图2,由图可知,原料药在SEM 下呈不规则块状,而纳米混悬剂呈不规则球形,大小较均匀。

图2 扫描电镜图Fig.2 Images taken on scanning electron microscope
2.7 波棱瓜子总木脂素纳米混悬剂溶出度的测定
2.7.1 色谱条件 Kromasil-C18色谱柱(250 mm ×4.6 mm,5 μm);流动相为乙腈-2% 冰醋酸(22 ∶78);体积流量1.0 mL/min;检测波长280 nm;柱温室温;进样量10 μL。
2.7.2 供试品溶液的制备 称取波棱瓜子总木脂素纳米混悬剂冻干粉适量,磷酸盐缓冲液(pH 为7.5)超声溶解,过0.45 μm 微孔滤膜,取续滤液,即得。
2.7.3 专属性考察 按处方比例称取缺波棱瓜子总木脂素原料药的辅料适量,制成空白纳米混悬液冻干粉,再按“2.7.2”项下方法制成阴性对照溶液,在“2.7.1”项色谱条件下进行测定。结果显示,阴性对照溶液在与对照品溶液相同的保留时间处未见色谱峰,表明辅料对波棱甲素的测定无干扰,见图3。
2.7.4 标准曲线的绘制 精密吸取对照品溶液适量,用甲醇按不同比例稀释,得到2、10、20、40、60、80 μg/mL 对照品溶液,分别精密吸取10 μL进样分析,以质量浓度(μg/mL)为横坐标(C),色谱峰面积为纵坐标(A),得到标准曲线A=13 733C+6 310.5 (r =0.999 6),表明波棱甲素在2 ~80 μg/mL 呈良好的线性关系。
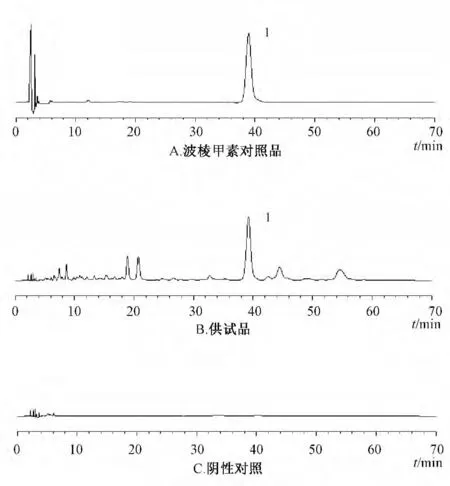
图3 专属性考察HPLC 色谱图Fig.3 HPLC chromatograms for specificity investigation
2.7.5 精密度试验 精密吸取质量浓度为40 μg/mL的对照品溶液,进样10 μL,平行测定6 次,计算精密度。结果显示,波棱甲素峰面积RSD 为1.41%,表明该仪器精密度良好。
2.7.6 重复性试验 精密称取波棱瓜子总木脂素纳米混悬剂冻干粉100 mg,按照“2.7.2”项下方法平行制备6 份,在“2.7.1”项色谱条件下,进样10 μL 测定。结果显示,波棱甲素峰面积RSD值为1.32%,表明该方法重复性良好。
2.7.7 稳定性试验 精密吸取供试品溶液10 μL,分别于0、2、4、8、12 h 注入HPLC 色谱仪,测定峰面积。结果显示,波棱甲素峰面积RSD 值为0.35%,表明供试品溶液在12 h 内稳定。
2.7.8 回收率试验 精密称取波棱甲素含有量已知的波棱瓜子总木脂素纳米混悬剂冻干粉适量,共6 份,分别加入pH 为7.5 的磷酸盐缓冲液和精密量取的波棱甲素对照品,超声溶解,混匀,在“2.7.1”项色谱条件下进样分析。结果,回收率均在98.21% ~101.98%之间,RSD 为1.85%,表明该方法准确度良好。
2.7.9 体外溶出率的测定 取波棱瓜子总木脂素纳米混悬剂冻干粉及其物理混合物各0.4 g,共3份,按《中国药典》2010 年版二部 (附录XC)桨法测定溶出度。在(37 ±1)℃温度下,以磷酸盐缓冲液(pH 为7.5)900 mL 为释放介质[8],搅拌速度为100 r/min,待其平稳后,将胶囊投进溶出杯中,从接触溶媒起立即计时,分别于5、10、15、20、30、45、60 min 取样1 mL,并补充相同温度体积的新鲜溶出介质,样品经0.45 μm 滤膜滤过,取续滤液,在“2.7.1”项色谱条件下进样分析,记录峰面积,计算累积溶出度,结果见图4。由图可知,物理混合物的最大累积溶出率只有39.67%,而波棱瓜子总木脂素纳米混悬剂在20 min 时的累积溶出率可达85.00%,溶出效果明显优于物理混合物,表明将难溶性药物波棱瓜子总木脂素制备成纳米混悬剂后,其溶出度得到显著改善。
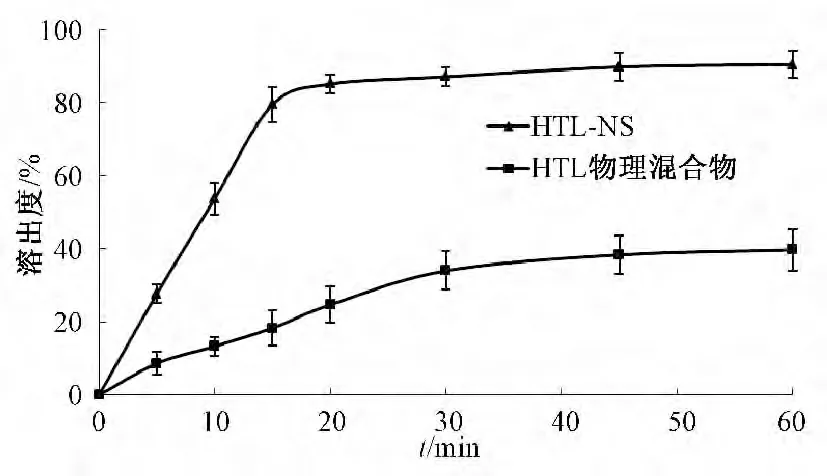
图4 波棱瓜子总木脂素纳米混悬剂和物理混合物的溶出曲线图Fig.4 Dissolution curves of HTL-NS and HTL physical mixture
3 讨论
文献报道[9],PVP K30 是一种聚合物,可包裹在纳米粒子表面,使粒子间产生空间排斥,能防止Ostwald 熟化和团聚等现象的发生,但是浓度较低时,不能完全包裹纳米粒子表面,而浓度较高时,溶液黏度增大,粒子凝聚,导致粒径变大[10]。SDS是一种离子型表面活性剂,具有静电作用,能减小纳米化过程中产生的过多的表面能。研究发现[11],联用这两种类型的稳定剂可使制剂具有更好的稳定性。根据析晶理论,只有晶核形成快而成长慢,才能得到最小粒径的稳定混悬液,所以药物过饱和时,结晶生长快,产生Ostwald 熟化,使粒径变大[12]。
本实验根据波棱瓜子总木脂素中的大部分化合物都含有酚羟基结构,溶解度受pH 影响的特点,采用pH 依赖的溶解沉淀法联合高压均质技术,用于制备波棱瓜子总木脂素纳米混悬剂。预实验发现,波棱瓜子总木脂素在碱性溶液中不能完全溶解,而加入适量乙醇后可促进其溶解[13],当碱性溶液与乙醇的体积比为1 ∶1 时,波棱瓜子总木脂素能得到较好溶解,故在制备过程中加入了5 mL乙醇。波棱瓜子总木脂素纳米混悬剂在冻干前后,粒径增加了近50 nm,这是因为其在固体化过程中随着水分的散失,存在“固化损伤”现象[14],粒子之间发生不可逆的聚合、团聚、增长等现象,使冻干粉的再分散性能降低,粒径变大,但增加的粒径在合理的范围内,影响不大。
实验结果显示,采用pH 依赖的溶解沉淀法联合高压均质技术能成功制备波棱瓜子总木脂素纳米混悬剂,而且其粒径小,以无定型状态存在,体外溶出行为良好,可为弱酸弱碱类难溶性药物有效部位的纳米化提供新的方法。
[1] 国家药典委员会. 中华人民共和国卫生部药品标准(藏药):第1 册[S]. 1995.
[2] Yuan H L,Yang M,Li X Y,et al. Hepatitis B virus inhibiting constituents from Herpetospermum caudigerum[J]. Chem Pharm Bull,2006,54(11):1592-1594.
[3] Cong L B,Yuan H L,Wang Q,et al. Simultaneous determination of seven bioactive lignans in Herpetospermum caudigerum by RP-HPLC method[J]. Biomed Chromatogr,2008,22(10):1084-1890.
[4] Shegokar R,Müller R H. Nanocrystals:industrially feasible multifunctional formulation technology for poorly soluble actives[J]. Int J Pharm,2010,399(1-2):129-139.
[5] Guo J J,Yue P F,Lv J L,et al. Development and in vivo/in vitro evaluation of novel herpetrione nanosuspension[J]. Int J Pharm,2013,441(1-2):227-233.
[6] Liu Y,Xie P,Zhang D,et al. A mini review of nanosuspensions development[J]. J Drug Target,2012,20 (3):209-223.
[7] 张媛媛. 基于纳米混悬技术的难溶性中药有效部位给药系统的研究[D]. 成都:成都中医药大学,2011.
[8] 郭静静,李仙义,袁海龙,等. 波棱甲素纳米混悬剂胶囊的制备及体外溶出度测定[J]. 中草药,2012,43(3):467-470.
[9] Patel G V,Patel V B,Pathak A,et al. Nanosuspension of efavirenz for improved oral bioavailability:formulation optimization,in vitro,in situ and in vivo evaluation[J]. Drug Dev Ind Pharm,2014,40(1):80-91.
[10] Patravale V,Kulkarni R. Nanosuspensions:a promising drug delivery strategy[J]. J Pharm Pharmacol,2004,56(7):827-840.
[11] Müller R H,Jacobs C. Buparvaquone mucoadhesive nanosuspension:preparation,optimisation and long-term stability[J].Int J Pharm,2002,237(1-2):151-161.
[12] Hao J F,Gao Y,Zhao J,et al. Preparation and optimization of resveratrol nanosuspensions by antisolvent precipitation using Box-Behnken design[J]. AAPS Pharm Sci Tech,2015,16(1):118-128.
[13] Xu Y,Liu X Y,Lian R Y,et al. Enhanced dissolution and oral bioavailabiity of aripiprazole nanosuspensions prepared by nanoprecipitation/homogenization based on acid-base neutralization[J]. Int J Pharm,2012,438(1/2):287-295.
[14] Wang B H,Zhang W B,Zhang W,et al. Progress in drying technology for nanomaterials[J]. Drying Technol,2005,23(1/2):7-32.
