基于纳滤技术的消癌平注射液中的钾离子去除工艺优化
2015-01-13李存玉杨泽秋陈伟伟李红阳彭国平
李存玉, 钱 祥, 杨泽秋, 陈伟伟, 李红阳, 彭国平*
(1. 南京中医药大学药学院,江苏 南京210023;2. 江苏省中药资源产业化过程协同创新中心,江苏南京210023)
消癌平注射液是以单一药材通关藤为原料,经过水提取、精制而成的中药注射剂,具有清热解毒,化痰软坚的功效,多用于治疗肝癌、肺癌、胃癌、食道癌等,多作为放疗、化疗的辅助治疗药物使用,临床使用量较大,是一种效果较好的抗癌药物[1]。但是,借助中药注射液安全性再评价的契机,在对消癌平注射液进行工艺优化时发现,其生产过程中常常出现钾离子浓度偏高的现象,危害着其用药安全性。
钾离子普遍存在于中药材中,当作为静脉给药时,钾离子浓度过高容易造成机体电解质平衡失调,对心肌的损伤很大[2]。因此,《中国药典》2010 版规定静脉注射液中钾离子质量浓度不得超过22% (mg/mL)[3]。消癌平注射液中钾离子的超标直接是由其原料药材通关藤所引入的,因此需要在通关藤药材提取、浓缩等工艺环节中采取适宜的方法降低钾离子的含量,提升注射剂的质量安全。
目前钾离子的去除方法主要分为阳离子交换树脂法、电渗析法[4],二者均能有效的去除药液中的钾离子,但是均存在成分吸附损失的问题,因此在中药注射液生产中存在应用瓶颈。而纳滤是介于超滤和反渗透之间的一种膜分离技术,截留分子量在200 ~1 000 Da 之间,具有操作压力低,通量高,对无机离子高效去除的能力,目前在制药、生物化工、食品、水处理等诸多领域广泛应用[5-8]。
为了在降低消癌平注射液中的钾离子浓度的同时,保留其有效成分,本研究选择系列截留分子量的纳滤膜进行消癌平注射液中间体纳滤处理,以钾离子的去除和有效成分绿原酸的保留为指标,优选适宜于中药注射剂中钾离子的去除工艺。
1 材料与方法
1.1 材料 通关藤饮片(批号20100130,由南京圣和药业有限公司提供),纳滤膜(截留分子量150 ~300 Da、300 ~500 Da、600 ~800 Da,聚酰胺复合膜,星达(泰州)膜科技有限公司),绿原酸对照品(批号110753-200212,中国食品药品检定研究院),钾离子标准溶液(国家标准物质中心),乙腈、磷酸为色谱纯,水为超纯水。
1.2 仪器 Agilent 1100 高效液相色谱仪(VWD检测器,美国Agilent LC 公司);TAS-986 火焰原子吸收分光光度计(北京普析通用仪器有限责任公司);纳滤膜分离设备(型号TNZ-1,南京拓鉒医药科技有限公司);不锈钢煎药桶(容量50 L),燃气为高纯度乙炔气,空气为助燃气。
1.3 方法
1.3.1 消癌平注射液中间体的制备 按照消癌平注射液质量标准制法,取通关藤饮片5.0 kg,加水(8、5、5 倍)煎煮3 次,第1 次1.5 h,第2 次1 h,第3 次0.8 h,提取液分别滤过,合并滤液,得消癌平注射液中间体约80 L。
1.3.2 纳滤工艺 取消癌平注射液中间体40 L,取样为原液,分别采用3 种不同截留分子量的纳滤膜浓缩(纳滤膜参数见表1),操作压力5 kg/cm2、温度25 ℃,纳滤浓缩过程如图1 所示,将进液端与截留液端均置于原液中,随着纳滤的进行,根据最终可生产的消癌平注射液成品量,在原液浓缩至体积在4 L 左右时,加入3 倍体积纯净水继续纳滤,重复3 次,将浓缩液定容至4 L,取样为纳滤浓缩液。

表1 纳滤膜参数Tab.1 Parameters of nanofiltration membrane

图1 纳滤膜过程示意图Fig.1 Schematic diagram of nanofiltration process
1.3.3 绿原酸检测[9-10]
1.3.3.1 绿原酸对照品溶液的制备 取绿原酸对照品适量,精密称定,置棕色量瓶中,加50%甲醇制成每1 mL 含40 μg 的绿原酸对照品溶液,即得。
1.3.3.2 HPLC 色谱条件 色谱柱:Thermo scientific C18色谱柱(4.6 mm ×150 mm,5 μm);柱温25 ℃;检测波长327 nm;体积流量1 mL/min;进样量10 μL;流动相乙腈-0.4% 磷酸水溶液 (9-91)。
1.3.3.3 绿原酸保留率测定 分别精密吸取绿原酸对照品溶液、消癌平注射液中间体、纳滤浓缩液,按“1.3.3.2”项下的色谱条件,采用高效液相色谱法测定峰面积,采用外标一点法,按式(1)计算绿原酸的保留率。

式中,R 为绿原酸的保留率;CN为纳滤浓缩液中绿原酸的质量浓度,单位为μg/mL;VN为纳滤浓缩液体积,单位为mL;CT为提取液中绿原酸的质量浓度,单位为μg/mL;VT为提取液体积,单位为mL。
1.3.4 钾离子的检测[11]
1.3.4.1 测定条件 检测波长:768.5 nm,空心阴极灯电流2.0 mA,狭缝为0.2 nm,采用空气-乙炔火焰,燃气流量2.5 L/min。
1.3.4.2 线性关系 标准曲线的制备:精密量取质量浓度为0.5 mg/mL 的钾单元素标准溶液100 mL,为对照品贮备液。
分别精密量取上述对照品贮备液各0、1、2、3、4、5 mL 置25 mL 量瓶中,纯化水稀释制得每1 mL分别含钾0、20、40、60、80、100 μg 的溶液,依次喷入火焰,测定吸光度,以吸光度Y 为纵坐标,质量浓度X (μg/mL)为横坐标,进行二次方程最小二乘法拟合回归,绘制标准曲线。得回归方程:Y = -0.001 03X2+0.150 22X +0.049 71,r=0.999 8。
1.3.4.3 重复性试验 按“1.3.4.2”项下方法制备同一批样品的溶液6 份,平行测定,RSD为1.6%。
1.3.4.4 精密度试验 取同一份供试品溶液连续测定6 次,吸收值RSD 为1.1%。
1.3.4.5 回收率试验 精密量取纳滤浓缩液1 mL于25 mL 量瓶中,加水稀释至刻度,摇匀。分别精密量取上述溶液2.5 mL 及对照品贮备液1 mL 于同一25 mL 量瓶中,纯化水稀释至刻度,摇匀,即得加样回收溶液。平行制备6 份,依法测定,计算回收率。回收率平均值为98.7% (n = 6),RSD为2.8%。
1.3.4.6 样品测定 精密量取消癌平注射液中间体(或纳滤浓缩液)1 ~10 mL (使供试品溶液吸收值在标准曲线范围内)于25 mL 量瓶中,纯化水稀释至刻度,摇匀,即得供试品溶液。精密吸取空白溶液与供试品溶液,照标准曲线的制备项下方法测定吸光度,根据标准曲线计算供试品中钾的含有量,按式(2)计算钾离子的去除率。

式中,Q 为钾离子的去除率;CN'为纳滤浓缩液中钾离子的质量浓度,单位为μg/mL;VN'为纳滤浓缩液体积,单位为mL;CT'为提取液中钾离子的质量浓度,单位为μg/mL;VT'为提取液体积,单位为mL。
2 结果
2.1 绿原酸的保留率 从表2 数据中可以看出,不同截留分子量的纳滤膜对绿原酸的保留率表现出一定差异,但是随着膜孔径的增大,绿原酸保留率呈现出下降的趋势,其中截留率分子量小于500 Da 时,绿原酸的保留率均能控制在93%以上,当选用600 ~800 Da 纳滤膜时,绿原酸损失明显,接近20%,高于150 ~300 Da 纳滤膜。
2.2 钾离子的去除率 对比不同孔径纳滤膜的钾离子去除效果,从表2 数据中可以看出,3 种纳滤膜中钾离子均有较高的透过率,均高于74%,但是150 ~300Da 纳滤膜浓缩液中钾离子质量浓度高达383.2 μg/mL,而300 ~500 Da 及600 ~800 Da纳滤膜浓缩液中钾离子质量浓度均低于220 μg/mL,且去除率均高于150 ~300 Da 纳滤膜。
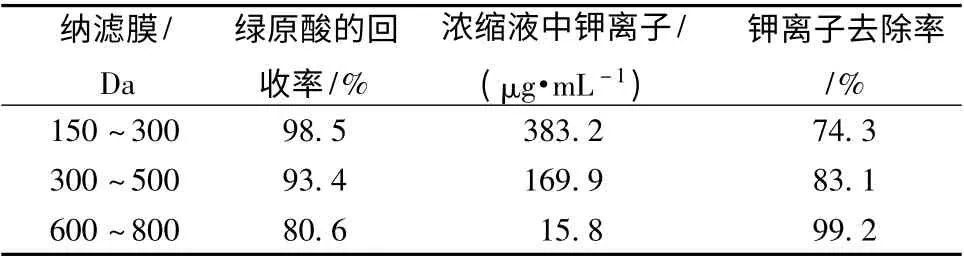
表2 不同纳滤膜的绿原酸保留率及钾离子去除率Tab.2 Rates of chlorogenic acid retention and K + removal by different nanofiltration membranes
2.3 钾离子去除的纳滤工艺优选 以消癌平注射液中间体中有效成分绿原酸的保留率及钾离子去除率作为纳滤浓缩工艺优选的评价指标,但是分析表2 中数据可以得出,绿原酸的保留和钾离子的去除是一对难以解决的技术矛盾,在保障注射剂中钾离子质量浓度小于《中国药典》2010 版规定(220 μg/mL)时的同时,可以选择截留分子量为300 ~500 Da 及600 ~800 Da 纳滤膜,其中600 ~800 Da纳滤膜的绿原酸损失明显,故选择截留分子量为300 ~500 Da 纳滤膜去除消癌平注射液中的钾离子。
3 讨论
消癌平注射液在实际生产中,多采用电渗析法去除通关藤提取液中的钾离子,但是绿原酸及部分甾体皂苷类成分损失严重,而电渗析处理后需要进一步的加热浓缩,又进而降低了有效成分绿原酸的质量浓度,导致目前存在钾离子超标的注射剂品种,多以有效成分损失为代价来保障注射剂的用药安全性。
纳滤技术具有常温操作,不破坏热敏性成分的优势[12],在消癌平注射液中间体浓缩中具有明显的技术优势。虽然在离子去除的同时,绿原酸有少量损失,但是与目前常用的电渗析法或离子交换树脂法比较,则优势明显。600 ~800 Da 纳滤膜对消癌平注射液中间体浓缩时,钾离子的去除率高达99.3%,虽然绿原酸的保留率在80%左右,但是随着通关藤提取液的浓缩,浓缩液中绿原酸浓度升高的同时,其膜透过量也会相应提高,损失量增加,因此本实验中采用“浓缩液中加入3 倍体积纯净水继续纳滤,重复3 次”的纳滤浓缩方法,如果减少药液的稀释倍数与重复纳滤次数,绿原酸的损失会下降,但是钾离子的去除效率则难以保证,但是增加药液的稀释倍数与重复纳滤次数,在引起有效成分损失的同时,生产效率也会大幅降低。
虽然纳滤技术在中药制剂生产中的浓缩应用尚处于起步阶段,但是其具有良好的应用前景,在去除有害物质的同时,提升中药注射剂质量。但是,随着纳滤技术的逐步推广,首先需要考虑纳滤膜在使用中膜材质与药液之间的兼容性,不能因为膜材质的脱落危害注射剂的安全性,从而限制了纳滤技术的推广应用;其次纳滤膜使用方法的规范性,从而保证注射剂产品质量的均一性。纳滤技术的种种优势决定了其应用潜力,但是在实际的推广中必须根据中药提取液中成分的结构特点,选择适宜的纳滤浓缩方式。
[1] 李迩娜,王 芳,钦 松,等. 消癌平注射液抗肿瘤作用机制研究进展[J]. 中国中医药信息杂志,2012,19(9):111-112.
[2] 徐丽君,魏世超,邹 欣,等. 黄芩注射液去钾离子工艺研究[J]. 医药导报,2002,S1:11.
[3] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010,附录ⅠⅩS.
[4] 钟跃宽,郝鹏彬,孙晶波,等. 红花注射液去除钾离子不同工艺对比研究[J]. 临床合理用药,2013,6(4B):31-32.
[5] 崔崇威,纪 峰,唐小辉,等. 纳滤膜法生产桶装饮用水与提高水资源利用率[J]. 哈尔滨工业大学学报,2007,39(2):258-261.
[6] 韩少卿,叶 骥,薛 强,等. 超滤和纳滤膜分离技术提取螺旋霉素[J]. 中国抗生素杂志,2005,30(1):52-55.
[7] 胡立新,崔朝亮,程新华,等. 利用膜分离技术对牛初乳进行除菌浓缩的研究[J]. 食品科技,2007,(3):90-92.
[8] 牟旭凤,白庆中,陈红盛,等. 聚合物辅助超滤/纳滤技术处理模拟放射性废水[J]. 给水排水,2006,32 (S1):174-177.
[9] 温瑞卿,李东辉,王 鑫. HPLC 法和聚类分析法探讨不同厂家消癌平片中绿原酸含量的一致性和稳定性[J]. 中成药,2011,32(11):2021-2023.
[10] 温瑞卿,李东辉,韩 杰,等. 消癌平片中绿原酸测定的影响因素和优化研究[J]. 中成药,2012,34 (4):762-764.
[11] 聂黎行,金红宇,林瑞超,等. 原子吸收分光光度法测定红花注射液中钾的含量[J]. 药物分析杂志,2010,30(3):468-470.
[12] Murakami A N N,Amboni R D M C,Prudêncio E S,et al.Concentration of biologically active compounds extracted from Ilex paraguariensis St. Hil. By nanofiltration[J]. Food Chem,2013,141(1):60-65.
