昭通金帅苹果中总黄酮提取及抗氧化研究
2015-01-12李会端耿仕香
李会端,崔 旭,耿仕香
(楚雄师范学院化学与生命科学学院,云南 楚雄 675000)
前言
黄酮类化合物是植物次级代谢产物,广泛存在于天然植物中,因其具有消炎杀菌、抗氧化、抗病毒、提高人体免疫力等药效,在医药和临床应用领域具有潜在应用前景[1-5]。苹果中富含类黄酮化合物,Tsao等采用液相色谱法测定了八个苹果品种中的类黄酮含量,测定结果显示苹果皮中的类黄酮含量在834.2-2300.3mg·kg-1,而果肉中的类黄酮含量在15-605.6 mg·kg-1,不难分析得出苹果中的总黄酮化合物主要集中在果皮部分,果肉和果心中的含量远低于果皮[6]。由于多数类黄酮没有标准品,文献中报道的苹果中总黄酮的含量测定多采用分光光度法[7-8]。聂继云等对苹果中总黄酮提取实验条件进行了优化,用分光光度法测定了苹果果实中总黄酮含量[9]。文献中还报道了超声波辅助法提取苹果中总黄酮的相关研究工作[10]。
虽然文献报道的研究数据表明苹果中总黄酮类化合物集中分布在果皮,然而苹果果皮中总黄酮的提取和含量测定的研究却鲜有报道[10-12],本文初次尝试选用云南昭通金帅苹果为原料,采用乙醇浸提苹果皮中总黄酮,设计单因素和正交实验优化浸提工艺条件,以芦丁为对照,采用紫外-分光光度法测定提取液中总黄酮含量,初步探究苹果皮黄酮提取液对羟自由基的抑制活性,为苹果营养成分的鉴定和开发利用提供黄酮分布和含量的基础实验数据参考。
1.材料与方法
1.1 原料、试剂与仪器
昭通金帅苹果(采自昭通云南),采摘苹果→洗净苹果果皮→自然阴干→粉碎→备用。
芦丁、盐酸、锌粉、亚硝酸钠、三氯化铝、硼酸、硝酸铝、无水乙醇、氢氧化钠、BHT等均为分析纯。CP214c电子天平 (奥豪斯仪器上海有限公司)、DFY-500摇摆式高速中药粉碎机、HH-S2S 水浴恒温锅、容量瓶、吸量管、SHZ-IIIA真空泵、分光光度计、恒温干燥箱等。
1.2 实验方法
1.2.1 总黄酮提取率的计算方法
以芦丁为对照,紫外分光光度法测定昭通金帅苹果皮浸提液中总黄酮的含量。测试原理及过程如下:移取一定体积的苹果皮浸提液配置待测液,先后加入5%亚硝酸钠溶液、10%硝酸铝溶液和4%氢氧化钠溶液,浸提液中总黄酮碱性条件与铝盐形成稳定络合物,此络合物在510nm处有稳定的特征吸收峰,且吸光度值与测试液中总黄酮浓度服从朗伯-比尔定律。根据芦丁标准曲线,将所测样品吸光度值代入线性回归方程求出测试样品液中总黄酮浓度,计算提取物中总黄酮的含量。
设原料中黄酮类化合物的含量为x,稀释后测试液总黄酮浓度为C;原浸提液总黄酮浓度为C0。

1.2.2 总黄酮对羟基自由基的抑制活性
参照Fenton体系,H2O2与Fe2+混合可活化氧自由基·OH,若向Fenton体系中加入水杨酸,水杨酸与·OH反应产生510nm处有特征强吸收峰的有色络合物。若向Fenton体系中加入具有·OH抑制活性的总黄酮,竞争效应使得有色络合物生成量减少。固定反应时间,在510nm处测含有总黄酮浸提液的吸光度值,与空白液对照,进而间接测定总黄酮浸提液对·OH的抑制活性。
·OH抑制活性计算公式:清除率 (%)=[A0- (Ax-Ax0)]/A0×100%
其中:A0为空白液吸光度;Ax为含有总黄酮浸提液的体系吸光度;Ax0为不加H2O2含有总黄酮浸提液的本底吸光度。
2.实验与结果分析
2.1 芦丁标准溶液的制备,标准曲线的绘制和最大吸收波长的选择
2.1.1 制备芦丁标准溶液
准确称取0.0100 g芦丁,在105℃干燥箱中恒重半小时,取出加浓度为75%乙醇置于小烧杯中溶解,冷却至室温,转移至50mL容量瓶中,用相同浓度的乙醇溶液洗涤烧杯,将洗涤液合并转移定容至标定刻度,制得0.20 mg·mL-1芦丁标准溶液,备用。
2.1.2 选择最大吸收波长
用吸量管分别准确吸取1.00 mL芦丁溶液和苹果皮总黄酮浸提液于50mL容量瓶中,先后加入5%的NaNO21.00mL,10%的Al(NO3)34.00mL,4%的NaOH 4.00mL,最后用75%乙醇定容至50mL,振荡混匀,静置。试剂空白作参比,在375~620nm波段范围扫描测定吸光度,确定测定最大吸收峰波长。芦丁溶液和苹果皮总黄酮浸提液的吸收光谱如图1所示,开始阶段随着扫描波长增加,吸光度值单调递增,510nm波长处测得最大吸收峰;再增加扫描波长,吸光度开始降低。故确定510nm为苹果皮总黄酮的最大吸收波长。

图1 芦丁标准溶液和总黄酮提取液的吸收光谱Fig.1 The absorption spectrum of diagram of rutin solution and total flavonoids extracts from apple
2.1.3 芦丁标准曲线的绘制
分别用吸量管准确移取0.00mL,0.50mL,1.50mL,2.50mL,3.50mL,4.50mL,5.50mL芦丁溶液于七支50mL容量瓶中,先后加入1.00mL 5%的NaNO2;4.00mL 10%的Al(NO3)3;4.00mL 4%的NaOH,振荡混匀;最后用75%乙醇定容,振荡摇匀,静置片刻。试剂空白为参比,在510nm处测定吸光度,吸光度对芦丁浓度作图,绘制标准曲线。由标准曲线计算回归方程为A=-0.00853+12.6C,线性相关系数为R2=0.9991。

图2 芦丁溶液标准曲线Fig.2 The standard curve of rutin solution
2.2 苹果果皮中总黄酮提取及定性实验
2.2.1 苹果果皮中总黄酮的提取
称取1.0000g原料于锥形瓶中,加入20.0mL浓度为75%的乙醇溶解,放入65℃恒温水浴锅中浸提2h,过滤,用10mL 75%乙醇洗涤滤渣3次。将滤液与洗涤液合并转移至50mL容量瓶中,最后用75%乙醇定容,即得总黄酮提取液,备用。
2.2.2 总黄酮提取液定性实验
盐酸-锌粉反应:分别移取1.00mL总黄酮浸提液、芦丁溶液于两支小试管中,滴加几滴浓盐酸,少许锌粉,振荡,观察。铝盐反应:分别移取1.00mL总黄酮浸提液、芦丁溶液,滴加几滴1%硝酸铝溶液,振荡,观察。浓硫酸反应:分别移取1.00mL总黄酮浸提液、芦丁溶液,滴加几滴浓硫酸,振荡,观察。浓氨水反应:分别移取1.00mL总黄酮浸提液、芦丁溶液,滴加几滴浓氨水,振荡,观察。
2.2.3 定性实验结果及分析
苹果皮总黄酮浸提液和芦丁溶液的显色反应结果如表1,苹果皮浸提液与芦丁的显色反应现象一致,说明昭通金帅苹果皮中含有黄酮类化合物。

表1 总黄酮提取液与芦丁标准溶液的显色反应Tab.1 Chromogenic reaction of flavonoids extracts and rutin solution
2.3 单因素实验及结果分析
2.3.1 浸提温度对总黄酮提取率的影响
分别称取1.0000g苹果皮粉末于五支锥形瓶中,固定料液比为1∶20(g/mL),即用20mL浓度为75%乙醇,在温度分别为45℃、55℃、65℃、75℃和85℃的恒温水浴中浸提2h。过滤,用10~15mL 75%乙醇洗涤滤渣至少三次。合并滤液和洗涤液,转移至50mL容量瓶,最后用75%乙醇定容。浸提液的显色反应和吸光度的测定过程参考文献[13]。做三组平行试验,将吸光度平均值代入线性回归方程,计算苹果皮中总黄酮提取率。

图3 浸提温度对总黄酮提取率的影响Fig.3 Effection of temperature on the extraction ratio of total flavonoids
浸提温度对总黄酮提取率的影响如图3所示:当浸提温度低于65℃时,随着浸提温度升高,总黄酮提取率也逐渐增大。浸提温度65℃,总黄酮提取率最高 (3.18%),浸提温度超过65℃,总黄酮提取率开始降低。苹果果皮中总黄酮提取的较佳温度为65℃。
2.3.2 浸提时间对总黄酮提取率的影响
分别准确称取1.0000g苹果果皮粉末于五支锥形瓶中,固定料液比为1∶20(g/mL),即用20mL浓度为75%乙醇,在65℃的恒温水浴中分别浸提1.0h,1.5h,2.0h,2.5h,3.0h。过滤,用10~15mL 75%乙醇洗涤滤渣至少三次。合并滤液和洗涤液,转移至50mL容量瓶,最后用75%乙醇定容。浸提液的显色反应和吸光度的测定过程参考文献[13]。做三组平行试验,将吸光度平均值代入线性回归方程,计算苹果皮中总黄酮提取率。

图4 浸提时间对总黄酮提取率的影响Fig.4 Effection of time on the extraction ratio of total flavonoids
浸提时间对总黄酮提取率的影响如图4所示:当浸提时间小于2.0 h时,浸提时间越长,总黄酮提取率越高;浸提时间为2.0h时总黄酮提取率最高 (4.23%);当浸提时间超过2.0h后,延长浸提时间,总黄酮提取率开始降低。苹果果皮中总黄酮提取的较佳浸提时间为2.0h。
2.3.3 提取剂浓度对总黄酮提取率的影响
分别准确称取1.0000g苹果果皮粉末于五支锥形瓶中,固定料液比为1∶20(g/mL),即用20mL乙醇,在65℃的恒温水浴中浸提2.0h,改变提取剂乙醇的浓度分别为55%,65%,75%,85%,95%。过滤,用10~15mL 75%乙醇洗涤滤渣至少三次。合并滤液和洗涤液,转移至50mL容量瓶,最后用75%乙醇定容。浸提液的显色反应和吸光度的测定过程参考文献[13]。做三组平行试验,将吸光度平均值代入线性回归方程,计算苹果皮中总黄酮提取率。提取剂浓度对总黄酮提取率的影响如图5所示:当乙醇浓度较低时,总黄酮提取率随乙醇浓度增大单调递增;乙醇浓度超过75%,总黄酮提取率随乙醇浓度增加而降低。苹果果皮中总黄酮提取的较佳提取剂浓度为75%,总黄酮提取率最高 (6.3%)。

图5 乙醇浓度对总黄酮提取率的影响Fig.5 Effection of ethanol concentration on the extraction ratio of total flavonoids
2.3.4 料液比对总黄酮提取率的影响
分别准确称取1.0000g苹果果皮粉末于五支锥形瓶中,分别用10、15、20、25、30 mL浓度为75%的乙醇,在65℃恒温水浴中浸提2.0h。过滤,用10~15mL 75%乙醇洗涤滤渣至少三次。合并滤液和洗涤液,转移至50mL容量瓶,最后用75%乙醇定容。浸提液的显色反应和吸光度的测定过程参考文献[13]。做三组平行试验,将吸光度平均值代入线性回归方程,计算苹果皮中总黄酮提取率。料液比对总黄酮提取率的影响如图6所示:当料液比小于1∶20时,随料液比增大,总黄酮提取率也逐渐增大;当料液比为1∶20时,测定总黄酮提取率最高 (5.6%);当料液比大于1∶20时,随着料液比增加,总黄酮提取率反而下降。苹果果皮中总黄酮提取的较佳料液比为1∶20。

图6 料液比对总黄酮提取率的影响Fig.6 Effection of solid-liquid ratio on the extraction ratio of total flavonoids
2.4 正交实验及结果分析
基于上述的单因素实验结果,选定浸提温度、浸提时间、提取剂浓度和料液比四个单因素,每个因素设定三个水平,设计L9(34)表进行正交实验,优化苹果皮中总黄酮浸提工艺的实验条件。相应地因素水平表和正交实验结果分别见表2和表3。

表2 L9(34)正交实验因素与水平设计Tab.2 Factors and levels of L9(34)orthogonal experiment
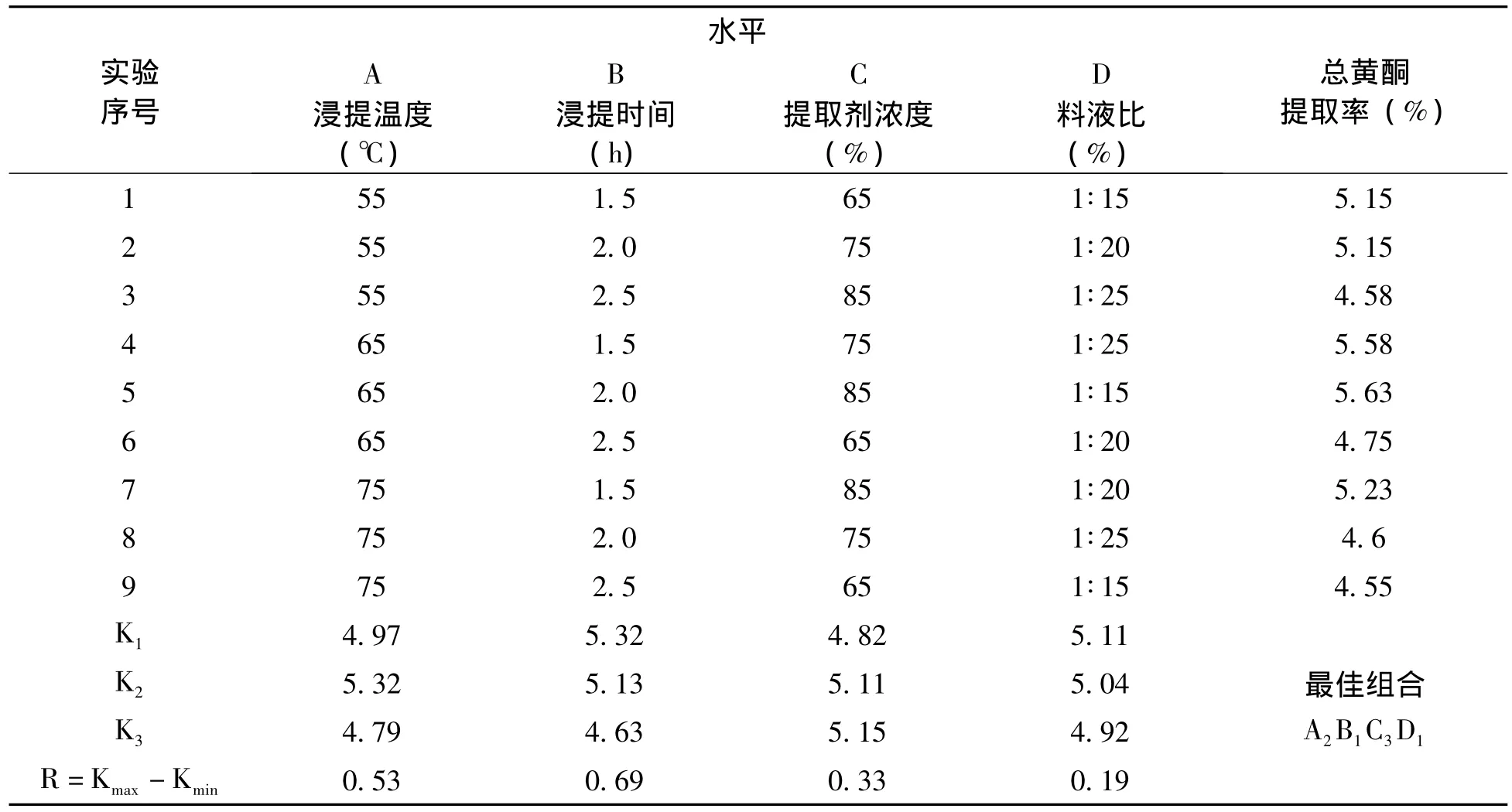
表3 正交实验结果Tab.3 The result of orthogonal experiment
正交实验结果显示,以总黄酮提取率为考察指标,乙醇浸提昭通金帅苹果果皮中总黄酮最优实验条件组合是A2B1C3D1。即浸提温度为65℃,浸提时间为1.5h,乙醇浓度为85%,料液比1∶15。在正交实验所确定的最优实验条件下,测得的苹果皮中总黄酮的最高提取率为5.63%。正交实验选定的四个单因素对总黄酮提取率的影响主次关系为B(浸提时间)﹥A(浸提温度)﹥C(提取剂浓度)﹥D(料液比),浸提时间对总黄酮提取率影响最大,其次是浸提温度,再次是提取剂浓度,料液比的影响最小。按照正交实验所确定的最佳浸提工艺实验条件做三组平行实验,苹果皮总黄酮的平均提取率为5.63%,验证实验结果见表4。

表4 苹果中总黄酮的提取率Tab.4 Extraction ratio of total flavonoids in apple
2.5 苹果果皮中总黄酮对羟自由基的清除活性研究
中的Fenton体系:在10mL比色管中依次加入2.00mL 9mmol/L的FeSO4,2.00mL 9mmol/L的水杨酸-乙醇,再分别加入0.2、0.4、0.6、0.8、1.0mL苹果皮总黄酮浸提液,加入2.00mL 8.8mmol/L H2O2启动反应,最后加蒸馏水定容,在37℃恒温水浴锅中反应30min。以空白试剂作参比,在510nm处测吸光度。参考上述体系和反应条件,不加H2O2,测苹果皮总黄酮浸提液的本底吸收。做三组平行实验,计算浸提液总黄酮对羟自由基的抑制活性:

A0为空白对照液吸光度;Ax为含浸提液的吸光度;Ax0为不加H2O2浸提液的本底吸光度。
以BHT(二丁基羟基甲苯)为对照,比较两种抗氧化剂对·OH的清除活性。实验结果如图7所示。

图7 总黄酮提取液和BHT对羟自由基清除活性比较Fig.7 Scavenging activity comparison of total flavonoids and BHT
羟自由基的清除活性对照试验结果显示苹果皮中总黄酮浸提液对·OH有清除活性,且清除率随总黄酮浸提液体积增加而增大,且总黄酮浸提液对·OH的清除活性高于相同浓度相同体积的BHT。
3.结论
本文选用乙醇浸提法提取昭通金帅苹果果皮中的总黄酮,设计单因素实验探究了浸提温度、浸提时间、提取剂浓度、料液比对苹果果皮中总黄酮提取率的影响,设计正交实验得出苹果果皮中总黄酮提取的较佳实验条件为:浸提温度65℃、浸提时间1.5h、乙醇浓度为85%、料液比为1∶15,在此条件下,总黄酮的提取率为5.63%。
贾金霞等测得两种栽培方法培育出的同一品种苹果果皮中总黄酮含量分别为2.3%和9.9%;李红、张元湖等测得苹果果皮中的总黄酮含量为3.66%。而本文测得昭通金帅苹果果皮中的总黄酮含量为5.63%。可见,原料产地不同、培育方法不同,苹果果皮中的总黄酮含量差异很大。
本文还初步探究了苹果皮总黄酮浸提液对羟自由基的清除活性,与BHT的对照实验结果显示,总黄酮提取液对羟自由基的清除活性要高于相同浓度相同体积的BHT。
参考文献:
[1]张岩,曹国杰,张燕,等.黄酮类化合物的提取以及检测方法的研究进展 [J].食品研究与开发,2008,29(1):154—157.
[2]陈孝刚,王志良,王彧,等.花生壳总黄酮提取及其对自由基清除作用的研究[J].辽宁中医药大学学报,2010,(4):35—38.
[3]Cook N C,Samman S.Flavonoids-Chemistry,metabolism,cardioprotective effects,and dietary sources[J].Journal of Nutritional Biochemistry,1996,7:66—76.
[4]解庆范,纪艳,林瑶琴.橡皮树中总黄酮提取工艺及清除·OH自由基能力的研究[J].海峡医药杂志,2011,23(7):205—208.
[5]朱慧,马瑞君,吴双,等.薇甘菊总黄酮的提取及清除羟自由基活性的测定 [J].食品科学,2010,(6):70—73.
[6]Tsao R,Yang R,Young J C,et al.Polyphenolic profiles in eight apple cultivars using highperformance liquid chromatography(HPLC) [J].Journal of Agricultural and Food Chemistry,2003,51:6347—6353.
[7]王建华,韩雅珊,戴蕴青.果蔬中黄酮类化合物含量的测定 [J].中国果品研究,1994,4:23—25.
[8]Fawbush F,Nock J F,Watkins C B.Antioxidant contents and activity of 1 -methylcyclopropene(1-MCP) -treated Empire apples in air and controlled atmosphere storage[J].Postharvest Biology and Technology,2009,52:30—37.
[9]聂继云,吕德国,李静,等.分光光度计法测定苹果果实总黄酮含量的条件优化 [J].果树学报,2010,27(3):466—470.
[10]焦岩,常影.超声波辅助提取苹果皮中的总黄酮工艺条件的优化[J].食品工业科技,2012,33(9):283—286.
[11]李红,张元湖.苹果果实中总黄酮的提取方法优化研究 [J].山东农业大学学报,2003,34(4):471—474.
[12]贾金霞,李宁,郑艳涛,等.两种栽培方法苹果总黄酮含量测定[J].郑州大学学报,2012,2:47—51.
[13]崔旭,李会端.酶辅助法提取大青叶中总黄酮及抗氧化性研究 [J].楚雄师范学院学报,2014,29(06):46—52.
