杜仲叶黄酮苷元水解及富集纯化工艺研究
2015-01-11王志宏雷明盛史丽娟周云雷彭密军
王志宏,彭 胜,雷明盛,2,3,郑 阳,史丽娟,周云雷,彭密军
1 吉首大学 林产化工工程湖南省重点实验室 杜仲湖南省工程实验室,张家界 427000;2武汉大学中南医院,武汉 430071;3 湖南省张家界市人民医院,张家界 427000
杜仲(Eucommia ulmoides Oliv.)是杜仲科杜仲属植物,因其具有“三降六抗一增”功效而成为我国特有的名贵滋补药材[1]。它富含多种活性成分,如黄酮类、木脂素类、苯丙素类和环烯醚萜类等。其中黄酮类物质有明显的保护心血管、抗氧化、清除自由基、增强免疫以及抗肿瘤等功效[2]。我国杜仲种植范围广泛,杜仲叶资源丰富易得,且杜仲叶中总黄酮含量较高。研究表明,杜仲叶富含多种黄酮:槲皮素、山奈酚、山奈酚-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷、槲皮素-3-O-芸香糖苷、槲皮素-3-半乳糖苷、槲皮素-3-O-葡萄糖基-(1→2)-阿拉伯糖苷或槲皮素-3-O-木糖基-(1→2)-葡萄糖苷等[6,7]。但在消化、吸收和代谢过程中,黄酮苷元比黄酮苷的效价高[3-5]。赵德义[8]等人通过比较杜仲黄酮和银杏黄酮的HPLC 指纹图谱发现,杜仲黄酮苷元主要为槲皮素和山奈酚。酸水解可将糖苷水解为对应的苷元,而聚酰胺树脂对含酚羟基化合物的富集纯化效果较好,为富集总黄酮的理想材料,采用聚酰胺树脂富集杜仲总黄酮的条件较为成熟[9],但是对杜仲黄酮苷元的富集工艺却很少见报道。本研究参考《中国药典》中银杏黄酮的水解工艺,对杜仲黄酮的水解工艺进行考察[10],进而考察苷元的富集工艺,以期为杜仲叶资源优势向经济优势转化寻找有效途径。
1 材料与方法
1.1 材料和试剂
杜仲叶于2013 年11 月份采集于吉首大学张家界校区,经廖博儒研究员鉴定为杜仲;将采集的矮林杜仲叶,经微波杀青,50 ℃烘干,粉碎,过80 目筛,备用;槲皮素(Quercetin,批号YA0806YB13,上海源叶生物科技有限公司,纯度≥98%,HPLC);山奈酚(Kaempferol,批号20130329,上海源叶生物科技有限公司,纯度≥98%,HPLC);甲醇为色谱纯(国药集团化学试剂有限公司);聚酰胺树脂(60~100目)、盐酸、氢氧化钠、醋酸、95%乙醇等均为分析纯。
1.2 仪器和设备
LC-20A 高效液相色谱仪,日本岛津;U-3900 紫外分光光度计,日本HITCHI 公司;BM400 型数显电热恒温水浴锅,日本YAMATO;AEL-405M 型万分之一天平,日本SHIMADZU;GZX-9146-MBE 数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 杜仲黄酮苷元HPLC 检测条件
高效液相色谱条件:Diamonsil C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:甲醇-0.2%磷酸(63∶37);检测波长:370 nm;流速:1.0 mL/min;柱温:30 ℃;进样量20 μL[11]。
1.3.2 杜仲黄酮苷元TLC 检测条件
薄层色谱检测条件:展开剂为甲苯-乙酸乙酯-甲酸(9∶3∶1),显色剂为1%三氯化铝-乙醇溶液,显色、晾干后置于紫外灯365 nm 下检测[12]。
1.3.3 杜仲叶提取物样品制备方法
取适量杜仲叶样品,加入95%乙醇,超声辅助提取60 min,过滤,滤液保存备用;滤渣再用60%乙醇以1∶20(g/mL)料液比超声辅助提取60 min,过滤;合并两次滤液,减压浓缩、冷冻干燥,得杜仲叶提取物[13]。
1.3.4 水解杜仲黄酮单因素与正交试验
实验以黄酮苷元槲皮素和山奈酚总和为考察指标。准确称取20 mg 杜仲叶提取物,经参考相关文献及在预实验的基础上[14,15],确定单因素考察如下:料液比(mg/mL)为4∶1、3.5∶1、3∶1、2.5∶1、2∶1、1.5∶1 和1∶1,水解时间考察范围为2、3、4、5、6 h,水解温度考查范围为50、60、70、80、90 ℃,盐酸浓度为3、4、5、6、7、8 mol/L。依据单因素实验结果,选择L9(34)的正交实验表进行设计,确定水解杜仲黄酮制备黄酮苷元的最佳工艺,试验重复3 次。
1.3.5 黄酮苷元的富集工艺
在最佳工艺条件下制备适量的杜仲叶黄酮苷元样品,减压浓缩后水洗至中性;用甲醇洗涤滤饼,收集滤液,薄层色谱检测至无目标物止。将滤液与适量聚酰胺树脂混合,进行充分的静态吸附,混合装柱,再经梯度洗脱,薄层色谱跟踪检测,收集相同洗脱液,合并、减压浓缩、冷冻干燥得粗样品,HPLC 法测其含量;然后将所得粗产品通过干法上样进行聚酰胺二次富集,HPLC 跟踪检测,收集相同洗脱液,合并、减压浓缩、冷冻干燥得纯化样品,测定样品中黄酮苷元含量。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对水解的影响
在70 ℃条件下,以甲醇∶盐酸为4∶1,盐酸浓度为6 mol/L,将料液比(mg/mL)设为4∶1、3.5∶1、3∶1、2.5∶1、2∶1、1.5∶1 和1∶1,水解4 h,结果见图1(A)。随料液比比例增加,水解所得黄酮苷元的含量呈增加趋势,但当料液比达到2∶1 之后,苷元含量基本趋于平稳。原因可能是料液比较大时,水解反应及物质的溶解在体系中不充分;当溶剂比例提高到一定程度,即料液比较小时,虽然反应较为彻底,但体系中酸含量的增大又会对苷元造成影响,并从节约实验成本角度出发,所以将实验料液比选为2∶1(mg/mL)。
2.1.2 水解温度对水解的影响
以料液比为2∶1(mg/mL),甲醇∶盐酸为4∶1,盐酸浓度为6 mol/L,温度为50、60、70、80、90 ℃,水解4 h,考察不同水解温度对水解黄酮苷元含量的影响,结果见图1(B)。由图可知,随温度的升高,分子运动加快,有利于水解反应的进行,但是温度过高,副反应增加,杂质相应增多。综合考虑,确定水解温度为70 ℃左右。
2.1.3 水解时间对水解的影响
按照水解条件,以料液比为2∶1(mg/mL),甲醇∶盐酸为4∶1,盐酸浓度为6 mol/L,水解温度为70℃,水解时间分别为2、3、4、5、6 h,进行水解,考察不同水解时间对水解得黄酮苷元含量的影响,结果见图1(C)。由图可得,水解4 h 时,苷元的含量达到最大值,当水解反应时间较短时,水解不充分;水解时间过长时,在体系中会产生副产物从而影响苷元的含量。综合考虑,确定水解时间为4 h 左右。
2.1.4 盐酸浓度对水解的影响
在70 ℃下,料液比为2∶1(mg/mL),盐酸浓度分别为3、4、5、6、7、8 mol/L,甲醇∶盐酸为4∶1,水解4 h,考察不同盐酸浓度对水解得黄酮苷元含量的影响,结果见图1(D)。由图可得,随盐酸浓度的增加,苷元含量呈现先增后减的趋势,原因可能为酸虽然可以使糖苷键质子化,但是酸的浓度过高,可能会对黄酮的母核造成破坏,降低黄酮苷元的含量。综合考虑,确定水解盐酸浓度为6 mol/L 左右。
2.2 正交试验结果
根据单因素实验结果,以水解温度、水解时间和盐酸浓度3 个指标作为正交实验考察的优化水平,每个因素选取3 个因素水平,进行L9(34)正交实验,因素水平表见表1,正交实验结果见表2。
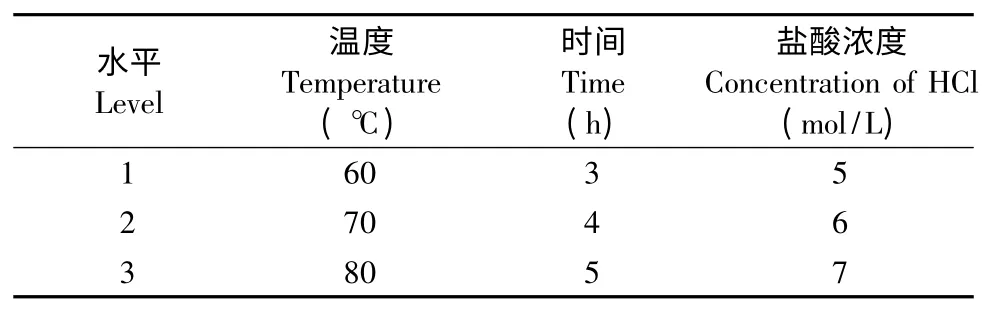
表1 因素水平表Table 1 Factors and levels for orthogonal experiments
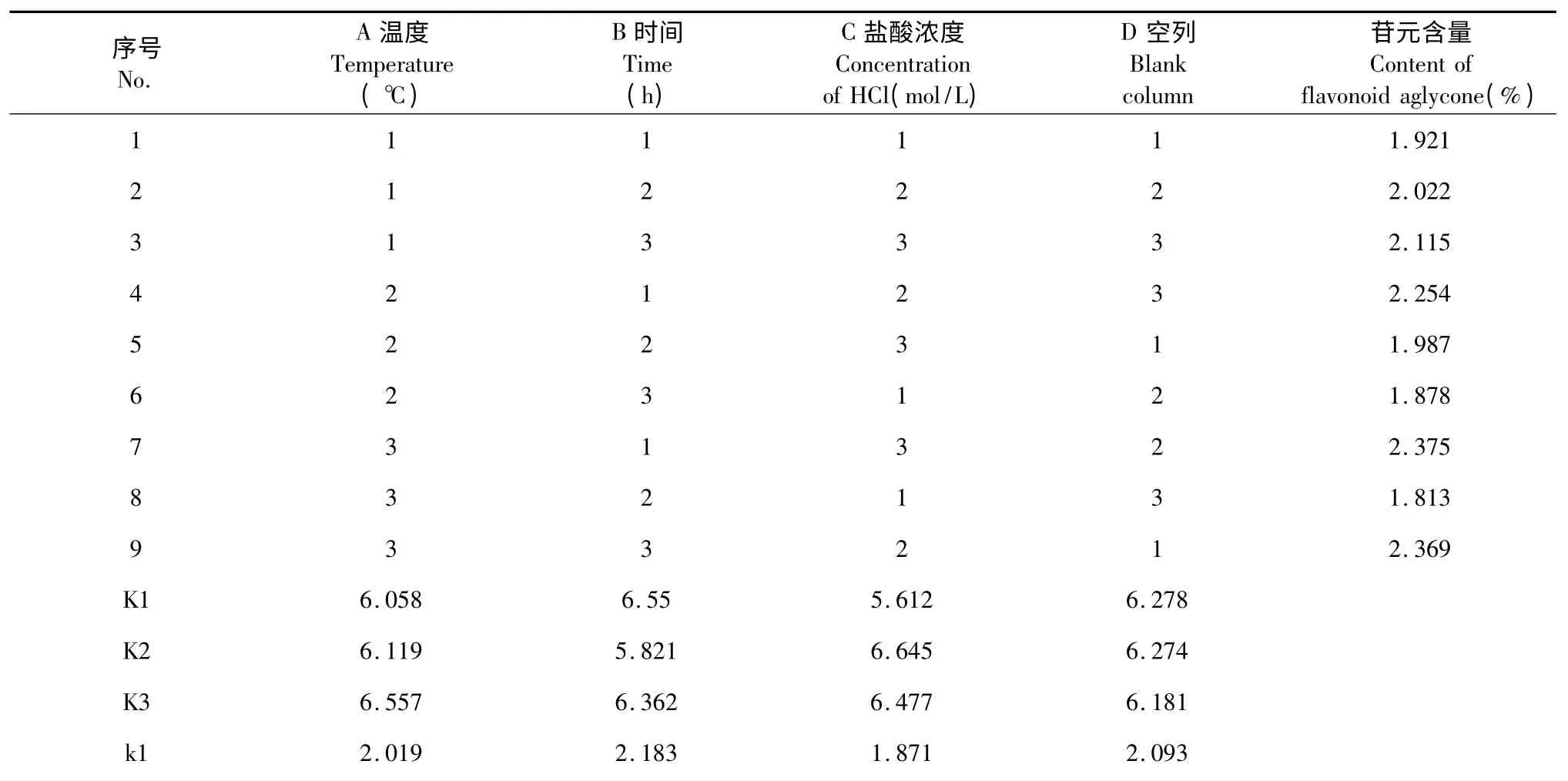
表2 正交实验结果Table 2 Results of orthogonal experiments

根据正交实验的结果,极差分析发现,对杜仲黄酮水解工艺的影响较大的因素依次为盐酸浓度、水解时间和水解温度。方差分析结果见表3,由方差分析可得,水解温度和水解时间对实验结果的影响达到显著,而盐酸浓度对黄酮苷元含量的影响达到极显著。综合考虑,确定最佳的水解工艺为A3B1C2,即水解温度为80 ℃,水解时间为3 h,盐酸浓度为6 mol/L。
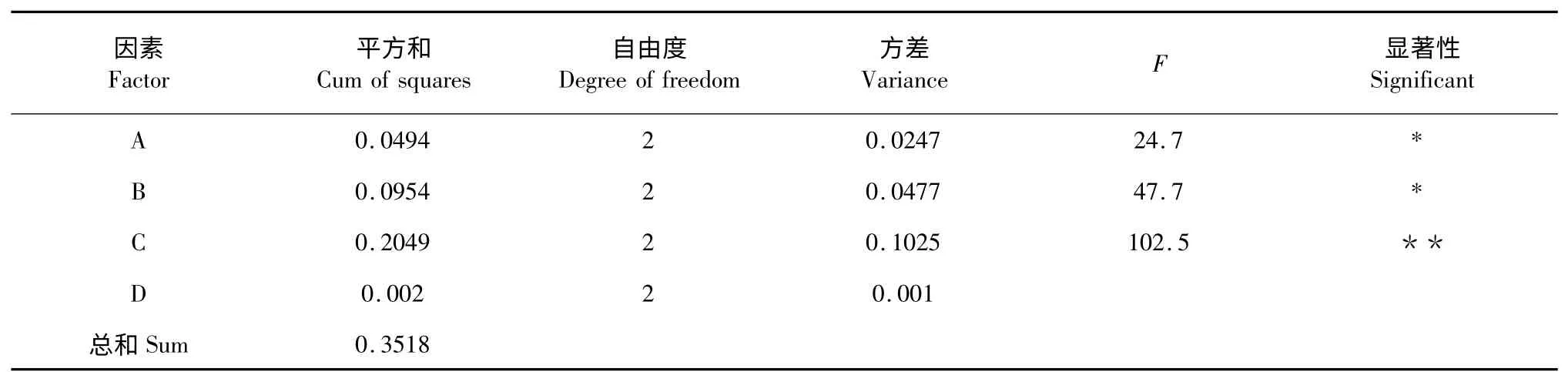
表3 方差分析表Table 3 Table of variance analysis
按照正交试验结果,在料液比为2∶1(mg/mL)条件下,将A3B1C2的工艺重复3 次,对该工艺的稳定性进行验证,苷元的含量为2.512%(RSD=0.059%),表明该工艺的重现性与稳定性较好,达到优化目的。
杜仲叶中黄酮苷元主要为槲皮素和山奈酚,但是其游离存在的含量很低,经测定槲皮素的含量为0.021%,而山奈酚为0.005%,本实验通过酸水解杜仲黄酮使水解物中的苷元含量达到2.512%,提高近100 倍。
2.3 杜仲黄酮苷元富集工艺的研究
采用不同梯度的甲醇-水体系以2 BV/h 的流速进行洗脱,最后用100%甲醇洗至检测不到苷元为止。洗脱液用薄层色谱跟踪检测,结果见表4。50%甲醇洗脱液中已经含有苷元,含量极低,70%~100%洗脱液中苷元含量较高,合并洗脱液,浓缩,冷冻干燥,得黄酮苷元粗品。HPLC 法测其纯度为12.87%。

表4 薄层检测洗脱液中苷元的结果Table 4 Enriching result of flavonoid aglycone in the eluent with TLC
将上述所得样品干法上样,进行聚酰胺二次富集。洗脱流速为2 BV/h,每梯度洗脱体积为5 BV,经水与低浓度的醇溶液除杂之后,用70%、90%和100%甲醇溶液洗脱,每50 mL 收集一次。实验发现,50%甲醇洗脱液中并未检测到杜仲黄酮苷元,黄酮苷元主要存在70%~100%洗脱液中,洗脱曲线如图2 所示,合并成分相似的洗脱液,减压浓缩,得杜仲黄酮苷元样品。经HPLC 法测定,黄酮苷元纯度达63.19%,黄酮苷元纯度较一步富集提升将近5 倍。
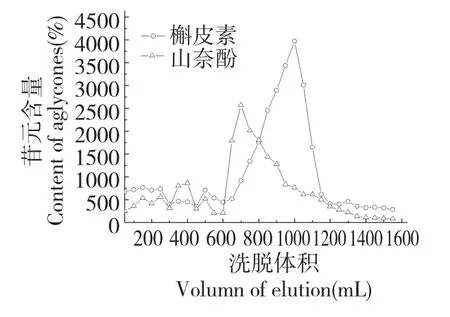
图2 黄酮苷元的洗脱曲线Fig.2 The elution curve of flavonoid aglycone
3 结论
杜仲黄酮苷元可由酸水解制备所得,在料液比为2∶1(mg/mL),水解温度80 ℃,水解时间3 h,盐酸浓度6 mol/L 的最佳工艺参数条件下,黄酮苷元最高含量可达2.512%;对水解液减压浓缩、脱酸处理,经聚酰胺一步富集,黄酮苷元含量为12.87%,所得样品再干法上样,经聚酰胺两步富集之后,杜仲黄酮苷元含量可达63.19%。
1 Li FD(李芳东),Du HY(杜红岩).Eucommia ulmoides Oliv.(杜仲).Beijing:China Press of Traditional Chinese Medicine,2001.1-2.
2 Wang ZH(王志宏),Peng S(彭胜),Lei MS(雷明盛),et al.Advances in studies on biological activity of Eucommia ulmoides Oliv.Nat Prod Res Dev(天然产物研究与开发),2013,25:1302-1309.
3 Izumi T,Piskula,Osawas,et al.Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans.J Nutri Edu,2000,137:1695-1699.
4 Lv P(吕鹏),Huang XW(黄晓舞),Lv QJ(吕秋军).Advances in studies on absorption,distribution,metabolism,of flavonoids.China J Chin Mater Med(中国中药杂志),2007,32:1961-1964.
5 Crepy V,Morand C,Besson C,et al.Quercetin,butnot its glycolsides,is absorption from the rat stomach.J Agric Food Chem,2002,50:618-621.
6 Cheng J(成军),Zhao YY(赵玉英),Cui YX(崔玉新),et al.Study on flavonoids from leave of Eucommia ulmoides Oliv.China J Chin Mater Med(中国中药杂志),2000,25:284-286.
7 Fu GM(付桂明),Wan Y(万茵),Zhang S(张硕),et al.Supercritical fluid extraction technology of flavonoids in Eucommia ulmoides Oliv.leaves and components analysis by LC-MS.Food Sci(食品科学),2007,28:128-131.
8 Zhao DY(赵德义),Gao JM(高锦明),Xu AX(许爱遐),et al.Study on fingerprint analysis and bioactive function of Eucommia ulmoides flavonoids.Acta Bot Boreal Occident Sin(西北植物学报),2003,23:1988-1990.
9 Lin CM(林春梅).Separation and purification of total flavones in burdock leaves by polyamide column.Food Ferment Ind(食品发酵与工业),2014,20:236-238.
10 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China.Beijing:China Medical Science Press,2010.Vol I,296.
11 Wang ZH(王志宏),Zhou YL(周云雷),Peng S(彭胜),et al.Simultaneous determination of flavonoid aglycones from Eucommia ulmoides Oliv.by HPLC.Appl Chem Ind(应用化工),2014,43:950-953.
12 Li CH(李春红),Pan H(潘红),He B(何兵),et al.TLC identification of quercetin and kaempferol and determination of total flavonoids in Toona sinensis leaves.J Luzhou Med Coll(泸州医学学报),2010,33:247-249.
13 Lv Q(吕强),Peng MJ(彭密军),Peng S(彭胜),et al.Effect of different planting modes on contents of active ingredients in leaves,twig and bark in Eucommia ulmoides.Econ Forest Res(经济林研究),2012,30:73-76.
14 Wu Y(伍毅).Study on preparation of flavone aglycone from Ginkgo biloba L.extract.Wuxi:Jiangnan University(江南大学),MSc.2008.
15 Li FG,Zhou H,Sun DL,et al.An efficient method for the simultaneous determination of three flayone aglycones in FlosChrysanthemi by acid hydrolysis and HPLC.J Chin Pharm Sci,2009,18:55-59.
