NIRS 结合TQ 软件快速测定山茱萸中莫诺苷的含量
2015-01-11龚海燕谢彩侠雷敬卫陈志红段小彦
龚海燕,李 珊,谢彩侠,雷敬卫,陈志红,段小彦,白 雁*
1 河南中医学院,郑州 450048;2 郑州市食品药品检验所,郑州 450007
山茱萸是山茱萸科植物山茱萸(Cornus officinalis Sieb.et Zucc.)的干燥果肉。有补益肝肾,固涩精气的功效[1],药理研究表明它具有免疫调节、降低血糖、抗菌、抗炎等作用[2]。山茱萸是常见中成药如六味地黄丸、金匮肾气丸等的主要原料,其质量直接影响这些药物的疗效和安全性。研究表明,其化学成分主要含有环烯醚萜苷、有机酸等[3]。近代研究表明环烯醚萜苷类为山茱萸中主要有效部位[4],而莫诺苷属环烯醚萜苷类,为山茱萸中主要药效成分,具有苦补健胃和预防糖尿病性血管病的作用[5]。2010 版《中国药典》一部中只对山茱萸药材中马钱苷成分进行了定量分析,然而马钱苷只是山茱萸中的主要有效成分之一。且有研究表明马钱苷与莫诺苷的化学结构相似,在炮制工艺中,二者可能有相互间结构转化,致使含量升高[6]。所以只测定马钱苷的含量是不能代表山茱萸药材的质量的,因此为了更好地控制山茱萸药材的质量,有必要建立测定莫诺苷的含量的快速方法。
近红外光谱(NIRS)分析技术样品前处理简单、无损、无污染,具有传统分析方法所不具有的优点,近年来广泛用于中药材定性判别和定量分析等方面[7,8]。研究表明偏最小二乘法适合中药复杂样品,特别是粉末样品的定量模型的建立[9,10]。本实验采用近红外光谱法与偏最小二乘法相结合的方法建立了快速测定山茱萸中莫诺苷的定量分析模型,为大批量山茱萸药材中莫诺苷的快速测定提供了一种新的绿色测定方法。
1 仪器与试剂
1.1 仪器
Thermo Nicolet 6700 型傅立叶变换近红外光谱仪(美国Thermo Nicolet 公司),配有InGaAs 检测器、外接积分球、样品旋转器、OMNIC 光谱采集软件和TQ8.0 分析软件;Waters2695 高效液相色谱仪(PDA 2996 紫外检测器);FW-200 型高速药材粉碎机(北京中兴伟业仪器有限公司);CS101-2D 电热鼓风干燥箱;MTTTLER TOLEDO XP205 十万分之一天平。
1.2 试剂
乙腈、甲醇为色谱纯,水为乐百氏纯净水。莫诺苷对照品(由成都曼斯特生物科技有限公司提供,纯度>98%),95 份山茱萸药材分别来自河南西峡、浙江、陕西,由河南中医学院陈随清教授鉴定为山茱萸科植物山茱萸(Cornus officinalis Sieb.et Zucc.)。
2 方法与结果
2.1 近红外光谱的采集
将山茱萸的干燥样品粉碎,过80 目筛,制成粉末样品,每份粉末样品取约4 g,放入石英样品杯中,摊平后以空气为参比,扣除背景,采集近红外光谱图。采集方式:积分球漫反射;扫描区间:4000~12000 cm-1;分辨率:8 cm-1;扫描次数:32 次;温度(25±2)℃,相对湿度30%~40%。每个样品扫描三次,取平均值作为样品NIR 光谱图。图1 是95 份山茱萸样品的近红外光谱叠加图。
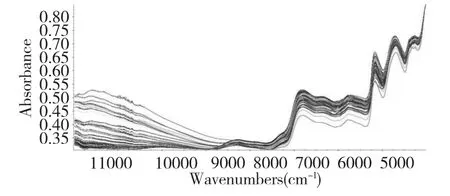
图1 95 份山茱萸样品的近红外光谱的叠加图Fig.1 NIR spectra of 95 Fructus Corni samples
2.2 山茱萸中莫诺苷的含量测定
2.2.1 对照品溶液的制备
精密称取莫诺苷对照品适量,加80%的甲醇制成浓度为151.40 μg/mL 的溶液,作为对照品溶液。
2.2.2 供试品溶液的制备
取本品粉末约0.1 g,精密称定,加入具塞锥形瓶中,精密加入80%的甲醇25 mL,称定重量,加热回流1 h,放冷,再称定重量,用80%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2.3 色谱条件及测定方法
大连依利特Hypersil ODS C18色谱柱;流动相为乙腈-水(11∶89),流速为1.0 mL/min,柱温30 ℃,检测波长为240 nm。进样体积10 μL,以保留时间定性,峰面积定量,外标法计算。每份样品平行做2次,以其平均值作为HPLC 参考值。
2.2.4 线性关系考察
精密量取标莫诺苷准液0.5、1.0、4.0、6.0、8.0、10.0 mL,置10 mL 容量瓶中,加80%甲醇稀释至刻度,按2.2.3 项下条件,精密吸取10 μL 分别注入高效液相色谱仪,以峰面积积分值y 为纵坐标,莫诺苷的含量x(μg/mL)为横坐标,绘制标准曲线,莫诺苷的标准曲线为:y=1.2E+6x-9100.3,R2=0.9998,在7.57~151.40 μg/mL 范围内线性关系良好。
2.2.5 精密度考察
精密量取151.40 μg/mL 的莫诺苷对照品溶液10 μL,进样6 次,测定峰面积,其相对标准偏差为0.56%,说明该方法精密度良好。
2.2.6 重复性考察
取同一样品,称取6 份,各0.1 g,精密称定,各按2.2.2 项下的制备方法制备供试品溶液,分别精密吸取10 μL 进样,测定莫诺苷的含量,其相对标准偏差RSD 值为1.56%。由此可见,采用本方法测定莫诺苷含量,重复性良好。
2.2.7 稳定性实验
取同一样品0.1006 g,按照2.2.2 项下方法制备供试品溶液,精密吸取10 μL,分别在0、2、4、8、12 h 进样,其莫诺苷的峰面积标准偏差为0.52%,结果表明莫诺苷在12 h 内稳定性良好。
2.2.8 加样回收率试验
精密称取已知含量(1.35%)的山茱萸约0.1 g,共6 份,分别精密称量对照品(1.35 mg),按照
2.2.2 项下方法制备供试品溶液,测定其含量,计算回收率,得平均回收率为98.56%,RSD 为1.03%。
3 山茱萸药材中莫诺苷定量模型的建立
对于复杂的天然产物的近红外定量模型的建立,通常采用偏最小二乘法(PLS)。本实验采用PLS 建立定量分析模型,并选择不同的预处理方法和不同的谱段,主因子数来建立定量校正模型。建模过程中常使用R2、RMSECV、RMSEC、RMSEP 为评价模型性能优良的参数,其中,R2指校正集样品由NIR 分析模型得到的预测值和参考值之间的相关性,R2越接近于1,表示分析模型对校正集预测越准确。RMSEC 指校正集样品由NIR 分析模型得到的预测值和参考值之间的标准偏差,RMSEC 值越小,说明所建模型对校正集预测效果越好[4]。RMSECV指模型通过内部交叉验证得到的校正标准偏差,体现模型的整体性能,RMSECV 值越小,校正集样品的预测结果越接近参考值。RMSEP 指验证集样品的NIR 预测值与参考值之间的标准偏差,RMSEP 值越小,验证集样品的预测结果越接近参考值。
3.1 山茱萸样品的选择
从收集到的的95 份样品中,根据其莫诺苷含量分布,选取78 个有代表性的样品组成校正集,剩余17 个样品为验证集。如表1 列出了校正集和验证集样品莫诺苷含量分布范围及其统计结果。

表1 校正集与验证集中莫诺苷的含量分布Table 1 Content distribution of calibration and validation set for morroniside
3.2 光谱的预处理
原始NIR 图谱(图1)可以看出,样品的平均近红外光谱极为相似,难以直接找出特征吸收带将其区分。此外,近红外光谱图有明显的散射漂移,且光谱信号易受样品粒度大小、密实度、噪音及光散射等因素影响。为了有效的消除各种噪音及测量误差对分析造成干扰,进而突显光谱中有用信息,研究中首先将原始图谱进行预处理。
由表2 以看出采用二阶导数(SD)+标准正态变换标量(SNV)+卷积平滑(SG)处理的光谱所建立的PLS 定量分析模型的R2为0.9845,为所建模型中最高,RMSEC、RMSECV 和RMSEP 分别为0.109、0.2641 和0.233,均为所建模型中最低,说明模型的内部结构、稳定性、拟合度和预测能力均相对较好,因此选定该光谱预处理条件为最佳条件。
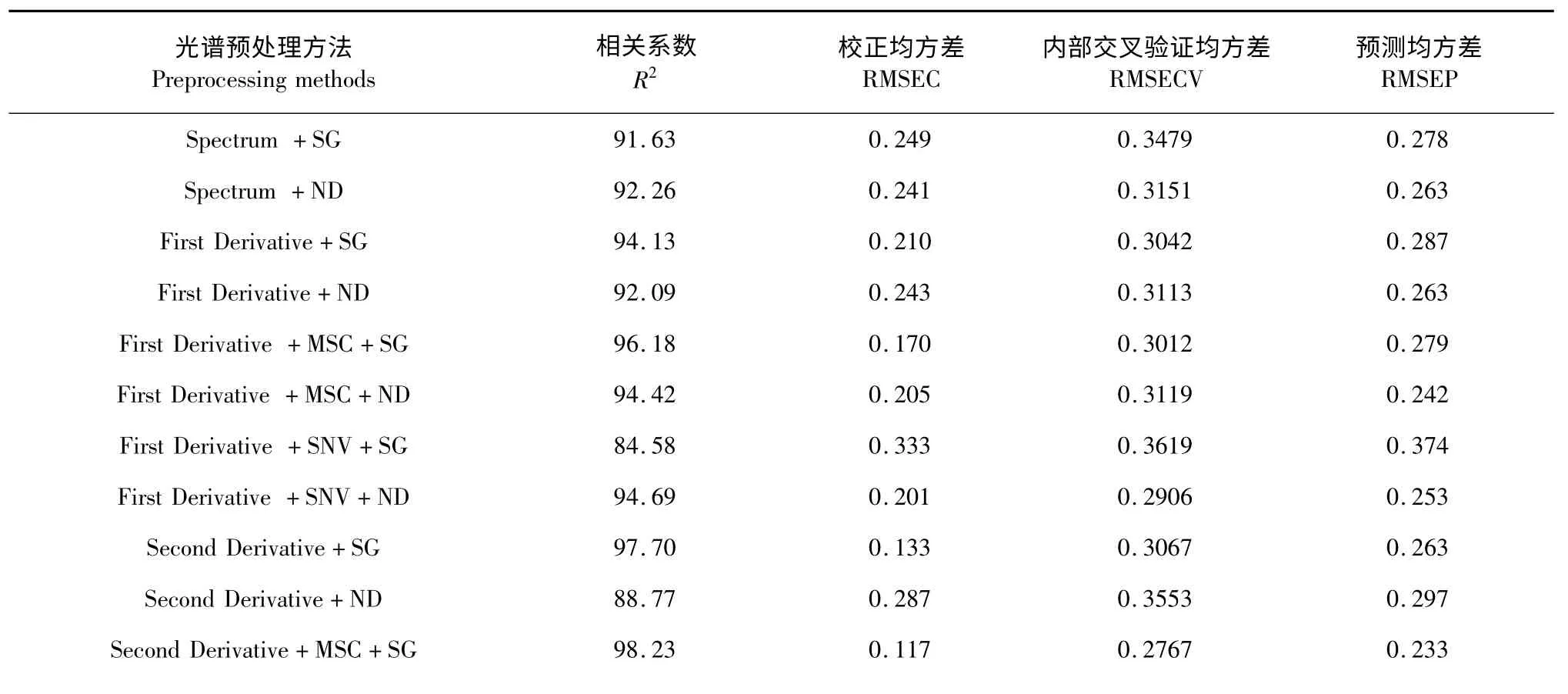
表2 不同光谱预处理方法对建模的影响Table 2 The effects of different preprocessing methods on model development

3.3 建模谱段的选择
由于样品近红外光谱谱峰重叠严重,用常规的线性分析方法无法分析。但经由二阶导数处理后,其吸收峰会变得尖锐,有效信息谱段更加明显。由表3 比较结果可以看出最佳建模波段为4011.21~8000.00 cm-1。图3 为样品在上述处理条件下的近红外光谱的二阶导数图谱。
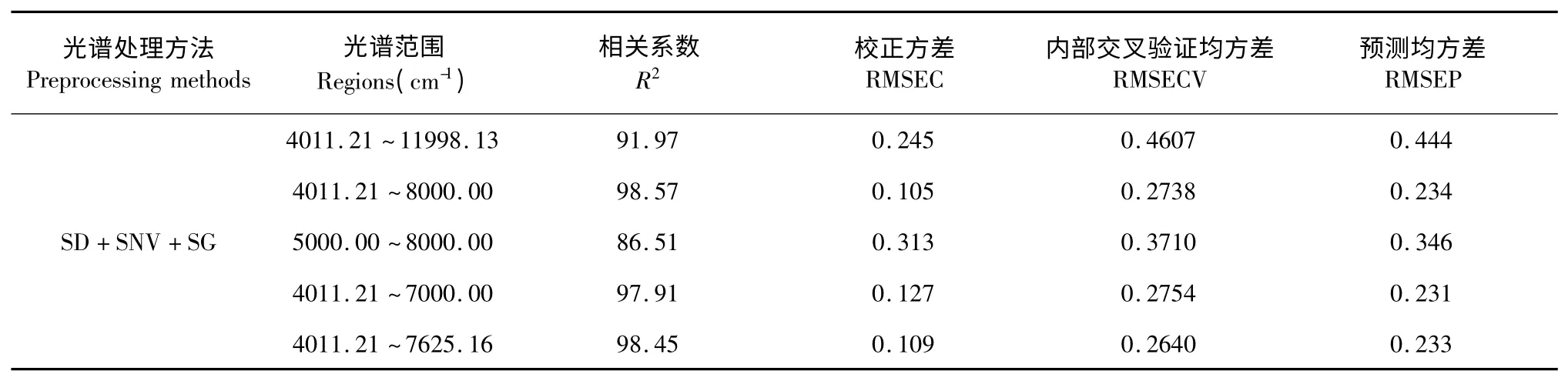
表3 建模波段对模型的影响Table 3 The effect of model performance by different regions
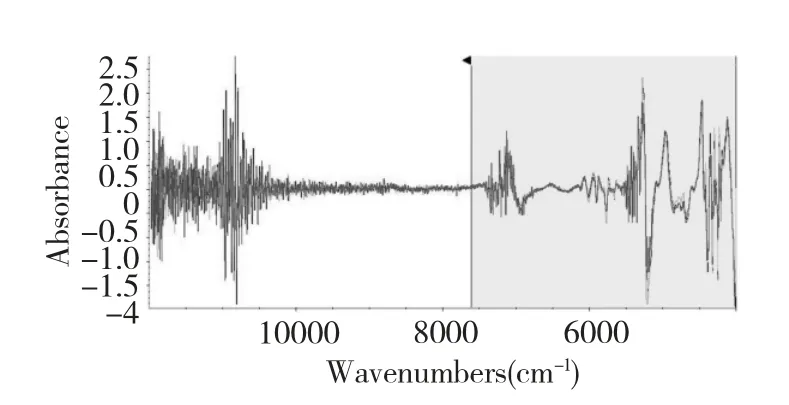
3 山茱萸样品在前处理后的近红外光谱的二阶导数图谱Fig.3 The second derivative spectrum of Fructus Corni samples
3.4 建模主成分的选择
主成分的选择直接关系到PLS 定量分析模型的实际预测能力。主因子数过少,会导致建模信息不全;主因子数过多会导致模型过拟合,这均会降低模型的预测能力。本实验用交互验证法,考察主因子数对RMSECV 的影响,选择最适主因子数。根据校正集RMSECV 与主成分数之间的相关图,如图4所示,当RMSECV 值最小为0.2738,所选主成分数最佳为10。
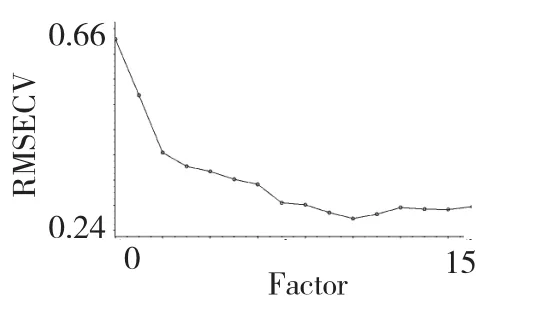
图4 校正集RMSECV 与主成分数之间的相关图Fig.4 Correlation plot of RMSECV values and different principal components
3.5 莫诺苷模型的建立
采用以上确定的最优条件,即PLS+SNV+二阶导数法光谱前处理方法,建模范围4011.21~8000.00 cm-1,选择10 个主成分建立最优校正模型。所建模型的校正集相关系数R2为0.9857,校正均方差RMSEC 为0.105,预测均方根偏差为0.234,其结果如图5、6 所示。
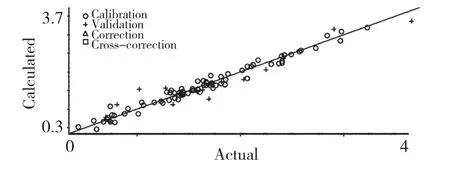
图5 校正集预测值与参考值之间的相关图Fig.5 Correlation between NIR predicted values and reference values
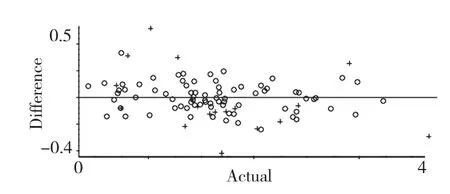
图6 预测绝对误差与参考值相关图Fig.6 Deviation between NIR predicted values and reference values
3.6 莫诺苷定量模型的验证
将17 份验证集样品的NIR 图谱输入定量分析模型,预测其莫诺苷含量,并与高效液相色谱法测得值进行比较,结果见表4。
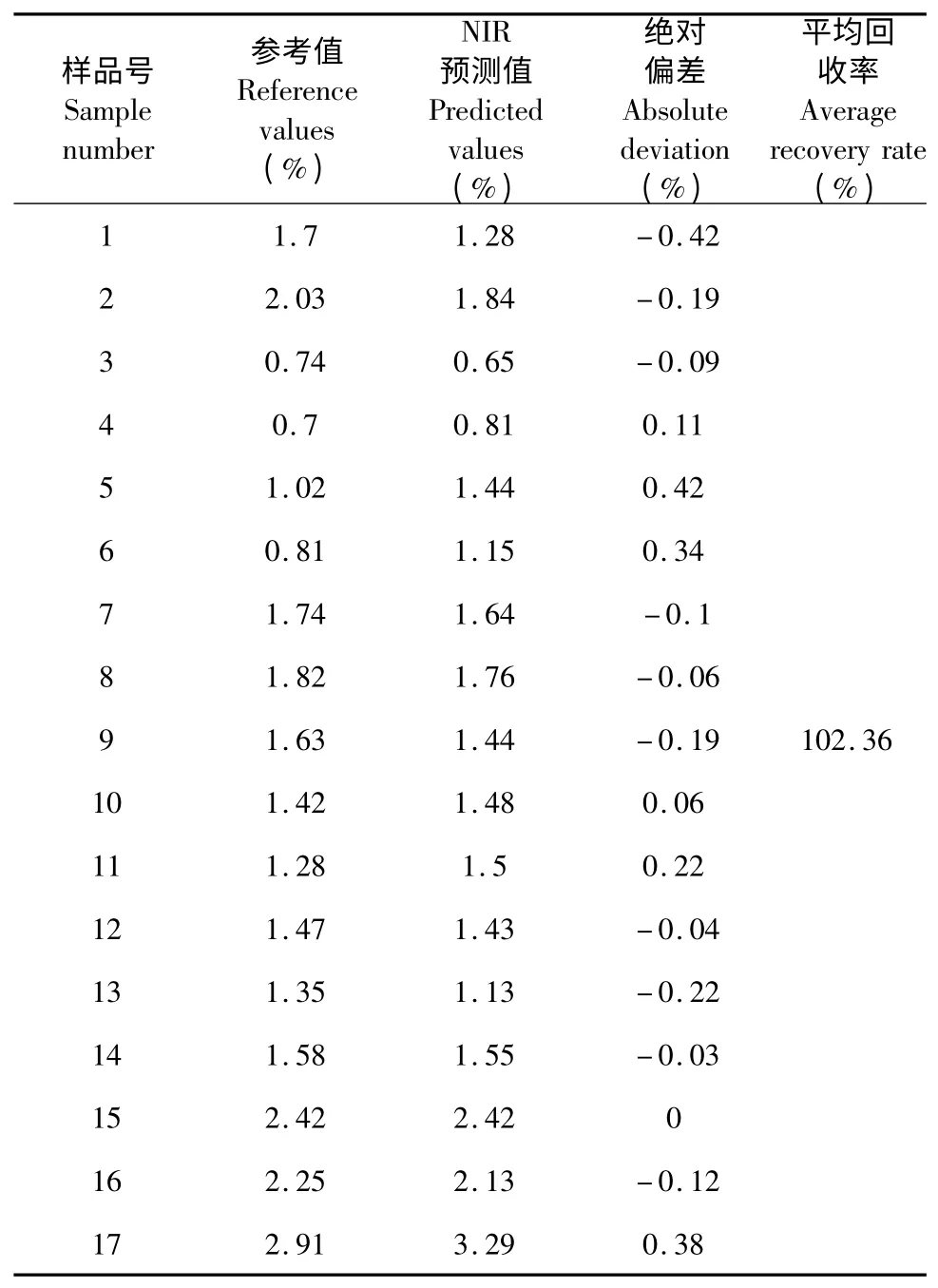
表4 NIR 预测值与高效液相色谱值的比较Table 4 Comparison of NIR predicted and conference values
由表4 知,最大绝对偏差0.42%,以验证集样品的NIR 预测值与HPLC 测定值的比值作为预测回收率,所得平均回收率102.36%,结果表明,利用近红外光谱技术测定山茱萸中莫诺苷的含量是可行的。
3.7 统计学分析
将17 个验证集样品NIR 预测值与高效液相色谱法所测得的分析值进行配对t 检验,结果显示t=-0.591,双侧P=0.563>0.05,按α=0.05 水准不拒绝H0,即说明两种方法的分析结果差别无统计学意义,表明该模型可用于预测其覆盖范围内的山茱萸中莫诺苷含量。
4 结论
在用高效液相色谱法测量山茱萸中莫诺苷时,选择流动相的时候,参考药典,以乙腈和水为流动相,来摸索其比例过程中发现,乙腈的比例越大,莫诺苷的保留时间越小,但不能完全分离,从乙腈:水=19∶81 开始,逐渐降低乙腈的比例,直到11∶89 才能将其完全分开,分离效果较好,因此选择该比例为最佳流动相条件。
中药材生长的环境不同,致使其内在成分有所差异,有效成分含量亦不相同,本研究能够为中药山茱萸的质量控制研究提供一种有效的研究途径和思路。通过NIRS 光谱法与化学计量学技术相结合,采用了偏最小二乘法,通过比较选择了最佳的近红外光谱的前处理方法、建模谱段和主因子数,建立了山茱萸中莫诺苷含量的定量校正模型,模型的预测能力较好。结果表明该方法快速、准确、无损、无污染,为制药企业山茱萸药材中莫诺苷快速分析提供了一种快速和绿色方法。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,26.
2 Dai JZ(戴建子),Zhang ZH(张志豪),Tang L(唐蕾),et al.Advance on chemical compositions and pharmacology of Cornus officinalis.China Pharm(中国药业),2006,15(2):74-78.
3 Zhang YE,Liu EH,Li HJ,et al.Chemical constituents from the fruit of Cornus officinalis.Chin J Nat Med(中国天然药物),2009,7:365-370.
4 Cao G,Zhang Y,Cong XD,et al.Research progress on the chemical constituents and pharmacological activities of Fructus Corni.J Chin Pharm Sci,2009,18:208-212.
5 Liu H(刘洪),Xu HQ(许惠琴).Advance in research of Fructus Corni officinalis and its main compositions.J Nanjing TCM Univ,2003,19:254-257.
6 Zhang ZL(张振凌),Zhao JY(赵建颖),Li J(李娟),et al.Function of getting rid of cores of Cornus officinalis Sieb.Et Zucc.and studies on method of processing in producing area.J Chin Med,2006,29:60-63.
7 Bai Y(白雁),Li S(李珊),Wang X(王星),et al.Determination of chlorogenic acid of honeysuckle by near-infrared spectroscopy rapidly.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(5):66-70.
8 Gong HY(龚海燕),Song RL(宋瑞丽),Bai Y(白雁),et al.The discrimination of Tiegun Yan using NIR combine conformity test.Comp App Chem(计算机与应用化学),2010,27:967-970.
9 Li R(李睿),Fan XL(樊夏雷),Zhou XH(周小华),et al.Identification of Aristolochia manshuriensis,Clematis armandi and Akebia trifoliate by near infrared diffuse reflectance spectra.Chin J Pharm(中国医药工业杂志),2011,42:933-937.
10 Bai Y,Zhang W,Xie CX,et al.Fast determination of active components in Scutellaria extract by NIRS combined with PLS.2012 International Conference on Biomedical Engineering and Biotechnology,1034-1038.
