不同处理方式对枸杞多糖抗氧化活性影响的研究
2015-01-11鲁晓丽慕家琪张自萍
鲁晓丽,慕家琪,张自萍
宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021
枸杞子为茄科(Solanaceae)植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实。近几十年来,许多学者对枸杞子进行了深入研究,发现它在调节免疫、抗衰老、抗肿瘤、降低血脂和血糖等方面表现出广阔的应用前景[1]。根据检索的文献可见,从中医到西医,从国内到国外,枸杞多糖(Lycium barbarum Polysaccharides,LBP)一直是近年来研究枸杞药理和保健作用的焦点[2,3]。现代科学研究表明,枸杞的药理作用与其生物活性成分枸杞多糖密切相关。枸杞多糖是一种非特异性免疫增强剂,具有增强免疫力、抗癌、防衰老、增加造血功能、防止遗传损伤等作用[4,5]。但是由于枸杞多糖制备过程可能存在原料、种属、地域、提取处理方法等方面的差异性,也可能是枸杞多糖蛋白质复合物的存在,所以枸杞多糖的相关研究重复性较差,对其活性的研究造成了一定的障碍。
有机溶剂洗涤法是枸杞多糖提取研究中普遍使用的一种化学脱水和脱色的方法[6]。冷冻干燥是使食品在低压、低温下进行水分蒸发,利用冰的升华原理,在高真空的环境条件下,将冻结食品中的水分不经过冰的融化直接从固态冰升华为水蒸气而使物料干燥。与其他脱水技术相比,冷冻干燥技术是能够保持食品物料营养成分最好的方法[7]。大孔吸附树脂脱色,通过物理吸附从水溶液中有选择性的吸附有机物。大孔吸附树脂有一定的选择性、强度好、产品纯度高、重复使用等特点[8],并且已成功地应用于工业脱色。
目前,关于枸杞多糖的处理方式和其生物活性的研究数不胜数,但是关于处理方式对其生物活性影响的研究少见报道,本实验通过DPPH 法和Fenton 法测定枸杞多糖对DPPH 自由基和羟自由基的清除率,研究有机溶剂洗涤法、冷冻干燥法、大孔吸附树脂脱色法三种处理方式对所得枸杞多糖生物活性的影响。以期为枸杞多糖的进一步开发利用提供新的实验数据和有价值的参考。
1 仪器与材料
1.1 仪器
RE-52A 旋转蒸发器,上海亚荣生化仪器厂;SHB-III 循环水式多用真空泵,郑州长城科工贸有限公司;回流提取装置;微型植物试样粉碎机,长沙步源制药机械设备有限公司;U-5100 比例光束分光光度计,日立高新技术公司。
1.2 材料与试剂
枸杞,购自宁夏中宁;Vc 对照品,天津傲然精细化工研究所;DPPH、磷酸缓冲液(pH 7.4)、邻菲罗啉、硫酸亚铁、H2O2、硫酸、苯酚、石油醚、乙醇、丙酮等均为分析纯。
2 实验方法
2.1 样品的前处理
将干燥的枸杞子,采用微型植物试样粉碎机进行粉碎,过40 目筛,得到枸杞粉末,备用。
2.2 供试品溶液的制备
[9]报道方法并稍作改进。称取枸杞粉末0.05 kg,置普通回流装置中,加入石油醚0.5 L,60 ℃回流脱脂3 次,每次1 h。滤出溶剂,残渣风干后加入80%乙醇0.5 L,60 ℃回流3 次,每次1h,回收乙醇。再70 ℃水提3 次,每次2 h,料液比1:10,合并水提滤液浓缩,以4 倍体积的95%乙醇沉淀,过夜,离心得沉淀物,以备采用不同处理方式进一步处理。
2.3 有机溶剂洗涤法
将2.2 所得沉淀物先后用95%乙醇、无水乙醇、丙酮洗涤数分钟,倾倒上清液,置于通风橱内挥干试剂[7],得到固形物样品Ⅰ。
2.4 冷冻干燥法
将2.2 得到的沉淀用水复溶,置于冷冻干燥机干燥[9],得到样品Ⅱ。
2.5 大孔树脂脱色法
将2.2 所得沉淀物用水复溶,经D318 大孔吸附树脂处理(相关实验另投它稿),得到样品Ⅲ。
2.6 抗氧化活性的测定
2.6.1 清除DPPH 自由基能力的测定
在文献[10]报道的基础上稍作改进,称取4 mg DPPH 至250 mL 容量瓶中,用极少量的乙醇溶解,然后加入50%乙醇定容至刻度。分别取不同浓度的样品溶液2 mL,加入2 mL DPPH 溶液,室温反应30 min,至525 nm 波长处测得吸光度,为Ai。根据以下公式求得DPPH 自由基清除率。
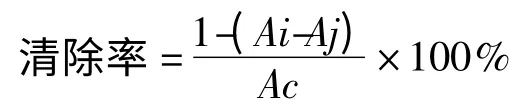
式中,Ac:未加样品的DPPH 溶液;Aj:空白吸光度;Ai:样品溶液的吸光度。
2.6.2 清除羟自由基能力的测定
在文献[10,11]报道的基础上稍作改进,在试管中分别加入2 mL pH7.4 的磷酸盐缓冲液,0.3 mL 2.5 mmol/L 邻菲罗啉溶液,充分混匀后,加入0.2 mL 7.5 mmol/L FeSO4溶液,每加一管立即摇匀。然后向其中加入提取溶液,混匀,再加入1 mL 0.1%H2O2,最后补充体积至8 mL。另再做损伤管和未损伤管,其中损伤管中加入0.1% H2O2,未损伤管不加H2O2,最后补充各管体积至8 mL,于37 ℃下保温1 h,在510 nm 波长处测吸光度计算清除率:
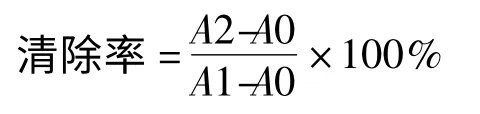
其中,A0:未损伤管的吸光度;A1:损伤管的吸光度;A2:样品液的吸光度。
2.7 统计学分析
采用SPSS17.0 统计软件进行统计分析,数据以标准差(±s)表示,组间比较采用t 检验,P<0.05有统计学意义。
3 结果与分析
3.1 不同处理方式对枸杞多糖清除DPPH 自由基能力的影响
二苯代苦味酰基自由基(DPPH·)是一种很稳定的以氮为中心的自由基,若受试物能将其清除,则表明受试物具有降低羟自由基、烷基自由基或过氧化自由基或打断脂质过氧化链反应的作用。通过测定清除DPPH 自由基的方法表征枸杞多糖清除自由基的活性。如图1 所示,不同处理方式得到枸杞多糖对DPPH 自由基的清除效果。
由图1 显示可知,枸杞多糖有显著的清除DPPH 自由基能力,且表现出良好的剂量依赖关系,在质量浓度为0.5~2.5 mg/mL 时,枸杞多糖对DPPH自由基的清除能力低于Vc,但随着质量浓度的升高其清除能力增强,不断的接近于Vc。以Vc 为对照,不同处理方式得到的枸杞多糖对DPPH 自由基的清除能力是不同的,并且存在极显著差异(P<0.01)。清除能力大小顺序:样品Ⅲ>样品Ⅱ>样品Ⅰ。其中2 mg/mL 样品Ⅲ清除能力最高,达62.46%。
枸杞多糖对DPPH 自由基清除能力可能是由于多糖中的羟基具有供氢质体能力。样品1 在有机溶剂洗涤过程中,有机溶剂对多糖的结构有一定程度的破坏,可能会导致其清除DPPH·的能力有所下降;冷冻干燥处理得到的样品Ⅱ,主要以枸杞多糖与色素复合物的形式存在,结构比较稳定,导致其对DPPH 自由基的清除能力减弱;经过大孔吸附树脂处理后得到的样品Ⅲ,可以去除一些色素、蛋白以及盐分子,大部分以游离的多糖分子存在,与DPPH 自由基结合,清除能力增强,抗氧化能力升高。
3.2 不同处理方式对枸杞多糖清除羟基自由基能力的影响
不同处理方式得到枸杞多糖对羟自由基的清除效果如图2。
羟自由基是自由基当中化学性质最活泼、毒性最大的一种。如图2 所示:多糖样品的清除能力随浓度的增大而增大,一定范围内成量效关系。低浓度枸杞多糖对羟自由基的清除能力大于Vc,随着浓度的不断增加,其清除能力逐渐低于Vc。并且枸杞多糖的处理方式不同,其清除能力不同。在质量浓度为1 mg/mL 时,以Vc 为对照,样品Ⅱ及样品Ⅲ对羟基的清除能力存在显著差异(P<0.05);其中,样品Ⅰ清除羟自由基能力不显著(P>0.05);样品Ⅱ对羟自由基的清除能力达到92.02%,略高于样品Ⅰ和样品Ⅲ,并且样品Ⅰ和样品Ⅲ的清除羟自由基的能力相当。可能原因就是有机溶剂使得样品Ⅰ中一些糖蛋白变性,枸杞多糖的构象有一定程度的损坏并且其中枸杞多糖的含量较低;样品Ⅱ尽可能的保存了所有营养物质(枸杞多糖、色素、糖蛋白等),它们对羟自由基都有不同程度的清除作用;样品Ⅲ经过大孔吸附树脂的初步分离纯化,其枸杞多糖纯度较其他两种都高,但其清除羟自由基能力低于样品Ⅱ,说明并不是枸杞多糖纯度越高,对羟自由基清除作用就越大。
4 讨论
由实验可以得出不同方式处理的枸杞多糖对DPPH 自由基和羟基自由基均有不同程度的清除能力,且表现出良好的剂量依赖关系。
有机溶剂洗涤法不仅对枸杞多糖的分子构象有一定的损害,导致其含量以及清除DPPH 和羟自由基的能力不高;而且有机溶剂具有挥发性,可以引起实验员中枢神经畸形或慢性中毒。所以在多糖抗氧化活性以及其他生物活性的研究中不建议使用此方法。
冷冻干燥法作为物理方法,能够保持食品物料营养成分最好的方法。能较好地保持食品原来的形状,减少食品色、香、味及营养成分的损失,减少了食品中脂质的氧化,冻干制品中蒸发掉的水分空间还存在,因而具有多孔结构,速溶性和快速复水性很好,在升华过程中溶于水的可溶性物质就地析出,溶于水的无机盐还均匀地存在,避免了一般干燥方法中因物料内部水分向表面迁移而营养损失等现象。冷冻干燥法比较温和,保证了枸杞多糖构象的完整性,但是影响了枸杞多糖的纯度。但是对自由基清除作用的有效成分不明确,有待进一步研究。
大孔吸附树脂是一类不含交换基团且有大孔结构的高分子吸附树脂,是植物多糖分离纯化的一种有效方法。将游离的色素类化合物和蛋白质吸附,起到一种初步纯化的作用。同时其过程中避免不了的是会有少量枸杞多糖被吸附。但是最终对DPPH自由基的清除能力较其他两种方法的都高。对羟自由基的清除作用居中,说明并不是枸杞多糖纯度越高,对羟自由基清除作用就越大。
由此可见,不同处理方式影响了枸杞多糖的生物活性。研究者可以按自己的实验要求选择合适的处理方式,避免处理方式不当,影响枸杞多糖的生物活性。
参考文献
1 Amagase H,Farnsworth NR.A review of botanical characteristics,phytochemistry,clinical relevance in efficacy and safety of Lycium barbarum fruit(Goji).Food Res Int,2011,44:1702-1717.
2 Sun GJ(孙桂菊),Zuo PG(左平国).A research of Lycium barbarism polysaccharides in efficacy and application status.J Southeast Univ,Med Sci(东南大学学报,医学版),2010,29:209-215.
3 Yan XT(燕宪涛),Lu XG(路新国).Research progress in biological activity of LBP.Food Nutri China(中国食物与营养),2011,17(11):73-75.
4 Wu HT,He XJ,Hong YK,et al.Chemical characterization of Lycium bararum polysaccharides and its inhibition against liver oxidative injury of high-fat mice.Int J Biol Macromol,2010,46:540-543.
5 Liang B,Jin ML,Liu HB.Water-soluble polysaccharide from dried Lycium bararum fruits:isolation,structural features and antioxidant activity.Carbohydr Polym,2011,83:1947-1951.
6 Tian LM(田丽梅).Studies on extraction,isolation and composition of Lycium barbarum polysaccharides.Chin J Chin Mater Med(中国中药杂志),2006,31:1603-1607.
7 Ratti C.Hot air and freeze-drying of high-value foods:a review.J Food Eng,2001,49:311-319.
8 He BL(何炳林),Shi ZQ(史作清).The structure and properties of macroporous ion exchange resins and new type of adsorbents.Polym Bull(高分子通报),2005,4:13-19.
9 Zhu CP(朱彩平),Zhang SH(张声华).Extraction and composition of Lycium barbarum polysaccharide by GC.Mod Food Sci Technol(现代食品科技),2009,25:1327-1329.
10 Ma Q(马茜),Mu JQ(慕家琪),Zhang ZP(张自萍).Study on antioxidant activity of Cortinarius rufo-olivaceus.Acta Agric Boreali-occidentalis Sin(西北农业学报),2013,22:178-181.
11 Zhu Y(朱月),Tian HC(田海晨),Bi XD(毕晓丹).Elimination effects of Aster mosaic polysaccharide on OH·freeradical.Jiangsu Agric Sci(江苏农业科学),2012,40:302-303.
