深红酵母JLC 固态发酵废弃烟梗制备类胡萝卜素研究
2015-01-11郭大城张可可董贵彬张旭萍朱大恒
郭大城,张可可,董贵彬,张旭萍,刘 慧,朱大恒,席 宇*
1 河南省疾病预防与控制中心,郑州 450016;2郑州大学生命科学学院,郑州 450001
类胡萝卜素(carotenoids)是萜类化合物的羟基化衍生物,在生物体内具有抗炎、增强机体免疫力、防治肿瘤和治疗光敏性疾病等作用[1],因此在食品、化妆品、医药和饲料添加剂等行业有广泛的应用[2-4]。利用非粮廉价底物通过微生物的合成作用生产类胡萝卜素,降低生产成本是目前类胡萝卜素生产的一个研究热点[5]。烟梗是卷烟工业的一种废弃物,约占烟叶总重的20%~30%[6],大量的烟梗被废弃,造成资源浪费和环境污染[7,8]。烟梗中含有大量的可溶性糖类和氮类物质[9],因此对其进行资源化利用是非常重要的。目前WTS 多用来提取烟碱、果胶、茄尼醇[10-12],然而利用酵母发酵WTS生产类胡萝卜素尚未见报道。本实验以一株分离的富含类胡萝卜素的深红酵母(Rhodotorula rubra)JLC为出发菌株,以WTS 为主要基质,对影响菌株JLC发酵生产类胡萝卜素的因素利用PB 设计法进行考察,旨在为WTS 的资源化利用和天然类胡萝卜素的开发提供新思路。
1 材料与方法
1.1 材料及试剂
WTS 由河南天昌国际烟草有限公司提供,长度为0.2~5.0 cm,直径为0.15~0.50 cm。酵母粉和蛋白胨购自英国OXOID 公司,琼脂粉购自美国Sanland 公司,其余实验用试剂均为国产分析纯。
1.2 菌株及培养基
深红酵母JLC 保藏于郑州大学生命科学学院,其类胡萝卜素最大吸收波长485 nm。菌种保藏和种子液制备均采用烟梗提取液(tobacco stem extraction,TSE)培养基[13],其中固体培养基琼脂含量为2.0%。
1.3 仪器
生化培养箱(MJX-70,上海和呈仪器制造有限公司);电热鼓风干燥箱(101,北京中兴伟业仪器有限公司);立式高压灭菌器(YXQ-LS-30SII,上海博迅实业有限公司);双人双面净化工作台(SW-CJ-2F,苏州净化设备有限公司);紫外可见分光光度计(UV-2450,日本岛津);低温高速离心机(Avanti J-25,Beckman coulter);连续流动分析仪(AA3,德国布朗卢比公司);恒温数显水浴锅(XTMD-8222,上海精宏实验设备有限公司);电子分析天平(BS223S,北京赛多利斯仪器系统有限公司)。
1.4 方法
1.4.1 烟梗预处理及成分分析
WTS 于60 ℃干燥箱中干燥2 h,去除较粗和较长烟梗后过16 目标准筛除尘备用。处理后WTS 采用连续流动分析仪进行主要成分分析。
1.4.2 种子液制备
从菌种斜面挑取一环培养物接种到含有80 mL种子培养液的250 mL 三角瓶中,置于恒温摇床30℃和180 rpm 条件下培养36 h,获得的培养物作为固态发酵的种子液。
1.4.3 固态发酵方法
分别称取一定量的WTS 置于250 mL 三角瓶中,按照1.4.4 实验设计加入相应量的添加物,以WTS 与水1∶3 的比例加入自来水后混匀室温浸泡10 h,121 ℃灭菌20 min。冷却后无菌操作将种子液以不同的接种量接种到上述三角瓶中,混合均匀,恒温30 ℃静置培养,每24 h 轻摇1 次。
1.4.4 PB 设计实验方案
PB 设计可利用最少的实验次数,从考查的众多因素中快速筛选出主要影响效应[3]。根据单因子实验结果,PB 设计(N=12)对影响WTS 发酵生产类胡萝卜素的10 种因素进行了评估,10 种因素的编码、单位及水平见表1。
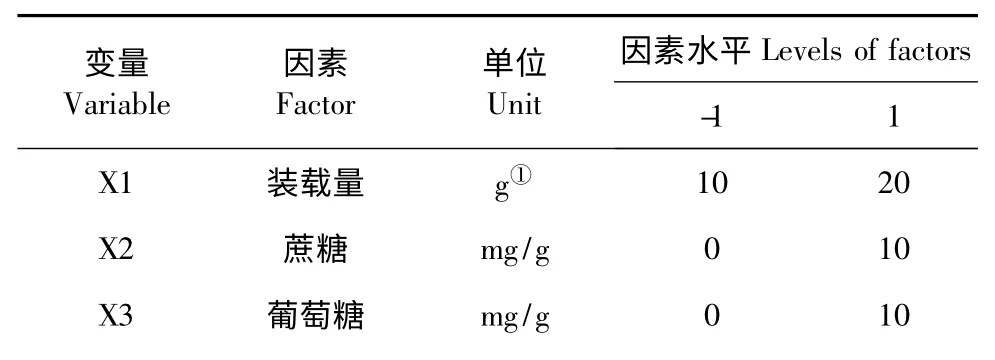
表1 PB 设计试验所选因子、水平及编码Table 1 The two levels of variables and codes used in the Plackett-Burman design
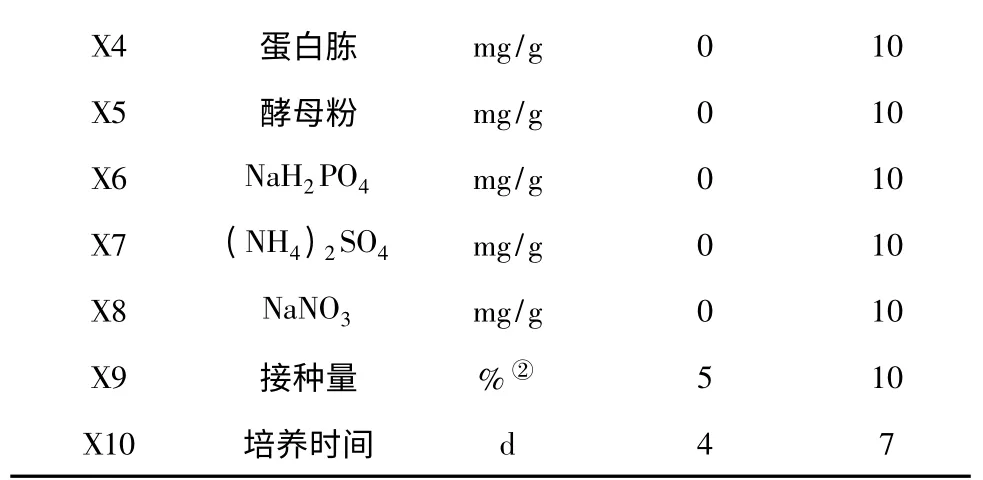
注:①指250 mL 三角瓶中装载WTS 的质量;②指种子液与固态发酵基质比例(v/w)。Note:①The quantity of WTS in a 250 mL Erlenmeyer flask;②The ratio of the seed broth to fermentation substrates(v/w).
1.5 分析方法
1.5.1 酵母生物量分离及测定
固态发酵培养一定时间后,向含发酵物的三角瓶中加入适量生理盐水,双层纱布过滤获得菌体滤液后定容。20 mL 菌体滤液8 000 rpm 离心10 min,弃除上清,收集菌体,无菌水洗涤2 次,105 ℃烘至恒重,称重并计算生物量[14]。
1.5.2 菌体类胡萝卜素的提取及含量测定
一定量的湿菌体经盐酸-热处理破壁后,用丙酮抽提类胡萝卜素。类胡萝卜素的提取参照文献[15]进行。用紫外可见分光光度计测定色素提取液485 nm 处吸光度,按下式计算类胡萝卜素含量:
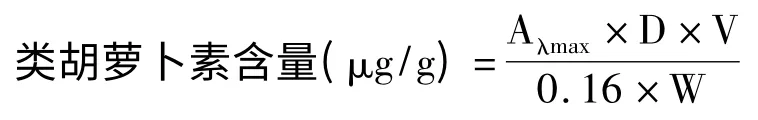
式中,Aλmax为色素最大吸收波长处的吸光度;D为测定试样的稀释倍数;V 为提取色素所用溶剂量(mL);W 为菌体重量(g);0.16 为类胡萝卜素的消光系数。根据菌体细胞类胡萝卜素含量计算固态发酵物中类胡萝卜素的产量。
1.5.3 数据分析
实验数据采用Design-Expert 8.0.6 统计分析软件进行处理。
2 结果与讨论
2.1 WTS 成分分析
WTS 中含有大量可溶性糖、烟碱等水溶性物质,其主要成分如表2。因此,经水浸泡后WTS 可作为一种廉价的固态发酵基质。发酵基质颗粒大小在固态发酵过程中起重要的作用,小颗粒基质能够提供更大的微生物作用表面,因此固态发酵中多采用小颗粒基质[16]。采用小颗粒基质,发酵后酵母细胞很难与基质颗粒分离。本实验中采用大颗粒的WTS 进行发酵,发酵后通过简单的过滤即可获得高纯度的酵母细胞,因此有利于规模化生产过程中类胡萝卜素及其它高附加值产物的分离和提取。
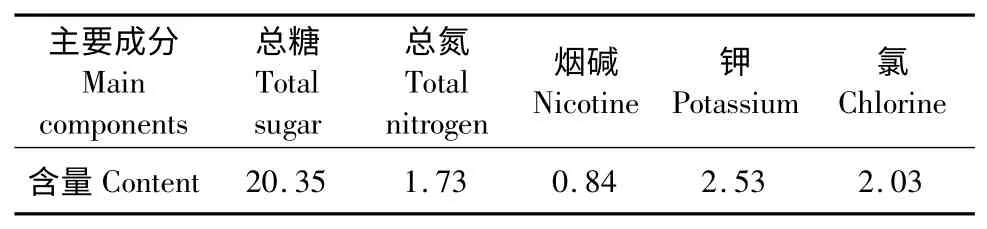
表2 预处理烟梗的成分分析(g/L)Table 2 The main compositions of WTS used in this study(g/L)
2.2 PB 设计试验方案及其结果
PB 设计实验中,生物量、色素含量及色素产量的响应值见表3。从表3 可看出:对生物量而言,最小的响应值为51.30 mg/g,最大响应值为89.45 mg/g;类胡萝卜素的最小和最大响应值分别为8.91 μg/g 和21.54 μg/g。色素含量在试验过程中变化也较大,第6 次试验中,以烟梗为唯一基质,色素含量为173.68 μg/g,其它11 次试验中色素含量均不同程度升高,表明添加因子对JLC 色素的累积有正效应。总的来说,在12 次试验中生物量、色素含量和色素产量变化均较大,表明在PB 设计中所选因子对响应值影响较大。
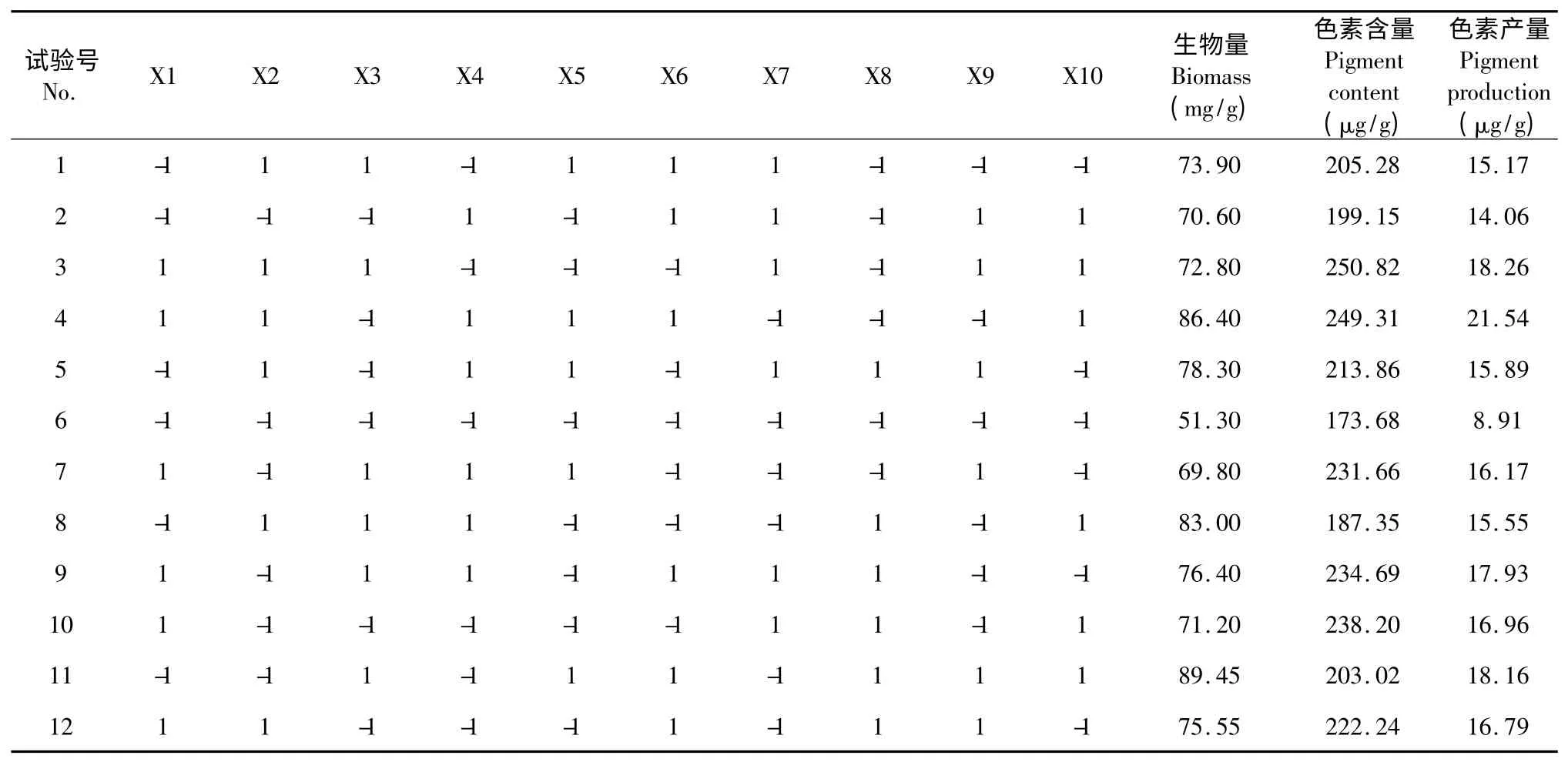
表3 PB 设计试验方案及结果Table 3 Plackett-Burman design matrix with biomass and carotenoid production
2.3 PB 设计试验的方差分析
Prob>F 值的大小能够表示模型及各个因子的显著性情况,当Prob>F 值小于0.05,表明有显著影响,当Prob>F 值小于0.01,表明有极显著影响[19]。对PB 设计试验结果进行方差分析见表4,结果表明,实验模型达到显著水平。在实验选择的10 个因素中,蛋白胨、葡萄糖和NaNO3对实验模型影响不显著,而蔗糖、酵母粉、(NH4)2SO4、装载量和培养时间对实验模型影响显著。
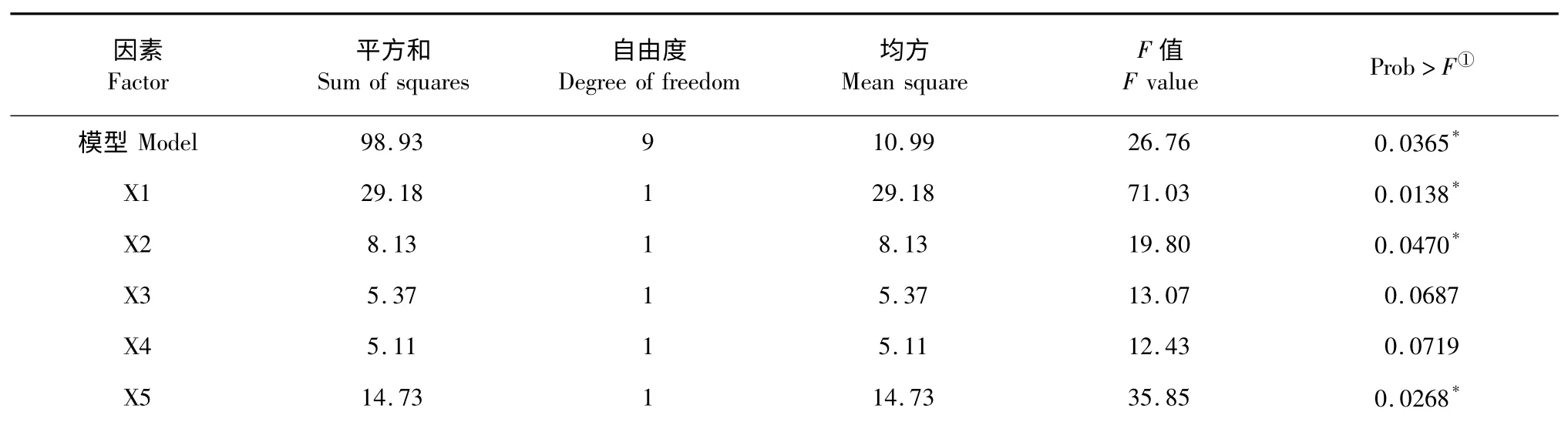
表4 PB 设计试验结果方差分析Table 4 Variance analysis of Plackett-Burman design experimental results

注:①Prob>F 小于0.05,表明模型或参数有显著影响;Prob>F 小于0.01,表明模型或参数有极显著影响。Note:①Prob>F less than 0.05,indicates that the model or parameters have a significant effect;②Prob>F less than 0.01,indicates that the model or parameter has an extremely significant effect.
2.4 供试因子对PB 设计试验模型的贡献度
贡献度(% contribution)指模型中的某因子的平方和占模型中各因子平方和总和的百分数,其值越大表明该因子对实验结果的影响越大[17]。供试因子对类胡萝卜素产量的贡献度见表5,结果表明,装载量、培养时间和酵母粉对模型贡献度相对较大,而蛋白胨、(NH4)2SO4、蔗糖等因素对模型贡献度相对较小。
根据因子的贡献度和Prob>F 值综合考虑,培养时间、装载量和酵母粉是影响JLC 固态发酵产类胡萝卜的重要因子,因此在下一步的放大发酵研究中对这3 个因素进行优化,有望进一步提高类胡萝卜产量。
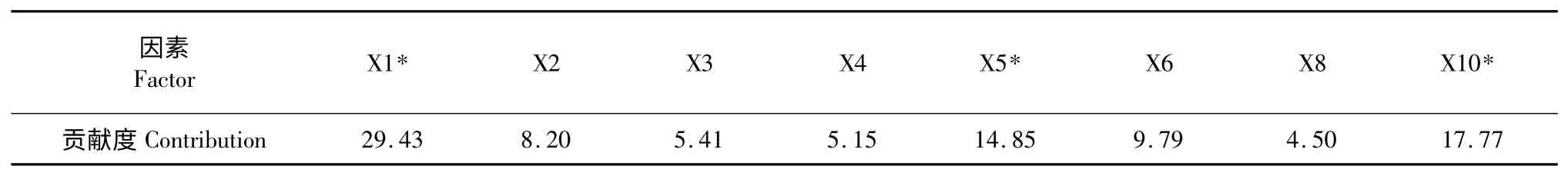
表5 PB 设计试验中供试因子对类胡萝卜素产量的贡献度(%)Table 5 The contribution of the tested variables to carotenoids production in Plackett-Burman design(%)
3 结论
深红酵母JLC 固态发酵WTS,发酵后简单过滤即可获得高纯度酵母细胞,有利于类胡萝卜素的提取,同时也有利于其它高附加值酵母成分的提取。装载量、培养时间和酵母粉是影响类胡萝卜素产量的关键因素。因此,以WTS 为主要基质,添加适量酵母粉,通过优化装载量和培养时间固态发酵生产类胡萝卜素,既可资源化利用WTS,又可获得天然类胡萝卜素。通过PB 实验,菌株JLC 类胡萝卜素的最大产量为21.54 μg/g,进一步优化有望提高类胡萝卜素产量。
1 Liu XJ(刘晓娟),Duan SS(段舜山),Li AF(李爱芬).Research advances on the production of carotenoids by microalgae.Nat Prod Res Dev(天然产物研究与开发),2007,2:333-337.
2 Frengova GI,Beshkova DM.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance.J Ind Microbiol Biotechnol,2009,36:163-180.
3 Elsanhoty RM,Al-Turki I,Ramadan MF.Screening of medium components by Plackett-Burman design for carotenoid production using date(Phoenix dactylifera)wastes.Ind Crops Prod,2012,36:313-320.
4 Huang YC(黄延春),Li YX(李云霞).Research progress on carotenoids in red Pepper.Nat Prod Res Dev(天然产物研究与开发),2013,4:562-565.
5 Frengova G,Simova E,Beshkova D.Use of whey ultrafiltrate as a substrate for production of carotenoids by the yeast Rhodotorula rubra.Appl Biochem Biotechnol,2004,112:133-141.
6 Li W,Zhanq LB,Peng JH,et al.Tobacco stems as a low cost adsorbent for the removal of Pb(II)from wastewater:Equilibrium and kinetic studies.Ind Crops Prod,2008,28:294-302.
7 Zhang KH,Zhang K,Cao Y,et al.Co-combustion characteristics and blending optimization of tobacco stem and high-sulfurbituminous coal based on thermogravimetric and mass spectrometry analyses.Bioresour Technol,2013,131:325-332.
8 Li W,Zhang LB,Peng JH,et al.Preparation of high surface area activated carbons from tobacco stems with K2CO3activation using microwave radiation.Ind Crops Prod,2008,27:341-347.
9 Sung YJ,Seo YB.Thermogravimetric study on stem biomass of Nicotiana tabacum.Thermochim Acta,2009,486:1-4.
10 Dong ZN(董占能),Bai JC(白聚川),Zhang HD(张皓东).Comprehensive utilization of tobacco waste.Chin Tob Sci(中国烟草科学),2008,1:39-42.
11 Xu YJ(徐永建),Zhao R(赵睿),Tan HF(谭海风).Research progress on the comprehensive utilization of tobacco waste.J Shanxi Univ Sci Technol(陕西科技大学学报),2012,05:16-21.
12 Zi WH,Peng JH,Zhang XL,et al.Optimization of waste tobacco stem expansion by microwave radiation for biomass material using response surface methodology.J Taiwan Inst Chem Eng,2013,44:678-685.
13 Ji YL(吉彦龙),Xi Y(席宇),Li MR(李敏睿),et al.Optimization of fermentation conditions for producing Rhodotorula rubra JLC with waste tobacco stems.Tob Sci Technol(烟草科技),2013,1:77-80.
14 Li X,Jia OY,Xu Y,et al.Optimization of culture conditions for production of yeast biomass using bamboo wastewater byresponse surface methodology.Bioresour Technol,2009,100:3613-3617.
15 Wang SL(王岁楼).The extraction of carotenoids from Rhodotorula.Shanxi Food Ind(山西食品工业),2001,(1):3.
16 Krishna C.Solid-state fermentation systems-an overview.Crit Rev Biotechnol,2005,25(1-2):1-30.
17 Dai WL(代文亮),Cheng L(程龙),Tao WY(陶文沂).Application of response surface methodology in optimization of precursors for Taxol production by Fusarium mairei K178.Chin Technol(中国生物工程杂志),2007,11:66-72.
