胃癌组织中一氧化氮合酶与整合素连接激酶的表达及意义
2015-01-11牛蕾雷丽
牛蕾雷丽
辽宁省阜新市中心医院病理科,辽宁阜新123000
胃癌组织中一氧化氮合酶与整合素连接激酶的表达及意义
牛蕾雷丽
辽宁省阜新市中心医院病理科,辽宁阜新123000
目的研究胃癌组织中微血管密度(MVD)的分布、一氧化氮合酶(NOS)与整合素连接激酶(ILK)表达及其与临床病理特征的关系。探讨MVD、一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)、神经型一氧化氮合酶(nNOS)、ILK在胃癌浸润、转移中的意义及其相关性。方法应用免疫组化SABC染色检测48例阜新市中心医院2010年3月~2014年3月行根治性手术的胃癌组织标本中iNOS、eNOS、nNOS、ILK的表达情况,对肿瘤微血管以CD34抗体染色标记并检测MVD值,并分析iNOS、eNOS、nNOS、ILK的相关性。结果iNOS、eNOS、nNOS、ILK在胃癌组织中的阳性表达率依次为72.92%(35/48)、81.25%(39/48)、83.33%(40/48)、37.5%(18/48)。不同病理类型的胃癌组织中iNOS、eNOS、nNOS、ILK的阳性表达率差异有统计学意义(P<0.05);TNMⅢ+Ⅳ期胃癌组织中的iNOS、ILK阳性表达。明显高于TNMⅠ+Ⅱ(P<0.05),但TNMⅢ+Ⅳ期与TNMⅠ+Ⅱ期胃癌组织中的eNOS、nNOS阳性表达。比较,差异无统计学意义(P>0.05)。不同病理类型的MVD值差异有统计学意义(P<0.05),不同TNM分期的MVD值差异有统计学意义(P<0.05)。iNOS、ILK阳性表达的胃癌组织中的MVD值均明显高于阴性表达的MVD值,差异有统计学意义(P<0.05),胃癌组织中iNOS与ILK的表达水平呈正相关(r= 0.375,P<0.05)。结论iNOS、eNOS、nNOS、ILK的持续递增式表达提示其可能参与了胃癌的生长、侵袭和转移过程,构建了肿瘤发展的血管网。iNOS与ILK正性相关,可能通过iNOS信号转导途径启动血管内皮生长因子的表达,促进肿瘤早期的血管发生和形成。
胃癌;微血管密度;整合素连接激酶;一氧化氮合酶
肿瘤组织中血管的生成是肿瘤生长、发生的主要因素,而恶性肿瘤微血管网的早期建立及快速生长是其快速侵袭和发展的原因。一氧化氮合酶(NOS)由诱导型一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)、神经型一氧化氮合酶(nNOS)三种同工酶构成,作为一氧化氮(NO)合成的关健限速酶,其表达直接影响NO的生成。研究发现,催化NO生成的NOS活性的增高与肿瘤血管生成关系密切[1]。Hannigan等[2]于1996年率先在酵母菌双杂合筛选系统中发现的一种蛋白激酶,它就是整合素连接激酶(integrin-linked kinase,ILK)。它可以调节诸多细胞的生长、分裂、增殖、存活、迁移和侵袭,在血管形成的化学信号传导中起着重要传导调控作用[3]。本研究通过研究胃癌中NOS与ILK的表达和肿瘤微血管密度(microvessel density,MVD)的高低,并分析其相关性,探讨其在肿瘤的生长过程中对血管的协同作用及其在肿瘤转移过程中的影响。现报道如下:
1 资料与方法
1.1 一般资料
选取阜新市中心医院2010年3月~2014年3月行根治性手术的胃癌病标本,并从中随机选取48例。所有肿瘤组织标本均常规固定包埋,HE染色,病理确诊为胃癌,且病例术前均未行放疗及化疗治疗。其中男29例,女19例;年龄39~78岁,平均(59.27±0.01)岁;病理类型:高中分化腺癌13例,低分化腺癌27例,黏液腺癌4例,印戒细胞癌4例;根据国际抗癌联盟(UICC)关于胃癌TNM分期方法[4]进行临床分期:Ⅰ期10例,Ⅱ期14例,Ⅲ期21例,Ⅳ期3例。
1.2 方法
1.2.1 主要试剂兔抗人iNOS多克隆抗体、兔抗人eNOS多克隆抗体、兔抗人nNOS多克隆抗体(武汉博士德生物工程有限公司);鼠抗人ILK单克隆抗体、兔抗人CD34多克隆抗体、免疫组化SABC染色试剂盒、DAB显色盒(福州迈新生物技术开发有限公司)。
1.2.2 方法用免组化SABC染色观察iNOS、eNOS、nNOS、ILK、CD34在胃癌中的表达分布情况。每次染色流程均设有对照作为染色质量控制标准。阳性对照用武汉博士德生物工程有限公司和福州迈新生物技术开发有限公司已证实的阳性iNOS、eNOS、nNOS、ILK、CD34切片为对照,以PBS代替一抗作为阴性对照,至少有2名有经验的病理医师独立观察切片。
1.2.3 结果判定两名病理医师采用双盲法在200倍视野下随机选取5个视野,记数每个视野中肿瘤上皮细胞的染色情况。以PBS代替一抗作阴性对照,iNOS、eNOS、nNOS、ILK阳性着色位于细胞质中呈弥漫或散在的棕黄色颗粒的细胞记为阳性细胞。根据瘤组织中阳性细胞的有无及数量分为:阴性(-):未见阳性细胞;弱阳性(+):阳性细胞<10%;阳性(++):阳性细胞10%~30%;强阳性(+++):阳性细胞>30%[5]。
MVD计数参照Weidner等[6]报道的方法,选取被CD34染成棕色的肿瘤微血管分布的最高区域,以与背景明显有别的任何一个棕色染色的内皮细胞或细胞丛作为一个血管,只要结构不连续,分支结构也作为一个血管计数。先在100倍光镜下寻找肿瘤中血管密度最高的5个区域,然后在400倍镜下计数MVD,5个区域的均值为该肿瘤的MVD值。计数由2名不知临床资料的高年资病理医师完成,结果取两者的平均值。
1.3 统计学方法
采用统计软件SPSS 19.0对数据进行分析,正态分布计量资料以均数±标准差表示,两组间比较采用t检验;多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。Spearman相关分析iNOS、eNOS、nNOS、ILK在胃癌中阳性表达的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织NOS、ILK、MVD的测定结果
iNOS、eNOS、nNOS主要在细胞质表达,呈棕褐色颗粒状(图1~3,封四);ILK主要也在细胞质表达,呈棕褐色颗粒状(图4,封四),且肿瘤浸润边缘部位染色阳性比肿瘤中心部位多见,同一癌组织内癌细胞间表达强度不均一。本组中iNOS、eNOS、nNOS、ILK的阳性表达率依次为72.92%(35/48),81.25%(39/48),83.33%(40/48),37.5%(18/48)。根据肿瘤类型,不同病理类型的iNOS、eNOS、nNOS、ILK阳性表达差异有统计学意义(P<0.05);iNOS、ILK在TNMⅢ+Ⅳ期胃癌组织中的阳性表达明显高于TNMⅠ+Ⅱ期,差异有统计学意义(P<0.05);但eNOS、nNOS在TNMⅢ+Ⅳ期与TNMⅠ+Ⅱ期胃癌组织中的阳性表达比较,差异无统计学意义(P>0.05)。MVD用CD34抗原标记,主要表达于血管内皮细胞的细胞膜(图5,封四)。MVD染色呈棕黄色,分布不均,最密集的染色区域即“热点”主要位于癌灶边缘。不同病理类型的MVD值差异有统计学意义(P<0.05);不同TNM分期的MVD值差异有统计学意义(P<0.05)。见表1。
2.2 胃癌组织中NOS、ILK的表达与MVD的关系
iNOS、ILK在胃癌组织中阳性表达的MVD值均明显高于阴性表达者,差异有统计学意义(t=6.940、3.613,P<0.05);eNOS、nNOS在胃癌组织中阳性表达的MVD值与阴性表达者比较,差异无统计学意义(t=0.440、0.361,P>0.05)。见表2。
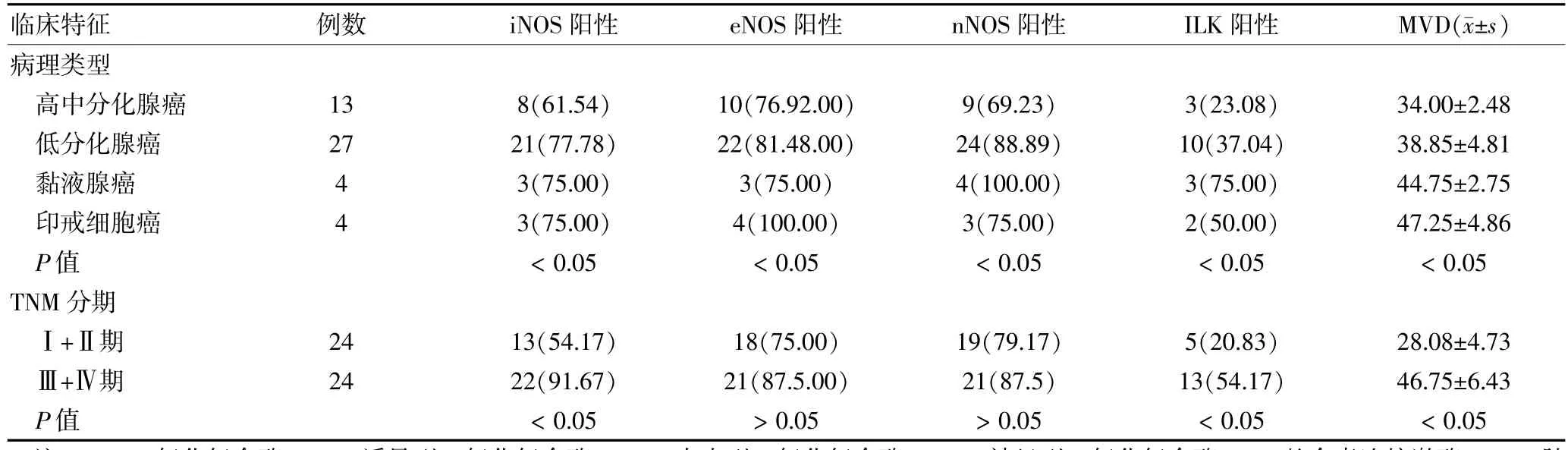
表1 胃癌组织中NOS、ILK、MVD的测定结果[n(%)]
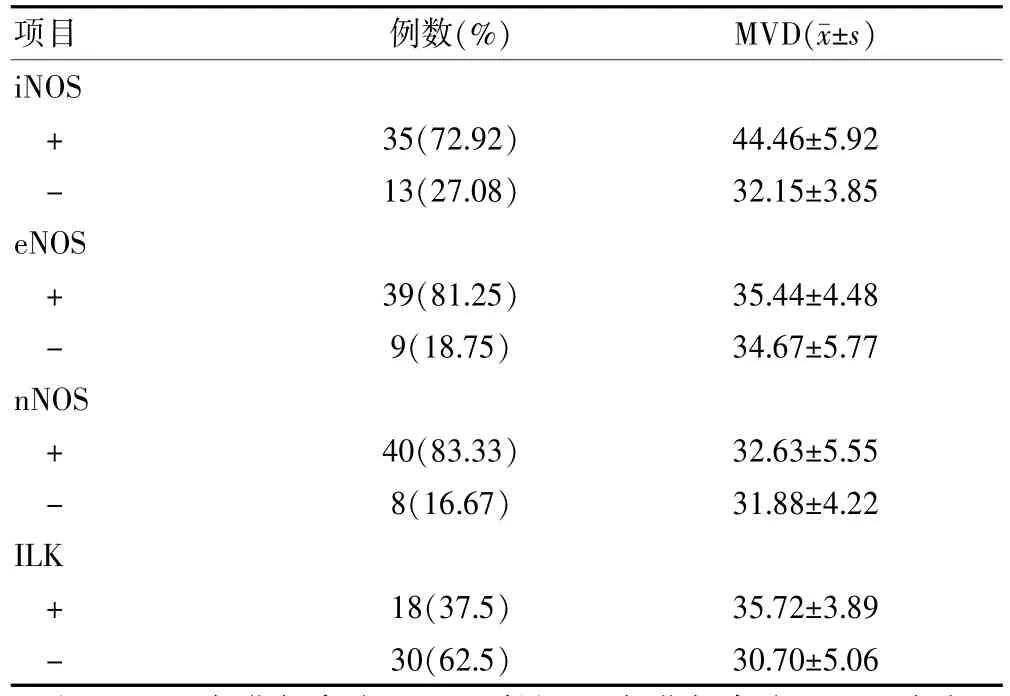
表2 MVD值及NOS、ILK表达与胃癌的关系
2.3 胃癌组织中NOS与ILK表达的关系
不同的iNOS表达的胃癌组织中ILK表达差异有统计学意义(P<0.05),相关性分析显示,胃癌组织中iNOS与ILK表达呈正相关(r=0.375,P<0.05)。胃癌组织中eNOS、nNOS与ILK表达无明显关系(P>0.05)。见表3。
3 讨论
NOS是NO合成的限速酶,在人和动物的正常组织细胞中存在广泛,并且在许多恶性肿瘤组织中广泛表达,其活性变化通过三种亚型,即诱导型(iNOS)、内皮型(eNOS)和神经型(nNOS)直接调节NO生成量及其生物学行为。近年有研究证明[7],NO主要在介导的肿瘤血管形成过程的各个步骤如新的血管网构建和血管腔的形成中起着重要作用。NO对肿瘤的影响主要是促进局部微血管网的建立和调节局部血供,通过对血管网及血流量的控制起到促进肿瘤生长及其远处转移作用。有研究表明NO在肿瘤的发生、发展过程中具有浓度依赖作用。Ziche等[8]认为低浓度的NO能够有效对抗基因突变,并激活机体防御功能;高浓度的NO则失去对基因突变的控制,转而刺激基因突变,诱发肿瘤的发生。Saffi等[9]则认为在肿瘤的生长过程中,低浓度的NO在肿瘤细胞信号传递途径中起调节作用,调节细胞增殖,促进肿瘤微血管网建立,从而有利于肿瘤生长,而高浓度的NO则表现为细胞毒性作用,影响肿瘤细胞间的信号转导,从而抑制肿瘤的生长。虽然对于NO浓度对肿瘤的影响尚有争论,但可以肯定的是不同浓度下NO对肿瘤的作用不同。
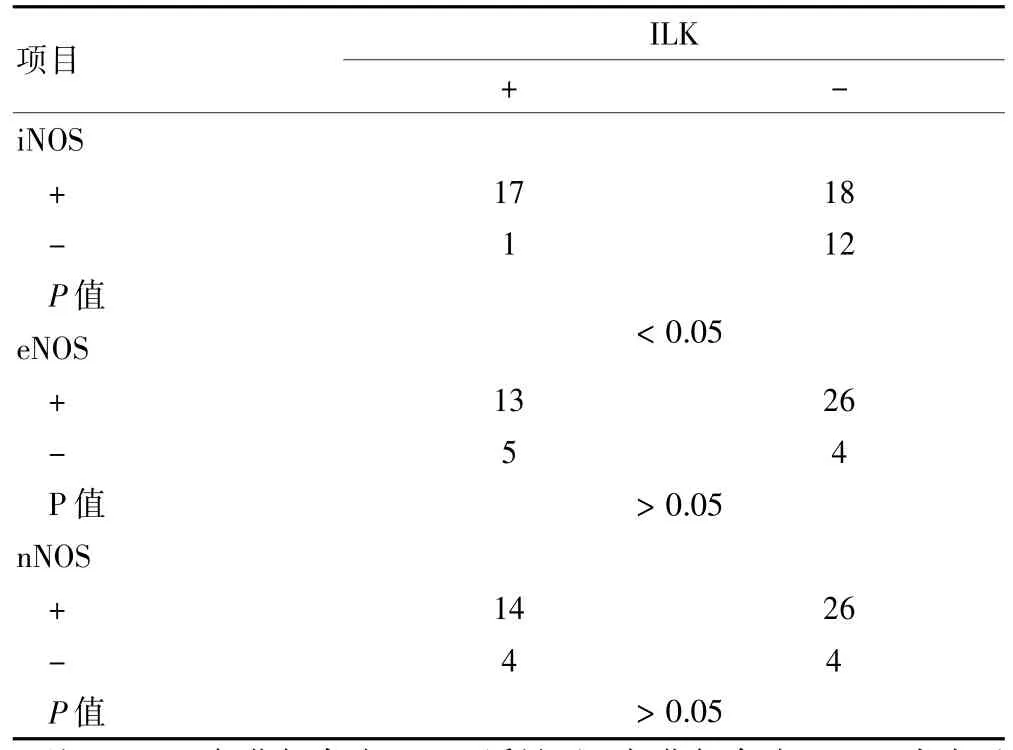
表3 胃癌组织中NOS与ILK表达间的关系(例)
ILK是一种多功能酶,能参与到多种信号传导通路中,在肿瘤形成的过程中起重要作用。Sa等[10]研究发现将过表达的ILK细胞导入裸鼠体内可导致裸鼠肿瘤发生,提示ILK是个致癌基因。黄汉等[11]证实在口腔腺样囊腺癌中ILK高表达,也提示ILK的高表达与恶性肿瘤的发生存在相关性。将肿瘤发生归于细胞生理的6种基本改变:生长信号的自我满足;生长抑制(抗生长)的失敏感;细胞程序性死亡(凋亡)的破坏;无限制的复制潜能;永生的血管生成能力;组织侵袭和转移性。ILK参加细胞基础功能的调控,调节细胞生长,通过对细胞内信号转导的调控来影响细胞内外基质的相互作用,因此ILK的改变,哪怕是表达和活性的微小改变,也将导致细胞增殖的异常,肿瘤基因的发生以及细胞内外基质的相互作用。
本研究结果显示:iNOS、eNOS、nNOS、ILK在肿瘤浸润边缘部位染色阳性比肿瘤中心部位多见,不同病理类型胃癌组织中的iNOS、eNOS、nNOS、ILK差异有统计学意义(P<0.05);MVD最密集的染色区域即“热点”主要位于癌灶边缘,不同病理类型胃癌组织中的MVD差异有统计学意义(P<0.05)。TNMⅢ+Ⅳ期胃癌组织中的的iNOS、ILK阳性表达率及MVD均明显高于TNMⅠ+Ⅱ期胃癌组织。说明在胃癌的发生发展过程中有大量的微血管产生,且呈浸润性生长,侵袭性强,越至肿瘤晚期肿瘤恶性程度越高这种癌灶边缘表达越强烈,转移能力强,其原因可能是由于肿瘤内微血管的快速形成,以及肿瘤内血管网的广泛建立,增加了肿瘤细胞进入血液循环的概率,从而增加其远处转移的概率与能力。Jenkins等[12]的研究发现iNOS-19细胞形成的瘤体中MVD表达明显增高,提示有更多的新生血管生成;Gallo等[13]对头颈发生恶性肿瘤的患者进行MVD值和NOS检测,发现随肿瘤恶性程度增高,NOS表达增加,且淋巴结转移与NOS存在相关性,肿瘤MVD的变化趋势与NOS的变化趋势相一致。而eNOS、nNOS在TNMⅢ+Ⅳ期与TNMⅠ+Ⅱ期胃癌组织中的阳性表达率比较,差异无统计学意义(P>0.05);iNOS、ILK在胃癌组织中阳性表达的MVD值均明显高于阴性表达的MVD值;而eNOS、nNOS在胃癌组织中阳性表达的MVD值均与阴性表达的MVD值差异无统计学意义(P>0.05),其原因可能与其发生机制有关,eNOS及nNOS主要参与机体正常生理功能的调节,而iNOS则在病理条件下被激活,参与机体免疫及肿瘤的发生、发展过程。
本研究显示:胃癌患者iNOS与ILK的表达水平呈正相关(r=0.375,P<0.05);eNOS、nNOS与ILK的表达无明显相关(P>0.05),说明ILK在肿瘤的发生发展过程中与iNOS所引起的血管变化存在联系,可能是ILK信号通道在整合素ανβ3的激活下,AKT在AKT丝氨酸473位点磷酸化的情况下发生激活,从而增强血管内皮生长因子(VEGF)的表达,促进了肿瘤血管通路的形成及微血管网的建立[14]。Pkb/Akt-473丝氨酸,使mTOR/FRAP-2448磷酸化水平增高,激活了Akt/iNOS通路,促进HIF-1α产生,通过iNOS调节NO调节浓度,达到诱导细胞增殖,启动VEGF的表达,促进了血管生成,从而起到了促血管生成的作用[15];同时ILK活化后使GSK-3磷酸化失活,GSK-3磷酸化失活后失去了磷酸化AP-1的能力,使得被脱磷酸化的AP-1恢复了与启动子结合的能力,继而与血管内皮生长因子受体结合,激活受体转导通路,进而启动VEGF的转录[16]。
恶性肿瘤的发生与发展是一直以来都是科学研究的热点,通过对肿瘤细胞因子的研究,可以在分子生物学水平探讨肿瘤的形成机制,进一步揭示肿瘤发生、发展的规律,为肿瘤临床治疗提供新的思路、新的方法。
[1]李红,张敏,赵瑞霞,等.乳腺癌组织中p53和VEGF及NOS的表达及临床意义[J].中国肿瘤临床与康复,2010,17(5):394-399.
[2]Hannigan GE,Leung-Hagesteijn C,Fitz-Gibbon L,et al. Regulation of cell adhesion and anchorage-dependent growth by a newβ1-integrin-linked protein kinase[J]. Nature,1996,379(6560):91-96.
[3]McDonald PC,Fielding AB,Dedhar S.Integrin-linked kinase-essential roles in physiology and cancer biology[J]. J Cell Sci,2008,121(Pt 19):3121-3132.
[4]陈波,孙继元,金锋,等.关于胃癌TNM分期系统中最少淋巴结检出数目的研究[J].中华外科杂志,2005,43(11):702-705.
[5]Feng CW,Wang LD,Jiao LH,et al.Expression of p53,inducible nitric oxide synthase and vascular endothelial growth factorin gastric precancerous and cancerous lesions:correlation with clinical features[J].BMC Cancer,2002,2:8.
[6]Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic factor in early stage breast carcinoma[J].Journal of the National Cancer Institute,1992,84(24):1875-1887.
[7]Hu J,Ma S,Zou S,etal.The regulation ofnitric oxide synthase isoform expression in mouse and human fallopian tubes:potential insights for ectopic pregnancy[J].Int J Mol Sci,2014,23,16(1):49-67.
[8]Ziche M,Morbidelii L,Masini S,et al.Nitric oxide mediats angiogenesisin vivo and endothelialcellgrowth and migration in vitro promoted by substance P[J].J Clin Invest,2004,94(5):2036-2044.
[9]Saffi MA,Furtado MV,Polanczyk CA,et al.Relationship between vascular endothelium and periodontal disease in atherosclerotic lesions:Review article[J].World J Cardiol,2015,26,7(1):26-30.
[10]Sakai T,Docheva D.et al.Integrin-link kinase is required for polarizing the epiblast,cell adhesion and controlling actin accumulation[J].Genes Dev,2003,17(7):926.
[11]黄汉,米磊,张斌,等.涎腺腺样囊性癌组织中ILK和E-cadherin的表达及意义[J].口腔颌面外科杂志,2011,21(3):159-162..
[12]Jenkins DC,Charles IG,Thomsel LL,et al.Roles of nitric oxide in tumor growth[J].Proc Natl Acad Sci USA,1995,92(10):4392-4396.
[13]Gallo O,Masini E,Morbidelli L,et al.Role of nitric oxide in angiogenesis and tumor progression in head and neck cancer[J].J Natl Cancer Inst,1998,90(8):587-596.
[14]Edwards LA,Woo J,Huxham LA,et al.Suppression of VEGF secretion and changes in glioblastoma muliforme microenvironment by inhibition of integrin-linked kinase(ILK)[J].Mol Cancer Ther,2008,7(1):59-70.
[15]Zhou H,Chiles K,Feldser D.Modulation of hypoxiain duciblefactor 1 alpha expression by the epidermal growth factor/phospha-tidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells:implications for tumor angiogenesis and therapeutics[J].Cancer Res 2000,60(6):1541-1545.
[16]Tan CA,Mui A,Dedhar S.Integrin-linked kinase regulates inducible nitric oxide aynthase and cyclooxygenase-2 expression in an NF-kappa B-dependent manner[J].J Biol Chem,2002,277(5):3109-3116.
Expressions and significance of nitric oxide synthase and integrin-linked kinase in gastric cancer tissues
NIU Lei LEI Li
Department of Pathology,Central Hospital of Fuxin City,Liaoning Province,Fuxin 123000,China
ObjectiveTo detect the expressions of nitric oxide synthase(NOS)and integrin-linked kinase(ILK)in gastric cancer tissues,and analyze the relationship of clinicopathologic factors among them.MethodsFrom March 2010 to March 2014,in Central Hospital of Fuxin City,48 gastric cancer tissues samples from radical surgery were selected, and the expressions of iNOS,eNOS,nNOS and ILK of these samples were detected by SABC immunohistochemical stain.The correlation of iNOS,eNOS,nNOS and ILK were statistically analyzed.ResultsThe positive expression rates of iNOS,eNOS,nNOS and ILK in gastric cancer tissues were 72.92%(35/48),81.25%(39/48),83.33%(40/48),37.5% (18/48).The positive expression rates of iNOS,eNOS,nNOS and ILK in differentgastric cancer pathologicaltype had statistically significantdifferences(P<0.05);The positive expression of iNOS and ILK in TNMⅢ+Ⅳphase were significantly higher than those in TNMⅠ+Ⅱphase(P<0.05),but The positive expression of eNOS,nNOS in TNMⅢ+Ⅳphase and TNMⅠ+Ⅱphase were compared,the differences were not statistically significant(P>0.05).MVD in different gastric cancer pathological type had statistically significantdifference(P<0.05),MVD in different TNM phase had statistically significantdifference(P<0.05).MVD of iNOS,ILK positive expression gastric cancer tissues were higher than those of nagtive expression,the differences were statistically significant(P<0.05),iNOS of gastric cancer tissues had a positive correlation with ILK(r=0.375,P<0.05).ConclusioniNOS、eNOS、nNOS、ILK continous increasing expressions participate in the development,invasion and metastasis process of gastric cancer.The positive correlation of iNOS and ILK might start signal transduction pathways by expression of VEGF,promote early tumor angiogenesis and formation.
Gastric Cancer;Microvessel density;Integrin-linked kinase;Nitric oxide synthase
R656.6;R735.2
A
1673-7210(2015)08(b)-0083-05
2015-03-20本文编辑:苏畅)
