肝郁与慢 性 非细菌性前 列 腺炎的关 系
2015-01-11孙洪福王卫东高兆旺张庆祥
孙洪福 刘 燕 王卫东 高兆旺 张庆祥▲
1.山东中医药大学附属医院泌尿外科,山东济南 250014;2.山东中医药大学基础医学院,山东济南 250011
肝郁与慢 性 非细菌性前 列 腺炎的关 系
孙洪福1刘 燕2王卫东1高兆旺1张庆祥2▲
1.山东中医药大学附属医院泌尿外科,山东济南 250014;2.山东中医药大学基础医学院,山东济南 250011
目的建立慢性非细菌性前列腺炎(CNP)并肝郁大鼠模型的方法,探讨肝郁与 CNP 的关系。方法采用Wistar雄性大鼠 50 只,模型组为 37 只,前列腺蛋白制备组 5 只,空白组 8 只。 其中模型组随机选取 6 只作为 CNP 组,6 只作为肝郁并 CNP 组。 先采用弗氏免疫佐剂法制备 CNP 模型,观察前列腺病理变化和肿瘤坏死因子-α(TNF-α)、白细胞介素-1β (IL-1β) 浓度变化, 然后对模型组采用束缚法制备肝郁并 CNP 模型, 观察前列腺病理变化和TNF-α、IL-1β 浓度变化。结果采用弗氏免疫佐剂法能导致大鼠前列腺出现炎性改变和 TNF-α、IL-1β 浓度升高。 CNP 组和肝郁并 CNP 组大鼠前列腺组织 TNF-α 和 IL-1β 浓度均高于空白组,差异有统计学意义(P< 0.05);肝郁并 CNP 组大鼠前列腺组织 TNF-α 和 IL-1β 浓度均高于 CNP 组,差异有统计学意义(P< 0.05)。结论弗氏免疫佐剂法结合束缚法能制备肝郁并 CNP 模型,肝郁能加重 CNP 的炎性改变。
慢性非细菌性前列腺炎;肝郁;病证结合模型;大鼠
前列腺炎是临床上最为常见的泌尿外科疾病之一。 有资料显示,50%以上的男性在一生中的某个时期会受到前列腺炎的困扰[1]。 按照前列腺炎的分类体系,一般分为 4 型,分别为急性细菌性前列腺炎、慢性细菌性前列腺炎 、 慢性 非 细 菌 性 前 列 腺 炎 (chronic non-bacterial prostatitis,CNP)、 前列腺痛。 据统计,CNP 占到前列腺炎的 90%[2]。 临床上发现大部分慢性前列腺炎患者伴有精神、心理方面的异常,研究表明,在经久不愈的前列腺炎患者中,50%以上存在显著的精神心理异常和人格特征改变,常见的有焦虑、多疑、抑郁,甚至有自杀倾向[3-4]。 肝郁是中医名词,肝郁后患者会出现抑郁、焦虑、多疑等精神心理表现。 肝郁能否进一步 加 重 前列腺 炎 的 病理改变 ,本 实 验 通 过 制 备CNP 肝郁证大鼠模型,观察肝郁与 CNP 的关系。
1 材料与方法
1.1 实验动物
成年健康 Wistar 雄性大鼠 50 只,体重 250~300 g,由山东大学实验动物中心提供,合格证号:Scxk(鲁)20130001。 在山东中医药大学动物实验中心实验室分笼喂养,每笼 5 只,每天给予标准饲料,清洁自来水自由饮用。 动物房环境温度 22~24℃, 相对湿度70%左右,实验前饲养 1 周以熟悉环境。
1.2 主要试剂
吸附无细胞百白破联合疫苗(武汉生物制品研究所有限责任公司,批号:20131049-1,0.5 mL/安瓿),弗氏完全佐剂(美国 Sigma 公司,批号:F5881,10 mL/瓶),BCA 蛋白浓度测定试剂盒(购自上海碧云天生物技术有限公司,产品编号:P0010S),肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)酶联免疫试剂盒(购自上海依科赛生物制品有限公司,试剂盒基于生物素双抗体夹心技术原理)。
1.3 特殊设备
大鼠束缚箱(自制):长 60 cm,宽 12 cm,按长度分割成 8 cm 长空格,且空格可调节。
1.4 模型制备
1.4.1 CNP 大鼠模型的制备 将健康成年 Wistar 雄性大鼠 50 只,正常饲养 1 周后,按随机数字表法分为 3 组:模型组 37 只,前列腺蛋白制备组 5 只,空白组 8 只。取前列腺蛋白制备组 5 只大鼠,用戊巴比妥钠麻醉后,取前列腺放玻璃匀浆器中匀浆,把匀浆充分的前列腺组织吸入离心管中,置入高速离 心机中,以1500 r/min,离心 30 min,取上清液 13 mL,用 BCA 蛋白浓度测定试剂盒测定前列腺蛋白浓度,取 0.2 mL上清液等比稀释后依次放入 96 孔板, 在酶标仪上读取OD值,按照检测的标准曲线读取上清液浓度为31.2 mg/mL,用 0.1 mol/L pH 7.2 的磷酸缓冲盐溶液(PBS)稀释为 15 mg/mL,与弗氏完全佐剂(1∶1)混合制成混悬液。
模型组 37 只大鼠乙醚麻醉,每只腹腔注射吸附无细胞百白破联合疫苗 0.5 mL 并多点皮内注射大鼠前列腺蛋白提纯液和佛氏完全佐剂(1∶1 混悬液)1 mL,空白组 8 只大鼠皮内注射 0.9%氯化钠注射液,每 30 天重复上述注射方法 1 次。 在第 60 天时,处死模型组4 只,取完整前列腺组织,行病理检查,观察到前列腺局部组织结构损害,部分基膜被破坏,出现慢性炎症病理改变,可判定 CNP 模型造模成功。 自模型组随机选取 6 只为 CNP 组,正常饲养 7 d 后处死,同样取前列腺组织,观察 TNF-α、IL-1β 及前列腺组织病理。
1.4.2 肝郁并 CNP 大鼠模型的制备 剩余模型组 27 只大鼠采用束缚法制备肝郁并 CNP 大鼠病证结合模型,共 7 d。 肝郁并 CNP 模型的制备,按照严灿等[5]慢性束缚的方法并加以改进,将模型组大鼠置于特制的束缚制动箱 12 cm×8 cm 内,通过逐步移动玻璃插片缩小大鼠的活动空间,调节到其不产生强烈反抗且不使大鼠感到明显压迫的最小空间,并在上面加盖玻璃,防止大鼠窜出。 每日开始时间随机,每日束缚制动1 次,持续时间从第 1 天的 4 h 逐渐增加,第 4 天后稳定在 6 h/d,连续束缚制动 7 d。 模型组大鼠在束缚制动期间禁饮食。 7 d 后处死肝郁并 CNP 组大鼠 6 只,取完整前列腺组织,观察 TNF-α、IL-1β 及前列腺组织病理,可判定肝郁并 CNP 模型造模成功。
1.5 前列腺组织病理分析及 TNF-α、IL-1β 指标检测
1.5.1 前列腺组织病理分析 取前列腺组织放入 4%多聚甲醛中固定 6 h,然后将前列腺组织冲水 6 h 脱甲醛,再用不同浓度的乙醇各脱水 2 h,随后组织进行浸蜡、包埋、切片、贴片、烤片 15~30 min,最后采用苏木精-伊红(HE)染色,晾干后观察前列腺组织病理切片。
1.5.2 TNF-α、IL-1β 指标检测 将前列腺组织用匀浆器匀浆,离心,取上清液;根据试剂盒提供的 1 支原倍标准品,按要求对标准品进行稀释。 取出实验所需条板,分别将标本和不同浓度标准品加入相应孔中,用封板胶纸封住反应孔,孵箱孵育 90 min,洗板 5 次,除空白孔外,加入生物素化抗体工作液,用封板胶纸封住反应孔,孵箱孵育 60 min,洗板 5 次,除空白孔外,加入生物素化抗体工作液,用封板胶纸封住反应孔,孵箱孵育 30 min,洗板 5 次,加入显色底物,避光孵育 10~15 min,加入终止液,混匀后即刻测量OD值,计算浓度。
1.6 统计学方法
采用 SPSS 17.0 统计软件对数据进行分析和处理,计量资料以均数±标准差表示,采用完全随机设计的单因素方差分析,组间两两比较采用SNK检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠前列腺组织病理学变化
空白组大鼠前列腺组织结构完整,腺腔内有少量嗜酸性分泌物;间质无水肿,有少量炎症细胞浸润,腺泡上皮无明显病理改变(图 1A)。 CNP 组大鼠前列腺腺腔扩张,腺体内炎症细胞浸润,部分腺体脱落;间质水肿,血管扩张充血,炎症细胞散在浸润,病理改变较空白组明显(图 1B)。 肝郁并 CNP 组大鼠前列腺腺体内炎症细胞浸润、部分腺体增生或脱落;间质水肿、血管扩张充血、大量炎症细胞弥漫性浸润,病理改变较CNP 组加重(图 1C)。
2.2 各组大鼠前列腺组织 TNF-α 和 IL-1β 浓度比较
CNP 组和肝郁并 CNP 组大鼠前列腺组织 TNF-α和 IL-1β 浓度均高于空白组,差异有统计学意义(P<0.05);肝郁并 CNP 组大鼠前列腺组织 TNF-α 和 IL-1β浓度均高于 CNP 组,差异有统计学意义(P< 0.05)。 见表 1。
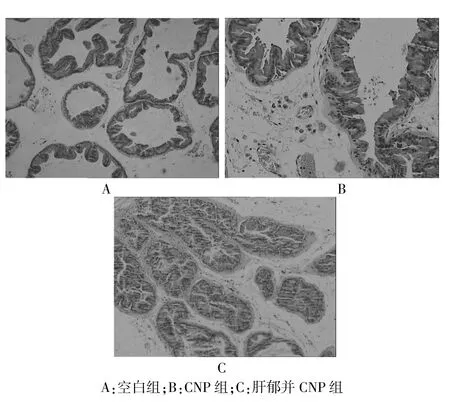
图1 各组大鼠前列腺组织病理学变化(HE 染色,40×)

表1 各组大鼠前列腺组织 TNF-α 和 IL-1β 浓度比较(ng/L,x±s)
3 讨论
由于 CNP 的病因机制仍未明确,所以制备 CNP模型的方法就不确定,无论选择何种方法,经过一段时间的制备, 最终制备出符合 CNP 病理表现的模型就认为这种方法可行。 综合文献,目前制备 CNP 模型的方法有以下几种。
①化学诱导剂模型:多数学者认为,前列腺部的尿道黏膜层具有保护其下面组织的功能,避免其接触到因含有害物质尿液反流到前列腺内所造成的损害。多项研究推测,CNP 可能是由下尿路上皮潜在的保护因素和损害因素之间的平衡破坏所致[6]。 如果尿道黏膜潜在的保护因素和损害因素之间平衡遭到破坏,可能导致前列腺炎性改变。 基于这种理论,许多学者设计了化学诱导剂制备 CNP 模型的方法。 这种理化因素所诱导的前列腺炎和临床上的 CNP 病因特征有很大差异,不是非常理想的前列腺炎模型[7]。
②免疫模型:叶伟成等[8]采用纯化的 SD 大鼠前列腺组织蛋白结合免疫佐剂方法建立了 CNP 的小鼠模型,小鼠的脾脏和胸腺没有出现类似前列腺的病理改变,说明模型具有特异性,前列腺组织的病理改变和临床基本相似,基本上符合 CNP 的动物模型要求。
如何制备肝郁模型,关键 是如何让大 鼠持续愤怒、抑郁、焦虑,并对这些模型是否制备成功有一定的客观指标描述。 综合文献研究,这些模型一般从两个方面入手,一是用过量或毒性药物造成急慢性中毒性肝损害来制备模型,二是通过不断或过强的情志刺激改变动物生理状态来制备模型。 从临床角度看,情志刺激模型比较符合临床。
在情志刺激法中,夹尾法急性激怒模型[9]:体重为300~400 g 的雄性 Wistar 大鼠,3~7 只置于同一个笼内,用尖端缠有纱布的止血钳夹其中 1 只大鼠尾巴中部,这样会使其主动攻击其他大鼠,间接激怒其余大鼠,用间接激怒大鼠作实验用鼠,每次刺激 30 min,每隔 3 h 刺激 1 次,每天 4 次,造模 2 d;钳夹大鼠尾巴时全笼大鼠被激怒,随着刺激次数的增加,撕咬逐渐加剧,3 d 后,大鼠间剧烈撕咬逐渐减弱,伴有进食减少,体倦,毛发变暗,体重下降。 足底电刺激法模型:宇克莉等[10]用电刺激的方法对大鼠足底电刺激,每次刺激 30~60 s,间隔 20~30 min 重复刺激,每只每日共刺激 4 h,连续 3 个月,大鼠会出现肝郁表现。 捆绑式动物模型[11]:Wistar 大鼠,雄性体重(240±28)g。将大鼠用细布条捆住四肢,使其行走困难,活动受限,然后定时观察大鼠状态,时间为 1 周;模型大鼠呈现胡须下垂,叫声尖细,贴边扎堆,活动、饮食减少等改变,这种办法符合肝郁模型的实际。模具激怒模型[12]:雌性 Wistar大鼠,体重 300~400 g,用红色有机玻璃(块厚 0.2 cm、直径 4 cm)组成类似颈部枷锁形的模具,根据动物大小调节模具大小;戴模具(单笼饲养)7 d,前 5 d 动物戴模具后会出现暴跳、抓咬笼具、不断撕叫等反常表现;后 2 d 逐渐反应迟钝,行为逐渐迟缓,动物眼 睛眯小,毛色枯黄,粪便小、干、少,体重减轻。 多种刺激法[13-14]:用多种刺激方法对大鼠进行刺激,反复断水、食物,冰水游泳,冷热环境,震荡,夹尾巴,黑白颠倒等不断刺激。 慢性束缚法:严灿等[5]、李娜等[15]采用慢性束缚的方法, 将模型大鼠置于特殊制作的束缚箱内,通过移动插片逐渐缩小大鼠活动的空间,调节到其不产生强烈反抗的最小空间; 每日开始的时间不固定,每日束缚 1 次,束缚时间从第 1 天的 4 h 逐渐增加至每天 6 h,连续 21 d。
对于肝郁模型的制备,夹尾急性激怒法首先作用时间比较短,不符合长期情绪刺激的实际,对于这种办法笔者开始进行了尝试,前几次大鼠会剧烈撕咬,但是大鼠适应了这种环境后,相互之间又和平共处,而且这种方法是一种肝气逆模型的制备方法;足底电刺激法好像对大鼠有恐惧的作用,不符合郁怒刺激,且这种方法操作复杂,刺激多样,可以导致不同的情绪反应,因此笔者认为不符合实际。 捆绑式、模具激怒及慢性束缚法操作简单,又符合制备肝郁模型的实际,本实验选择慢性束缚法。 在实验过程中,关键是调节束缚板的距离,既让大鼠受到足够的挤压,又不至于让大鼠因挤压过度影响呼吸致死,注意有足够的呼吸通道,防止大鼠窒息。
TNF-α 作为一种单核因子, 具有广泛的生物学活性,不仅能够提高中性粒细胞的吞噬能力,还可以增强抗体依赖性细胞介导的细胞毒作用。 IL-1β 具有广泛的免疫调节作用, 并有致热和介导炎症的作用。大量研究表明,慢性前列腺炎患者前列腺分泌物或精液中可出现某些炎性因子水平变化[16-17]。 有研究认为,免疫调节异常在慢性前列腺炎的发病中占重要地位,主要表现为 TNF-α、IL-8 等促炎因子增多,导致前列腺腺管、腺泡及腺体周围有淋巴细胞、单核细胞及浆细胞等大量炎症细胞浸润[18]。
贺大林等[19]采用 ELISA 观察 38 例Ⅲ型前列腺炎患者和 12 例正常人的前列腺液中 TNF-α 和 IL-8 的表达,结果发现,前列腺炎患者前列腺液中 TNF-α 和IL-8 浓度明显高于正常人,表明 TNF-α 和 IL-8 参与该 病 的 发病过 程 。 本 实验也 表 明 ,CNP 大 鼠 模型 中TNF-α、IL-1β 炎症因子有表达增高现象,在肝郁模型前列腺组织中 TNF-α、IL-1β 炎症因子表达更明显。
通过制备 CNP 模型,对 TNF-α、IL-1β 的监测发现, 模 型 组 TNF-α、IL-1β 指 标 明 显 升 高 , 提 示 CNP与免疫有关。 对于肝郁并 CNP 模型的制备,束缚法是常用的一种制备肝郁模型方法,运用这种制备方 法,确实能诱导大鼠出现肝郁表现,为以后制备肝郁模型提供参考,一些经验教训值得借鉴。 通过对这种病证结合模型病理以及一些免疫指标的监测,发现肝郁后前列腺炎的炎性改变加重,免疫指标相对于非肝郁组也有变化,显示肝郁能够加重前列腺炎炎性改变或肝郁可导致非细菌性前列腺炎。
[1] 郭应禄,李宏军.前列腺炎[M].北京:人民军医出版社,2003:79-98.
[2] Schaeffer AJ,Knauss JS,Landis JR,et al. Leukocyte and bacterial counts do not correlate with severity of symptoms in men with chronic prostatitis:the National Institutes of Health Chronic Prostatitis Cohort Study [J]. J Urol,2002,168(3):1048-1053.
[3] 陈群,王翠华,严志强,等.慢性前列腺炎病人情绪因素与森田疗法[J].中华男科学杂志,2003,9(9):676-678.
[4] 陈修德,郑宝钟,金讯波,等.慢性前列腺炎心理障碍及其治疗[J].中华男科学杂志,2004,10(2):112-114.
[5] 严灿,徐志伟,吴丽丽,等.建立中医情志致病动物模型的思考[J].中国临床康复,2006,10(3):155-157.
[6] Nickel JC,Johnston B,Downey J,et al. Pentosan polysulfate therapy for chronic nonbacterial prostatitis (chronic pelvic pain syndrome category ⅢA):a prospective multicenter clinical trial [J]. Urology,2000,56(3):413-417.
[7] 李冬梅,曹 霖,孙祖 越.前列 腺炎 动物模型 研究进展 [J].实验动物与比较医学,2007,27(3):211-212.
[8] 叶伟成,薛慈民,徐兆东,等.免疫佐剂法制作慢性非细菌性前列腺炎小鼠模型的方法[J].中国男科学杂志,2001,15(1):29.
[9] 须惠仁,傅湘琦,向丽华,等.肝郁证的动物实验研究——激 怒 刺 激 对 大 白 鼠 血 液 流 变 学 的 影 响 [J].中 医 杂 志 ,1991,32(6):44-47.
[10] 宇克莉,孙建华,毕平,等.大鼠肝郁证所致冠心病心肌超微结构变化的研究[J].天津师范大学学报:自然科学版,1999,19(4):45-48.
[11] 乔明琦,张惠云,陈雨振,等.肝郁证动物模型研究的理论思考[J].中国医药学报,1997,12(5):42-44.
[12] 陈小野.实用中医证候动物模型学[M].北京:北京医科大学中国协和医科大学联合出版社,1993:263.
[13] 金光亮,南睿,郭霞珍.慢性应激肝郁证大鼠模型的建立[J].北京中医药大学学报,2003,26(2):18-21.
[14] 张庆业,廖小红,范丽霞,等.肝郁脾虚泄泻大鼠模型的建立及评价[J].中国实验动物学报,2014,22(3):20-23. [15] 李娜,刘群,李晓娟,等.2 型糖尿病兼抑郁症大鼠模型的建立与评价[J].中国实验动物学报,2014,22(4):16-19.
[16] Motrich RD,Maccioni M,Molina R,et al. Reduced semen quality in chronic prostatitis patients that have cellular autoimmune response to prostate antigens [J]. Hum Reprod,2005,20(9):2567-2572.
[17] Hochreiter WW,Weidner W. Prostatitis— a frequently unrecognized disease [J]. Ther Umsch,2006,63(2):117-121.
[18] 谷现愿,潘柏年.现代前列腺疾病[M].北京:北京医科大学中国协和医科大学联合出版社,1996:17-19.
[19] 贺大林,周锋,何辉,等.前列腺按摩液中 IL-8 和 TNF-α 测定在慢性前列腺炎诊断、分型中的临床意义[J].中华男科学杂志,2004,10(10):40-42.
Relationship between liver depression and chronic non-bacterial prostatitis
SUN Hongfu1LIU Yan2WA NG Weidong1GAO Zhaowang1ZHANG Qingxiang2▲
1.Department of Urology Surgery, Affiliated Hospital of Shandong University of TCM, Shandong Province, Ji'nan 250014,China;2.Basic Medical College ofShandong University of TCM,Shandong Province,Ji'nan 250011,China
ObjectiveTo establish method of chronic non-bacterial prostatitis (CNP) and liver depression rat model and probe into the relationship between liver depression and CNP.Methods50 male Wistar rats were chosen for experiment, among which 37 rats were chosen for model group, 5 rats were chosen for preparation group and the other 8 rats were chosen for blank group.6 rats were randomly selected as CNP group and 6 rats as liver depression combined with CNP group in model group.First,the modelof CNP were made by Freund′s adjuvant method to observe the pathological change of prostate and level change of TNF-α, IL-1β; then, the liver depression pattern of CNP was made by binding method to observe the pathological changes of prostate and level change of TNF-α, IL-1β.ResultsFreund′s adjuvant method could lead to rat prostate inflammatory change and the level rising of TNF-α and IL-1β. TNF-α,IL-1β level of rat prostate in CNP group and liver depression combined with CNP group was higher than that in blank group respectively, with statistical difference (P< 0.05).TNF-α,IL-1β level of rat prostate in liver depression combined with CNP group was higher than that in CNP group respectively, with statistical difference (P< 0.05).ConclusionFreund′s adjuvant method combined with the binding method can prepare liver depression pattern of CNP, liver depression can aggravate inflammatory change of CNP.
Chronic non-bacterialprostatitis;Liver depression;Combination model of disease and syndrome;Rat
R697+.33
A
1673-7210(2015)08(b)-0021-04
2015-04-27 本文编辑:李亚聪)
山东省中医药科技发展计划项目(2013-051)。
▲
