妊娠期甲状腺疾病筛查和干预对妊娠结局的影响
2015-01-11王洁陈晓娟
王洁 陈晓娟
广东省深圳市龙华新区人民医院,广东深圳518109
妊娠期甲状腺疾病筛查和干预对妊娠结局的影响
王洁 陈晓娟
广东省深圳市龙华新区人民医院,广东深圳518109
目的探讨甲状腺疾病筛查以及干预对孕妇妊娠结局的影响。方法选取2012年9月~2014年8月广东省深圳市龙华新区人民医院内分泌科和产科就诊的2490例孕妇,对其进行甲状腺功能和甲状腺抗体筛查,将患有甲状腺疾病的孕妇分为治疗组(192例)和未治疗组(192例),余2124例无甲状腺疾病的孕妇设为正常组。未治疗组不予任何干预治疗,治疗组按照孕妇的筛查结果给予相应的治疗。观察统计孕妇在不同妊娠期(妊娠时间<13周为T1期,13~<28周为T2期,≥28周为T3期)甲状腺激素和甲状腺过氧化物酶抗体(TPoAb)的水平。比较两组孕妇不良妊娠结局和产科并发症的发生情况。结果2490例孕妇中,甲状腺疾病总患病率为15.42%,其中临床甲减者占1.91%,亚临床甲减者占6.75%,临床甲亢者占0.24%,亚临床甲亢者占0.96%,低甲状腺素血症者占2.91%,甲状腺功能正常TPoAb阳性者占2.65%。对甲状腺功能正常孕妇进行随访,检测血清发现:随着孕龄的增加,血清FT3、FT4水平不断下降,血清FT3、FT4、TSH水平T1与T3期比较、T2与T3期比较,差异均有统计学意义(均P<0.05)。未治疗组中,甲状腺功能正常TPoAb阳性及亚临床甲减孕妇所分娩的新生儿出生5 min后Apgar评分均明显低于正常组,差异均有统计学意义(P<0.05);各种甲状腺疾病孕妇的不良妊娠结局和产科并发症总患病率均高于正常组,差异均有统计学意义(P<0.05)。治疗组中,所有患有甲状腺疾病的孕妇经过相应的治疗后,不良妊娠结局和产科并发症总患病率与正常组比较,差异均无统计学意义(P>0.05)。结论及时筛查妊娠期甲状腺疾病并根据具体筛查结果积极进行相应的干预治疗可明显改善妊娠结局。
妊娠期;甲状腺疾病;妊娠结局;干预治疗
甲状腺激素(thyroid hormones,TH)是人类机体生长和发育所必需的激素之一[1],主要包括:三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)。妊娠期间,TH直接参与胎盘发育,而且几乎参与到胎儿的整个神经系统发育过程,是胎儿神经系统发育中不可或缺的调控激素之一[2]。甲状腺疾病是常见的内分泌疾病,孕妇是甲状腺疾病的高发人群[3],如果孕期出现甲状腺疾病,孕妇和胎儿的发育都会受到极其严重的影响。如果没有得到及时诊断,很容易导致流产、甲减、甲亢及新生儿先天性畸形等一系列严重并发症。因此,本研究对甲状腺疾病的筛查和干预对孕妇妊娠结局的影响进行了分析,现将结果报道如下:
1 资料与方法
1.1 一般资料
选取2012年9月~2014年8月广东省深圳市龙华新区人民医院内分泌科和产科就诊的2490例孕妇,所有孕妇均无甲状腺疾病等相关疾病的病史。对所选孕妇进行甲状腺疾病筛查,根据筛查结果将患有甲状腺疾病的孕妇分为治疗组(192例)和未治疗组(192例)。其中,治疗组孕妇年龄23~29岁,平均(25.32±3.41)岁;未治疗组孕妇年龄22~27岁,平均(24.69±4.16)岁。余2124例孕妇无甲状腺疾病为正常组,年龄22~29岁,平均(25.14±4.06)岁。三组孕妇年龄等一般资料比较差异无统计学意义(P<0.05),具有可比性。
1.2 方法
1.2.1 甲状腺疾病筛查方法
所有孕妇情绪平稳时采取空腹静脉血3 mL,静置2 h后,离心机中进行离心后取出,提取血清并将其放置-20℃的冰箱中保存备用。
1.2.2 血清甲状腺激素及抗体的测定
1.2.2.1 游离三碘甲腺原氨酸(FT3)应用放射免疫法(RIA)测定FT3,试剂盒由法国IMMUNOTECH公司生产,检测范围:0.5~44 pmol/L,参考范围:2.5~5.8 pmol/L。
1.2.2.2 游离甲状腺素(FT4)应用放射免疫法(RIA)测定FT4,试剂盒由法国IMMUNOTECH公司生产,检测范围:0.4~75 pmol/L,参考范围:11.5~23 pmol/L。
1.2.2.3 促甲状腺激素(TSH)应用免疫荧光分析法(IFMA)测定TSH,试剂盒由天津协和医药科技有限公司生产,检测范围:0.03~50 mU/L,参考范围:0.25~4 mU/L。
1.2.2.4 甲状腺过氧化物酶抗体(TPoAb)应用放射免疫法(RIA)测定TPoAb,试剂盒由英国RSRLtd公司生产,检测范围:2~5000 U/mL,参考范围:<15 U/mL。以上各指标的批间差异和批内差异(CV)均<10%。
1.2.3 诊断标准
①临床甲减(临床甲状腺功能减退症):TSH>4.0 mU/L,FT4和/或FT3水平低于正常值。②亚临床甲减(亚临床甲状腺功能减退症):TSH>4.0 mU/L,FT3和FT4水平在正常范围内。③临床甲亢(临床甲状腺功能亢进症):TSH<0.25 mU/L,FT4和/或FT3水平升高。④亚临床甲亢(亚临床甲状腺功能亢进症):TSH浓度下降,FT4和FT3水平正常。⑤TPoAb阴性(-):TPoAb<0.25 U/mL。⑥TROAb阳性(+):TPoAb>9.0 U/mL[4]。
1.3 研究方法
正常组的孕妇每月进行1次血清FT4、FT3和TSH的检查,并按妊娠分期记录其平均值;未治疗组不进行任何干预治疗;根据甲状腺疾病的具体筛查结果,治疗组的孕妇在临床医生的指导下进行治疗,并且每月进行血清FT4、FT3和TSH的复查,如果干预效果不明显应该及时调整用药情况,当TSH达到正常水平后,可每2个月复查1次;平均每2个月对三组孕妇进行1次CT检查;记录孕妇的不良反应情况以及胎儿或新生儿的并发症发生情况。干预治疗结束后,将三组实验数据进行对比研究。
1.4 新生儿评分标准
新生儿Apgar评分[5]:新生儿出生5 min后根据皮肤颜色、心率、呼吸、肌张力及运动、反射5项体征进行对新生儿的身体状况进行评分。评分标准:0~3分:新生儿患有重度窒息;4~7分:新生儿患有轻度窒息;8~9分:新生儿身体状况良好;10分:正常新生儿。评分越高,新生儿的身体状况越好。
1.5 妊娠分期
将妊娠早期(妊娠时间<13周)设为T1期;妊娠中期(妊娠13~<28周)设为T2期;妊娠晚期(妊娠时间≥28周)设为T3期。
1.6 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 妊娠期甲状腺功能异常及TPoAb阳性率
逐一检查2490例孕妇的血清FT3、FT4、TSH水平,可见妊娠期孕妇甲状腺功能异常的总患病率高达15.42%,其中亚临床甲减的患病率最高,其次为低甲状腺素血症,而临床甲亢的患病率最低,差异有统计学意义(P<0.05)。见表1。

表1 孕妇甲状腺功能异常的患病率
2.2 正常孕妇血清FT3、FT4、TSH水平在不同孕期的变化
对正常孕妇血清FT3、FT4、TSH在妊娠期不同时期的不同水平进行检测后发现:FT3和FT4在随着孕龄的增加呈下降趋势,血清FT3、FT4、TSH水平T1期与T3期比较、T2期与T3期比较,差异均有统计学意义(均P<0.05)。见表2。
2.3 两组孕妇产科并发症和不良妊娠结局的患病情况
两组孕妇中各种甲状腺疾病未治疗组的产科并发症和不良妊娠结局的总患病率均高于正常组
(7.02%),且差异有统计学意义(P<0.05)。与正常组比较,未治疗组中甲状腺功能正常TPoAb阳性者和临床甲减者总患病率比较,差异有统计学意义(P<0.05),治疗组中亚临床甲减未、亚临床甲亢未孕妇和未治疗组中低甲状腺素血症患者与正常组比较,差异均有高度统计学意义(P<0.01)。而治疗组总患病率与正常组比较差异均无统计学意义(P>0.05)。治疗组中亚临床甲减未和未治疗组中甲状腺功能正常TPoAb阳性孕妇分娩的新生儿出生5 min后Apgar评分明显低于正常组新生儿,差异均有统计学意义(P<0.05),治疗组中临床甲亢和未治疗组中均未出现不良妊娠结局和并发症。见表3。
表2 正常孕妇在妊娠期3个不同时期血清FT3、FT4、TSH水平

表2 正常孕妇在妊娠期3个不同时期血清FT3、FT4、TSH水平
注:与T1期比较,*P<0.05;与T2期比较,△P<0.05;FT3:游离三碘甲腺原氨酸;FT4:游离甲状腺素;TSH:促甲状腺激素
孕期FT3(pmol/L)FT4(pmol/L)TSH(mU/L)T1期T2期T3期4.54±0.63 4.26±0.46 3.37±0.35*△14.75±1.91 13.67±1.77 11.49±1.76*△1.36±0.53 1.69±0.43 1.57±0.60*△
3 讨论
甲状腺激素与机体的生长发育密切相关[6],由于胎儿在妊娠早期发育不完善,其生长、发育、代谢等机体活动所需的甲状腺激素均来自母体[7],如果母体此时的甲状腺功能发生异常,则会导致胎儿发育迟缓、不完善以及新生儿智力减退[8]、孕妇流产等一系列不良结局,可见甲状腺功能对妊娠期孕妇及胎儿的健康都极其重要[9]。从本次研究可以看出,FT3和FT4的浓度在T1、T2期和T3期分别为(4.54±0.63)pmol/L和(14.75± 1.91)pmol/L、(4.26±0.46)pmol/L和(13.67±1.77)pmol/L、(3.37±0.35)pmol/L和(11.49±1.76)pmol/L,可见FT3和FT4的浓度随着孕龄的增加而逐渐下降,分析其原因为:在整个妊娠过程中,胎儿的生长和发育增加了其对碘的需求量,从而导致母体甲状腺激素的相对不足[10]。
就本次研究的结果来看,通过提早对孕妇进行甲状腺疾病的筛查,发现孕妇甲状腺功能异常的患病率高达15.42%,说明提早对孕妇进行甲状腺异常筛查能够尽早发现孕妇的健康状况,以便对其进行干预治疗。将其分为治疗组和未治疗组,未治疗组孕妇中各种甲状腺功能异常的妊娠不良结局和并发症的总患病率分别为12.50%、14.29%、33.33%、16.67%、13.89%和9.10%,正常组孕妇的妊娠不良结局和并发症患病率为7.02%,可见未治疗组孕妇的总患病率高于正常组孕妇,差异有统计学意义(P<0.05)。由此可见,甲状腺功能异常可以导致多种不良妊娠结局,例如流产、妊娠期高血压疾病、胎儿宫内窘迫等,严重者还可能影响胎儿神经系统及视力发育[11],导致新生儿畸形等情况的发生。而治疗组经过相应的药物干预治疗,最后孕妇妊娠的不良结局以及并发症的总患病率分别为0.00%、4.76%、8.33%、5.56%和3.03%,与正常组孕妇比较差异均无统计学意义(P>0.05),相对于未治疗组的孕妇妊娠结局也有了明显的改善(P<0.05)。对分娩孕妇的新生儿评分发现,未治疗组中亚临床甲减和甲状腺功能正常TPoAb阳性孕妇的新生儿分数明显比正常组低(P<0.05),而治疗组中亚临床甲减和甲状腺功能正常TPoAb阳性孕妇的新生儿分数与正常组比较,差异无统计学意义(P>0.05)。这些都充分说明在妊娠期提早对孕妇进行甲状腺疾病的筛查,并根据具体筛查结果给予相应的干预治疗,可以明显改善孕妇妊娠的并发症以及不良结局的发生[12]。
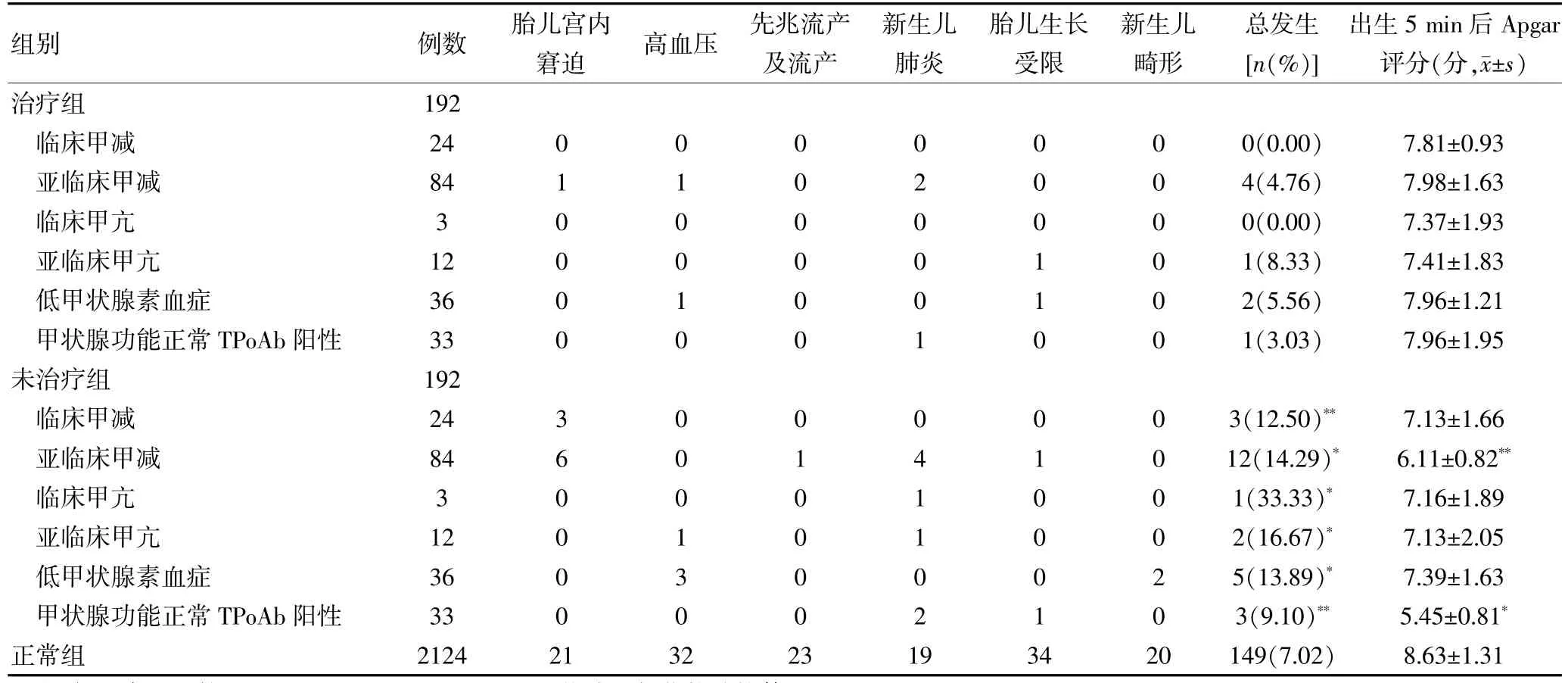
表3 各种甲状腺疾病产科并发症和不良妊娠结局以及新生儿Apgar评分比较(例)
甲状腺疾病是威胁孕妇自身健康和胎儿发育的高危疾病[13],如果对患有甲状腺疾病的孕妇没有进行及时且有针对性的治疗或者治疗效果不佳,无论是母体本身还是胎儿发生并发症的概率均很大[14]。通过提早筛查甲状腺疾病有助于对甲状腺疾病的早期控制,对于保护孕妇健康和提高后代智力水平具有十分重要的意义[15-16]。因此,对于妊娠期甲状腺疾病应该早发现、早干预、早治疗[17],在妊娠早期对孕妇进行甲状腺疾病的筛查,对于患有甲状腺疾病的孕妇应当尽早进行干预治疗[18],并在整个妊娠期都给予密切的监测[19],直至甲状腺疾病病情得到控制。
综上所述,及时筛查妊娠期甲状腺疾病并根据具体筛查结果积极进行相应的干预治疗可明显改善妊娠结局。
[1]王佳燕,王晔恺,陈萍.舟山地区2011年-2012年孕检妇女血清FT3、FT4和TSH调查分析[J].放射免疫学杂志,2013,26(5):576-577.
[2]孟虎山.妊娠期孕妇甲状腺激素的临床分析[J].中国医药指南,2013,11(14):197-198.
[3]肖锋,黄敏华,苏丽媚.甲状腺功能检查在孕前检查中的意义[J].现代医院,2013,13(4):62-63.
[4]毛玲玲.妊娠期甲状腺功能减退对妊娠结局的影响及药物干预效果评价[J].中国医药导报,2014,11(26):142-144.
[5]GarberJR,Cobin RH,Gharib H,etal.Clinicalpractice guidelines for hypothyroidism in adults:cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association[J].Thyroid,2012,22(12):1200-1235.
[6]戴维,江咏梅.妊娠期甲状腺功能筛查指标的参考值建立及方法学研究现状[J].中华检验医学杂志,2013,36(1):10-13.
[7]徐跃,陈乔彬,皇甫英,等.妊娠合并甲状腺功能减退症激素替代治疗后的妊娠结局分析[J].中国医药导报,2014,11(23):140-147.
[8]陶欣.孕妇促甲状腺激素异常对胎儿发育的影响[J].检验医学与临床,2012,9(18):2361-2362.
[9]刘爱胜,陈荣贵,文艳,等.初孕孕妇甲状腺功能状况临床研究及诱因分析[J].国际检验医学杂志,2012,33(14):1778-1779.
[10]陈秀兰,李莲.探讨孕妇不同孕期尿碘含量对新生儿甲状腺功能的影响[J].中国医药导报,2012,9(27):95-102.
[11]De GrootL,Abalovich M,Alexander EK,etal.Management of thyroid dysfunction during pregnancy and postpartum:an Endocrine Society clinicalpractice guideline[J].J Clin Endocrinol Metab,2012,97(8):2543-2565.
[12]吴辉.甲状腺功能检测在妊娠妇女中的应用价值[J].国际检验医学杂志,2012,33(12):1508-1509.
[13]Karakosta P,A1egalis D,Georgiou V,etal.Thyroid dysfunction and autoantibodies in early pregnancy are associated with increased risk of gestational diabetes and adverse birth outcomes[J].JClin Endocrinol Metab,2012,97(12):4464-4472.
[14]沈红云.甲状腺功能异常孕妇1500例妊娠结局临床分析[J].陕西医学杂志,2012,41(4):436-437.
[15]Yan YQ,Dong ZL,Dong L,et al.Trimester-and methodspecific reference intervals for thyroid tests in pregnant Chinese women:methodology,euthyroid definition,and iodine status can influence the setting of reference interval[J].Clin Endocrinol(Oxf),2011,74(2):262-269.
[16]解裕豆,高云.妊娠合并甲状腺功能减退症的研究进展[J].临床误诊误治,2012,25(1):93-96.
[17]贺昌华.甲状腺功能异常对孕妇及妊娠结局的影响[J].中国医药导报,2014,11(17):139-141.
[18]Mannisto T,Vaarasmaki M,Pouta A,et al.Thyroid dysfunction and autoantibodies during pregnancy as predictive of pregnancy complication and maternal morbidity in later life[J].J Clin Endocrinol Metab,2010,95(3):1084-1094.
[19]Behrooz HG,Tohidi M,Mehrabi Y,et al.Subclinical hypothyroidism in pregnancy:intellectual development of offspring[J].Thyroid,2011,21(10):1143-1147.
Effect of screening and intervention in gestational thyroid disease on pregnancy outcome
WANG Jie CHEN Xiaojuan
The People's Hospital of Longhua New District in Shenzhen City,Guangdong Province,Shenzhen 518109,China
ObjectiveTo investigate thyroid disease screening and intervention effects on pregnancy outcome of pregnant women.Methods2490 cases of pregnant women from September 2012 to August 2014 in endocrinology department and obstetrical department of the People's Hospital of Longhua New District in Shenzhen City were selected,and they were given thyroid function and thyroid antibody screening.They were divided into treatment group(192 cases) and non-treatment group(192 cases).2124 pregnant women without thyroid disease as the normal group.Pregnant women of the treatment group without any intervention,while pregnant women of the treatment group were given the appropriate treatment in accordance with their screening results.the statistics and observation of all pregnant women in different gestational(<13 weeks of gestation or less was T1phase;13-<28 weeks of pregnancy was T2stage;≥28 weeks was the T3stage)thyroid hormones and thyroid peroxidase antibody levels were carried;and the adverse pregnancy outcomes and obstetric complications of two groups were compared.ResultsIn 2490 cases,thyroid disease,the total prevalence rate was 15.42%,of which 1.91%with clinical hypothyroidism,6.75%with subclinical hypothyroidism, clinical hyperthyroidism and subclinical hyperthyroidism was 0.24%,0.96%respectively,2.91%of hypothyroxinemia, thyroid function was normal but TPoAb positive was 2.65%.Follow-up on thyroid function of normal pregnant women, the detection of serum showed that:with the increase of gestational weeks,serum FT3,FT4 levels continue to decline, while TSH showed a rising trend,compared the serum FT3,FT4 and TSH level between T1and T3stage,T2and T3stage,the differences were statistically significant(allP<0.05).In non-treatment group,Apgar score 5 min of newborns after delivered of pregnant women with thyroid function and TPoAb positive,and subclinical hypothyroidism were significantly lower than the normal group,the differences were statistically significant(P<0.05);adverse pregnancy outcomes,the total prevalence rate of obstetric complications of pregnant women with various thyroid diseases were higher than that in the normal group,the differences were statistically significant(P<0.05).In the treatmentgroup,adverse pregnancy outcomes and total prevalence of obstetric complications of all pregnant women with thyroid disease after corresponding treatment had no statistically significant differences compared with the normal group(P>0.05).ConclusionTimely screening for gestational thyroid disease and actively intervene therapy according to the corresponding specific screening results can significantly improve the outcome of pregnancy.
Pregnancy;Thyroid disease;Pregnancy outcome;Intervention therapy
R541.6
A
1673-7210(2015)08(b)-0071-04
2015-03-10本文编辑:任念)
广东省深圳市龙华新区社会公益科研项目(2013056)。
