Schiff 碱金属配合物抗肿瘤活性研究进展
2015-01-10钟霞刘雯清陈年根高炳淼张俊清
钟霞,刘雯清,陈年根,高炳淼,张俊清
1.海南医学院药学院,海南海口 571199;2.上海迪亚凯特生物科技有限公司,上海 200120
Schiff 碱(Schiff Bases)是一类含有甲亚胺基的化合物,Schiff 碱基团通过碳-氮双键(-C=N-)上的氮原子及与之相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为供体与金属原子(或离子)配位,形成各种Schiff 碱金属配合物。研究表明Schiff 碱金属配合物具有良好的抗肿瘤活性,由于其具有一系列重要的生物学活性,如损伤DNA、断裂质粒、断裂蛋白及促使癌细胞凋亡作用[1],它已成为新型抗肿瘤药的备选者之一。Schiff 碱金属配合物的抗肿瘤活性研究已逐渐成为配位化学及抗肿瘤药物研究的热点,该文将对近年来国内、外Schiff 碱金属配合物抗肿瘤活性的最新研究进展作一综述,现报道如下。
1 Schiff 碱的抗肿瘤活性
在近年的抗肿瘤药物研发中,发现一些Schiff 碱及其衍生物具有抗肿瘤活性。
氟喹诺酮类是一种常用的抗菌药物,但研究发现一些氟喹诺酮类也有一定的抗肿瘤活性,其抗菌和抗肿瘤作用的靶点分别是原核生物Ⅱ型拓扑异构酶和真核生物Ⅱ型拓扑异构酶。由于氟喹诺酮类抗菌和抗肿瘤机制相似,且作用靶点的酶序列也具有相似性,因此已有很多研究尝试通过修饰和优化具有抗菌作用的氟喹诺酮类结构,研发新型氟喹诺酮类抗肿瘤药物。Hu 等人[2]设计合成了源于氧氟沙星的抗肿瘤化合物。他们以反式苯三唑取代氧氟沙星C-3 位的羧基,进而合成了两个系列11 种含有Schiff 碱和Schiff-mannich 碱侧链的衍生物。用MTT 法对其体外抗肿瘤活性进行测试,显示这些含有Schiff 碱和Schiff-mannich 碱侧链的化合物均对L1210、CHO 和HL60 肿瘤细胞有一定的抑制作用。其中含有苯酚游离基团的化合物具有更强的抗肿瘤活性。
由于磺胺类、噻唑酮类和苯并噻嗪类在对抗病原微生物及肿瘤细胞中有广泛运用,并且Schiff 碱也具有抗肿瘤活性,Kamel[3]和他的同事将4-氨基-N-吡啶-2-苯磺酰胺基与不同的单糖或芳香醛进行冷凝反应得到一系列磺胺-Schiff 碱2a-c 和4a-e。将2a-c 与巯基乙酸反应从而合成含碳核苷的3a-c,而将4a-e 与巯基乙酸或巯基苯甲酸反应得到相应的噻唑酮衍生物和苯并噻嗪衍生物,以期测试这些新型衍生物的抗肿瘤活性。以5-FU和多柔比星为对照药物,体外测试发现这些化合物对HELA(人宫颈癌细胞)和MCF-7(人乳腺癌细胞)具有明显抑制作用。它们对HELA 和MCF-7 均显示出强于多柔比星的抗癌活性(IC50:0.74~3.56 mg/mL),不过相比于5-FU,它们的抗癌活性并没有很大优势。
他们还对其进行了分子对接测试,分子对接测试可以反映化合物与酶结合的亲和力大小。用分子自动对接仪3.0.5 程序对这些Schiff 碱及其衍生物测试,发现其与PTK(酪氨酸激酶)的分子对接亲和力很强,而酪氨酸激酶参与肿瘤的生长和分化,酪氨酸激酶抑制剂已在临床治疗中有所运用,如伊马替尼、吉非替尼和赫赛汀,一些新的酪氨酸激酶抑制剂也正在人体试验和研发当中。
通过体外抗肿瘤细胞活性测试及分子对接测试,Kamel 和他的同事有力地证明了Schiff 碱及其衍生物是抗肿瘤新药的潜力备选者,也为科研工作者揭示了先导化合物优化的新思路。
2 Schiff 碱金属配合物的抗肿瘤活性
2.1 Schiff 碱与金属配合形成配合物后抗肿瘤活性增强
如上所述,一些Schiff 碱本身就具有抗肿瘤活性,但研究发现,在与金属配合形成Schiff 碱金属配合物后它们的抗癌活性增强。
Sathiyaraj 等人[4]合成并表征了Schiff 碱配体(图1)及其过渡金属钌(Ru) 的3 种新型Schiff 碱金属配合物。细胞毒性实验表明其对HELA 和人喉上皮癌细胞(HEP-2)有抑制作用。配体对HELA 有较高抑制作用(IC50=175 μM)但对HEP-2 的抑制作用较弱(IC50=389 μM),而3 种配合物对这两种癌细胞的IC50 分别为:配合物1=149,244 μM;配合物2=123,212 μM;配合物3=87,149 μM,这说明了在配体与Ru 配合形成Schiff 碱金属配合物后,抗肿瘤活性增强。
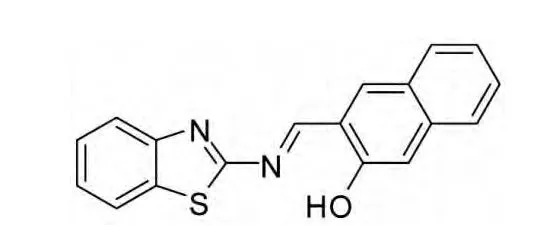
图1 Schiff 碱配体
2.2 模拟活性因子的Schiff 碱金属配合物
近年来,根据肿瘤发生和凋亡的分子生物学基础,一些新型Schiff 碱金属配合物已被合成,用于模拟生物体内抗肿瘤的活性物质,从而开发新型抗肿瘤药物。
SOD(超氧化物歧化酶)是一种金属蛋白酶(包括Cu-Zn SOD、Mn-SOD、Fe-SOD),它是生物体内的一线抗氧化酶,不仅具有调节机体氧化还原的作用,同时也是一个肿瘤抑制因子,SOD 模拟化合物可以诱导肿瘤细胞凋亡。Tabassum[5]等人合成并表征了4 种Cu-SOD 模拟化合物:源于香草醛的Schiff 碱Cu 配合物1-4:[CuLH(OAc)(H2O)Y](LH=2-((E)-1,3-二羟基-2-甲基丙烷-2-亚甲胺基)-6-甲氧基苯酚),1:Y=H2O;2:Y=(1,10-邻二氮杂菲)苯酚,3:Y=tpimH(2,4,5-三苯咪唑);4:Y=tfbimH(2-(三氟代甲基)苯并咪唑)。他们对其DNA 结合作用、DNA断裂作用、拟SOD 作用和抗肿瘤活性进行了研究,发现4 种配合物以不同的非共价键方式与CT-DNA 结合,其中2 的SOD 活性和抑癌细胞能力最强。
3 Schiff 碱金属配合物抗肿瘤作用的机制
Ma[6]等人对新合成的Schiff 碱Cu(II)配合物(图2)的抗肿瘤活性进行了研究,发现其对人乳腺癌细胞MCF-7 有生长抑制和细胞凋亡作用,并揭示了其潜在的抗肿瘤机制。
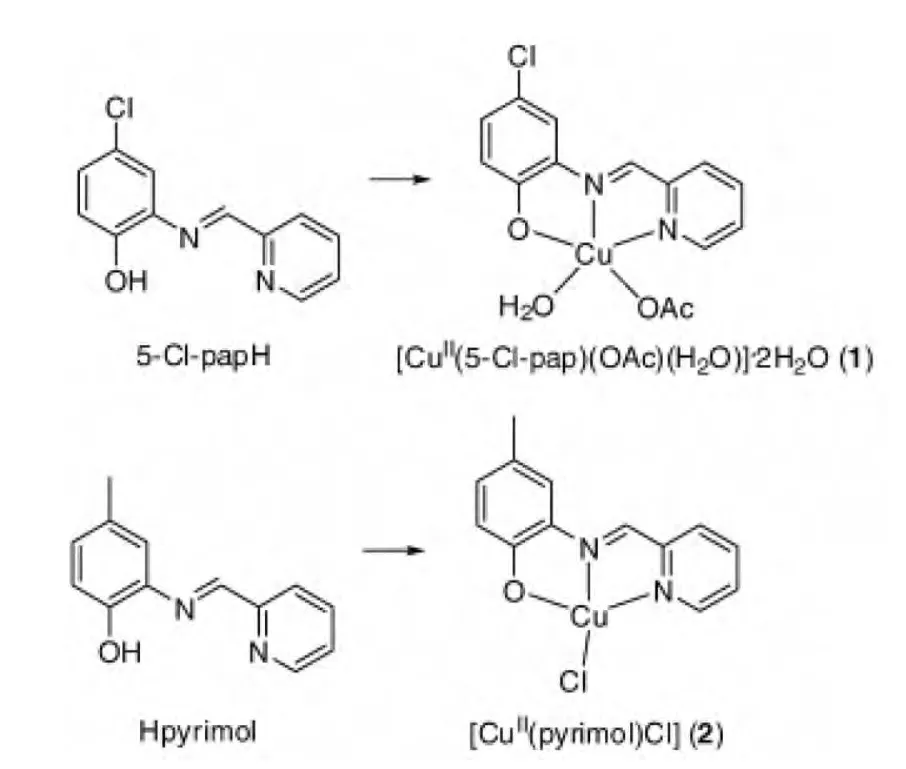
图2 Schiff 碱配体及其Cu(II)配合物
实验结果及机制分析如下。
MTT 试验:以顺铂为对照,MTT 试验结果表明,该配合物的IC50 在24 h 和48 h 均低于顺铂的IC50,成株试验的结果也良好地对应于MTT 的测试结果,表明了这种新合成的Schiff 碱铜配合物具有很强的抗肿瘤活性,其对MGF-7 的杀伤力在一定程度上强于顺铂。
荧光显微观察:赫斯特33342 荧光染色和膜联蛋白V-FITC/PI 染色实验表明,受该配合物作用的肿瘤细胞发生了核断裂,该配合物诱导了细胞凋亡,且具有剂量依赖性。
原子吸收分光光度法:原子吸光仪测试显示被该铜配合物作用的MCF-7 细胞内发生了一种时间依赖性的铜摄取增多的现象,同时进行的MTT 测试表明了这种铜摄取与细胞凋亡有直接关系。而细胞凋亡曾被认为与活性氧(ROS)的产生和累积有关,但是铜摄取水平、ROS累积和细胞凋亡三者之间的进一步关系还未被清楚阐明。
彗星试验:结果表明此配合物使MCF-7 细胞发生严重的DNA 断裂现象。
流式细胞术:流式细胞术分析表明此配合物对MCF-7 的抗肿瘤作用与细胞周期停滞有关。
荧光探针JC-1 检测:结果表明,受配合物作用的MCF-7 细胞线粒体膜电位下降,这是细胞凋亡早期的一个标志性事件,说明配合物抗肿瘤作用机制可能是通过线粒体通路进行的。同时,研究中发现该配合物能够上调凋亡相关基因-Bax 的表达并激活半胱氨酸蛋白酶9和3(细胞凋亡蛋白酶9 和3)。
由近年来最新的研究结果我们可以发现,Schiff 碱金属配合物可以通过DNA 断裂作用、线粒体通路、上调细胞凋亡蛋白酶通路等多维途径诱导肿瘤细胞凋亡。Schiff 碱金属配合物的抗肿瘤作用机制可能是多维非单一的情况,这也与肿瘤是一种分子网络病,其发病机制多维化相吻合。现在的肿瘤病因学研究已认为是通路而非单个致病基因诱导肿瘤发生。
4 Schiff 碱金属配合物的优势—对抗多药耐药且不良反应小
肿瘤细胞的多药耐药性(MDR)已成为肿瘤治疗及抗肿瘤药物运用的最大障碍,这主要与多药耐药相关蛋白如MRP1、P-糖蛋白(P-gp)的过度表达或谷胱甘肽(GSH)浓度的升高有关。近年的研究表明,活性氧ROS能够抑制肿瘤生长,基于ROS 累积选择性作用于肿瘤细胞的“氧化治疗”方法已有应用。
Basu 等人[7]合成并表征了一种能够分解耗竭GSH且具有氧化还原活性的Schiff 碱,钾-氮-(2-羟基-3-甲氧基-苯甲醛)-丙氨酸(PHMBA)。用多柔比星耐药T 淋巴细胞白血病细胞、多柔比星敏感T 淋巴细胞白血病细胞和艾氏腹水癌细胞对PHMBA 的细胞毒性进行了研究,发现对于耐药性细胞和敏感性细胞都能通过凋亡/坏死通路使其死亡,具有降低肿瘤细胞GSH 水平和促进ROS 累积的作用。同时也对PHMBA 是否对正常未增生细胞及正常分裂细胞有毒性进行了研究,对人外周血单个细胞(PBMC)、正常老鼠的纤维原细胞NIH3T3 和chang肝细胞进行了MTT 测试,发现并未对其有细胞毒性作用。另外,他们还发现PHMBA 诱导的细胞死亡与氧化应激介导线粒体通路相关。这项研究表明这种Schiff 碱有抗多药耐药肿瘤细胞的作用,且对正常细胞毒性较小。
近年来,许多Cu 的配合物被报道具有较强的抗肿瘤活性且较铂类抗肿瘤药的副作用小。
综上,Schiff 碱金属配合物具有潜在的抗多药耐药肿瘤细胞的作用,且对正常细胞毒性较小,选择合适的配体和金属可以合成新型抗耐药的抗肿瘤药物。
5 结语
该文综述了近年来国内、外关于Schiff 碱金属配合物抗肿瘤活性的研究进展,揭示了其相关作用机制,并阐述了其作为新型抗肿瘤药的优势。参考肿瘤病因学、分子药理学原理,将传统药物设计方法与计算机辅助药物设计(CADD)、3D 定量构效关系(3D-QSAR)等现代方法相结合,对Schiff 碱配体及金属进行合成、改造、组合和筛选,从而合成具有潜力的新型抗肿瘤药物,这对肿瘤化疗药的研发具有重要意义。
[1]Shakir M,Azam M,Ullah MF,et al.Synthesis,spectroscopic and electrochemical studies of N,N-bis [(E)-2-thienylmethylidene]-1,8-naphthalenediamine and its Cu (II) complex:DNA cleavage and generation of superoxide anion[J].Journal of Photochemistry and Photobiology B:Biology,2011,10(4):449-456.
[2]Hu GQ,Wang GQ,Duan NN,et al.Design,synthesis and antitumor activities of fluoroquinolone C-3 heterocycles(IV):striazole Schiff-Mannichbases derived fromofloxacin[J].Acta Pharmaceutica Sinica B,2012,2(3):312-317.
[3]Kamel MM,Ali HI,Anwar MM,et al.Synthesis,antitumor activity and molecular docking study of novel Sulfonamide-Schiff’s bases,thiazolidinones,benzothiazinones and their C-nucleoside derivatives[J].European Journal of Medicinal Chemistry,2010,4(5):572-580.
[4]Sathiyaraj S,Butcher RJ,Jayabalakrishnan C.Synthesis,characterization,DNA interaction and in vitro cytotoxicity activities of ruthenium(II) Schiff base complexes[J].Journal of Molecular Structure,2012,10(30):95-103.
[5]Tabassum S,Amir S,Arjmand F,et al.Mixed-ligand Cu(II)-Vanillin Schiff base complexes;effect of coligands on their DNA binding,DNA cleavage,SOD mimetic and anticancer activity[J].European Journal of Medicinal Chemistry advance online publication,23,August,2012(doi:10.1016/j.ejmech.2012.08.019).
[6]Ma ZY,Qiao X,Xie CZ,et al.Activities of a novel Schiff Base copper (II) complex on growth inhibition and apoptosis induction toward MCF-7 human breast cancer cells via mitochondrial pathway[J].Journal of Inorganic Biochemistry,2012,117(12):1-9.
[7]Basu S,Ganguly A,Chakraborty P,et al.Targeting the mitochondrial pathway to induce apoptosis/necrosis through ROS by a newly developed Schiff’s base to overcome MDR in cancer[J].Biochimie,2012(94):166-183.
