酶解-超声法对猪苓多糖正交优选提取及抗氧化活性的初步实验研究
2015-01-09杨晓方谷春秀刘红梅
张 元,冯 琼,杨晓方,谷春秀,刘红梅
北京联合大学生物化学工程学院,北京 100023
自由基是生物体中生化反应的普遍中间介质,它们是正常的细胞新陈代谢过程中氧化磷酸化作用产生的副产物[1]。大量研究表明,一方面自由基参与了许多重要的生命过程,诸如细胞增殖、分化、凋亡、肿瘤的诱发与抑制、肌肉收缩、神经传导、细胞信号转导和基因表达等调节;另一方面,自由基产生过多或清除过慢又会影响各种细胞或器官,使自然抗氧化和促氧化之间产生不平衡,诱导产生各种有害影响,使得细胞死亡和脂质过氧化反应的发生[2-4]。因此自由基在有机体中扮演着重要的角色,研究表明众多从天然产物中提取的多糖如:绿茶、海藻、香菇、云芝等多糖均被证明是有效地天然抗氧化剂和机体免疫剂[5],且多糖没有细胞毒性,作用于生物体副作用小,因此其在食品工业、制药工业等领域得到广泛应用。但多糖因其种类多样,结构复杂,分子量大,且多数含量低,极性大,加之其常与蛋白质、脂类等形成复杂的多糖复合物,这些给多糖的提取分离、构效关系、质量标准控制等的研究应用带来了诸多的困难。
猪苓为多孔菌科真菌猪苓Polyporus umbellatus(Pers.)Fries 的菌核,属药食两用真菌,在我国已有2 000 多年的食用和药用历史。猪苓性平味甘,归肾、膀胱经,具有利水渗湿、泄热止泻的功效;用于治小便不利,水肿、泄泻,淋浊,带下等[6]。猪苓多糖为猪苓的主要活性成分,其化学组成主要为主链由β-(1-3)葡萄糖苷键缩合而成的葡聚糖,在主链上每3~4 个残基间出现一个与β-D-吡喃葡糖糖基团作为侧链的结构[7],研究表明猪苓多糖具有抑制肿瘤生长、增强免疫力、抗诱变、抗炎、抗病毒、抗化疗毒性、抗放射、抗衰老等的活性作用,在临床上主要用于原发性肺癌、肝癌、食道癌、子宫颈癌、淋巴瘤、白血病等放化疗的辅助治疗,以提高了患者的抗病能力[8]。
近年来猪苓多糖的研究在结构鉴定和活性上取得了诸多进展,但还有许多问题尚待深入研究解决,如其在天然产物中的含量低,提取效率低,分离困难等问题制约了猪苓多糖的进一步开发和利用。因此综合考虑提取效率、成本等因素,选择一种合适的提取分离方法对猪苓多糖的研究开发具有重要的意义。当前,多糖的提取已逐渐由传统的溶剂提取法向运用酶法、超声波等辅助强化提取技术转变。酶法、微波提取法、半仿生法、动态逆流等技术已经逐渐由基础研究加速向应用生产环节转化和发展。因此本文酶法-超声优化提取猪苓多糖展开研究,并对提取的多糖进行体外抗氧化活性的初步评价。拟为应用酶解-微波法辅助技术生产提取猪苓多糖提供一定的实验依据和理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
猪苓,购于河北安国长安中药材公司;果胶酶,纤维素酶(活力单位10000 u/g),天津市利华酶制剂技术有限公司;D-无水葡萄糖,批号:110833-200503,中国药品生物制品检定所;维生素C 注射剂,山东新华制药股份有限公司。苯酚(分析纯),浓硫酸(分析纯)等,北京化工厂。
1.1.2 主要仪器设备
Mini 岛津紫外分光光度计。THZ-82 恒温水浴振荡器,常州国华电器有限公司。KQ-250 型超声波清洗器,昆山市超声仪器有限公司等。电子分析天平,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 提取方法与优选
将猪苓进行60 ℃恒温干燥,粉碎后过100 目筛,称取一定量的猪苓,进行提取工艺的研究。首先对酶法提取与传统水提醇沉法和单独超声提取实验做对比,根据实验结果比对,拟采用复合酶法进行提取,并对影响提取的单因素进行优选,影响条件主要有:酶用量、反应时间、pH 值、温度,并在此基础上进行酶法提取的正交试验,在最佳提取的工艺条件的基础上,再进行超声波的提取。
1.2.1.1 水提醇沉法:称取干燥过筛的猪苓5 g,向其中加入100 mL 水,在40 ℃水浴中浸提1 h,收集上清液,残渣再次用同种方法提取30 min,合并两次滤液,用95%的乙醇沉淀,静置24 h,抽滤,得到提取的多糖。提取的多糖采用无水乙醇、丙酮洗涤各2 次的方式进行除杂后,60 ℃低温干燥,备用。按1.2.5 所述检测多糖含量。
1.2.1.2 酶法提取:酶种类的筛选:猪苓粉碎后称取5 g 三份,加200 mL 蒸馏水;1%纤维素酶;1%果胶酶;1%纤维素酶:果胶酶(1∶1)(质量为猪苓粉末质量的1%,下同),于50 ℃,自然pH(6.36)条件下浸提1h 后减压抽滤,多糖处理方法同上。
1.2.1.3 猪苓超声提取试验:称取5 g 猪苓粉末,加入200 mL 水,在50 ℃下,超声提取20、40、60、80、100 min,抽滤,方法同上。
计算公式:猪苓多糖收率=猪苓多糖质量/猪苓质量×100%。
1.2.2 酶法提取猪苓多糖
1.2.2.1 加酶比例对猪苓多糖提取率的影响
称取5 份猪苓粉末各5 g,分别至于5 个锥形瓶中,标号,加入纤维素酶与果胶酶(1%)比例分别为1∶1、1∶2、1∶3、2∶1、3∶1,各加入200 mL 蒸馏水,于室温下搅拌浸泡30 min,使其充分接触溶解。
然后至于水温为50 ℃的恒温水浴振荡器中中速震荡1 h,再将其置于90 ℃的水浴锅中5 min 使酶失活,趁热过滤,提取得到的多糖采用无水乙醇、丙酮洗涤各2 次的方式进行除杂后,60 ℃低温干燥,称量,备用。按1.2.5 所述检测多糖含量。
1.2.2.2 反应温度的影响
同上,在5 个瓶中分别加入纤维素酶与果胶酶比例为1∶1(质量为1%)。各加入200 mL 蒸馏水,于室温下搅拌浸泡30 min,使其充分接触溶解。然后于水温分别为35、40、45、50、55 ℃的恒温水浴振荡器中中速震荡1 h。处理方法同1.2.2.1。
1.2.2.3 pH 的影响
同上,5 个瓶加酶加水后,于室温下搅拌浸泡30 min,使其充分接触溶解。并调节pH 值分别为5.5、6.0、6.5、7.0、7.5。方法同上。
1.2.2.4 反应时间的影响
同上,5 个瓶加酶加水后,于室温下搅拌浸泡30 min,使其充分接触溶解。然后至于水温为50 ℃的恒温水浴振荡器中分别中速震荡20、40、60、80、100 min。方法同上。
1.2.3 酶法提取的正交实验
由以上单因素试验的结果,确定以温度(A)、pH 值(B)、加酶比例(C)、反应时间(D)为考察因素,进行正交试验。
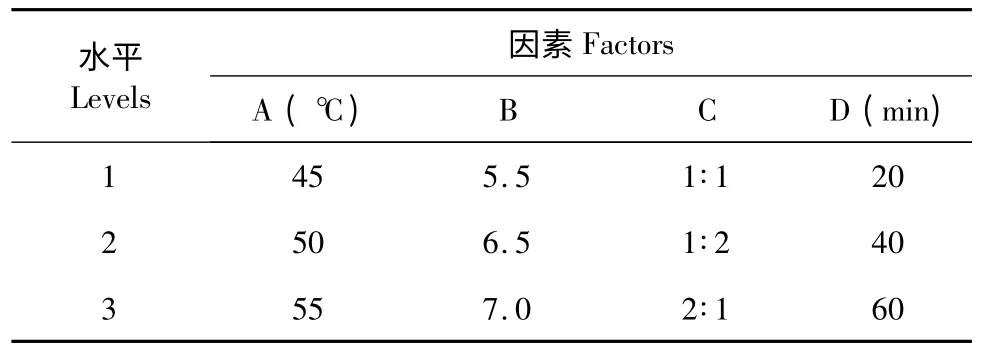
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiments
1.2.4 酶-超声提取
猪苓以最佳酶解条件反应结束后,再进行超声辅助浸提,然后绘制提取率与超声时间的变化曲线。多糖处理方法同1.2.2.1。
1.2.5 测定方法
1.2.5.1 标准曲线的制备
标准曲线的制备根据文献《酶法提取山药多糖的工艺研究》[9],即标准葡萄糖溶液于490 nm 处测定吸光度,以吸光度A 对质量浓度C(mg/mL)进行回归,得方程:

1.2.5.2 样品含量测定
精密吸取样品储备液1.0 mL 于10 mL 的容量瓶中,定容到刻度,摇匀,在490 nm 下测得吸光度值为0.64,代入回归方程。并计算猪苓多糖百分含量,计算公式如下:a%=10/1.0 × (A-0.1165)/1.2152 ×100%。
1.2.6 羟基自由基(·OH)清除能力的测定
釆用Fenton 法进行测定[10],以羟自由基清除率作指标。所用多糖为1.2.4 制备的多糖(下同)。具体方法为在比色管中依次加入7.5 mmol/L FeSO43 mL,然后再加入1% H2O23 mL,摇匀后加入6 mmol/L 水杨酸3 mL,摇匀后于37 ℃水浴加热15 min 后取出,在510 nm 测定其吸光度为A0;然后分别加入不同质量浓度的猪苓多糖溶液(1、2、3、4、5 mg/mL)3 mL,摇匀后继续水浴加热15 min,取出测其吸光度为AX。以相同质量浓度的VC溶液为阳性对照。则待测液对轻自由基(·OH)的清除率为:
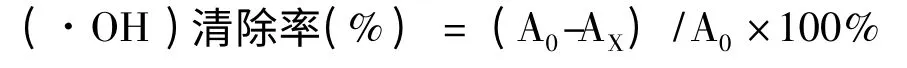
1.2.7 超氧阴离子自由基清除率测定
釆用邻苯三酚自氧化法[11],以超氧阴离子自由基清除率作指标。邻苯三酚在碱性条件下能迅速氧化,释放出O-·2,此自由基能促进邻苯三酚的自氧化,形成有色中间产物,这些中间产物在320 nm 处有最大吸收,当有抑制剂存在时,可以消除O-·2,从而降低中间产物的积累,使吸光度值降低,根据吸光度的变化评价抗氧化剂的清除能力[10]。以样品相同质量浓度的VC为阳性对照。具体方法为取不同质量浓度的猪苓多糖溶液(1、2、3、4、5 mg/mL)的水解样品溶液0.2 mL,加入Tris-HCl 缓冲液2.8 mL,蒸馏水0.4 mL,混匀,置于25 ℃保温20 min,作为试剂A;取0.2 mL 3 mmol/L 的邻苯三酚溶液,置于25 ℃下保温10 min,作为试剂B;以试剂A 与0.3 mL 10 mmol/L HCl 溶液的混合液作为空白调零后,将试剂A 与试剂B 迅速混合,在320 nm 处测定3 min 内吸光度的变化,回归求出吸光度变化斜率K1。
以蒸馏水代替水解样品溶液作为对照样品重复上述过程,得出吸光度变化的斜率为K0;
计算清除超氧阴离子的能力:

式中:K0为空白对照液的吸光度变化斜率;K1为加入水解液后的吸光度变化斜率。
2 结果与分析
2.1 猪苓多糖收率
从表5 的结果可以看出,单独的纤维素酶和果胶酶均较传统的水提溶剂法的收率有所提高,而复合酶法又较单独的酶法的提取收率为高,因此实验采用复合酶法提取作为酶法提取的工艺首选。
猪苓超声提取试验主要是想验证在单独超声条件下,不同提取时间对猪苓多糖提取的影响,结果表明,收率随提取随时间的增加而增加,但当时间大于60 min 后增幅不明显,当大于80 min 时反而出现下降,下降原因有待进一步分析。因此实验选择超声时间不超过60 min。
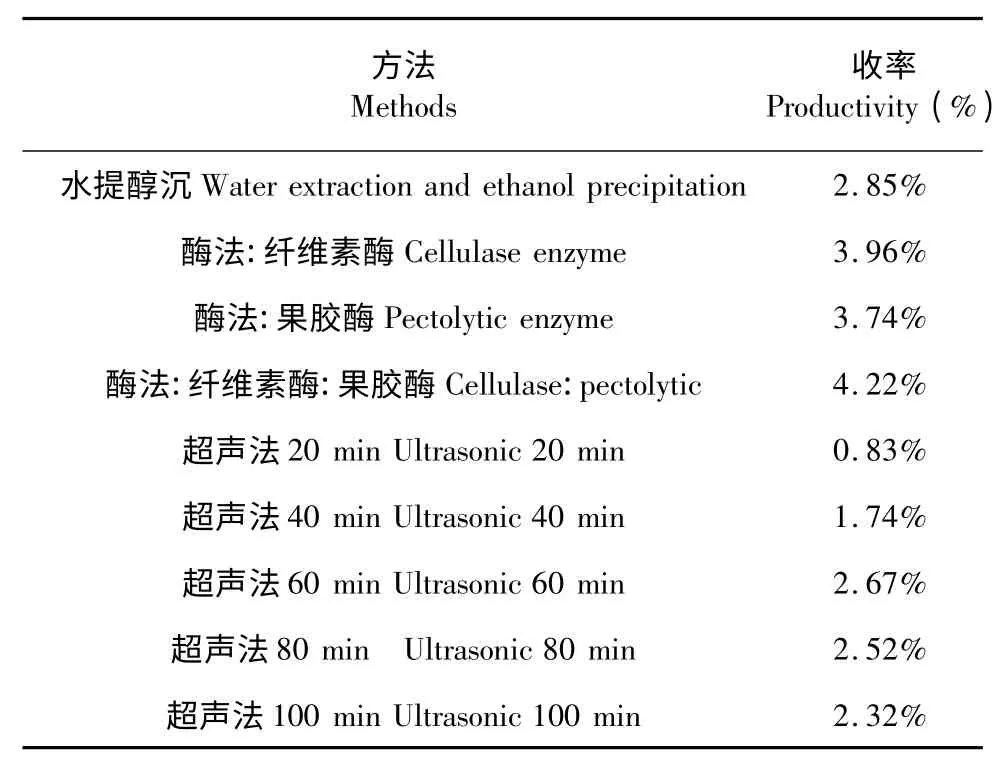
表2 猪苓多糖收率Table 2 Productivity of PUPS under different methods
2.2 纤维素酶果胶酶酶解条件的优化
2.2.1 酶用量比的选择
实验对复合酶的配比用量进行优选,拟选出最佳加酶用量比。从图1 可以看出,不同酶的配比对结果的影响,当纤维素酶不变,单独增加果胶酶的用量,收率并没有明显提高。相反,保持果胶酶用量不变,增加纤维素酶的用量反而使多糖的收率下降,因此选择复合酶最佳酶用量比为1∶1,添加量为1%。
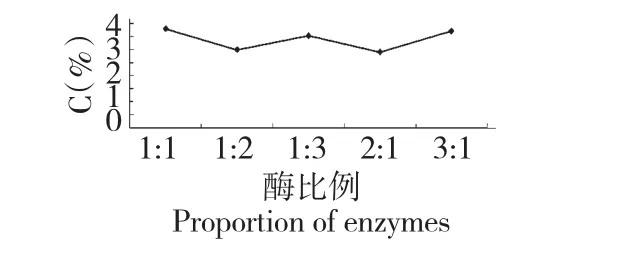
图1 酶配比用量对猪苓多糖收率的影响Fig.1 Effects of ratio of enzyme on the yield of PUPS
2.2.2 反应温度的选择
反应温度对多糖的收率是一个重要的因素,多糖的收率随温度升高,也呈现出升高的趋势,一方面是因为温度升高,反应速度加快会促进细胞内部的多糖物质向外扩散。另一方面随温度的升高酶的活力不断增强,在接近其最佳酶活力温度50 ℃时,反应效率最高。温度对酶的影响是双向的,在45~50℃区间酶活力最好,偏离越远酶活力则越小,因此当温度上升到55 ℃时,收率反而出现了下降。图2 实验的实验结果最佳的酶解温度为50 ℃。结果见图2。
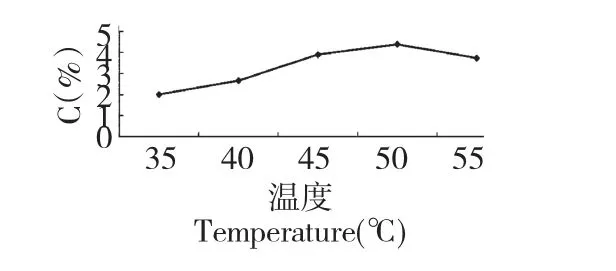
图2 反应温度对猪苓多糖收率的影响Fig.2 Effects of reaction temperature on the yield of PUPS
2.2.3 pH 的选择
实验结果表明,随酶解pH 值的升高,猪苓多糖的收率呈现先升高而后下降的趋势,最佳的pH 6.0~6.5 区间多糖收率最好,以pH 6.5 最佳。因此pH 对酶解效率有一定的影响,可能与酶在酸性环境中活性基团解离使基团的活性得到加强有关。结果见图3。
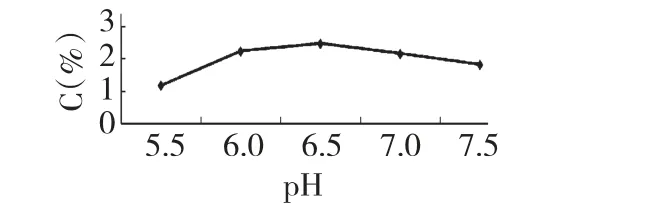
图3 酶解pH 值对猪苓多糖收率的影响ig.3 Effects of enzyme solution pH value on the yield of PUPS
2.2.4 反应时间的选择
在60 min 内,酶解时间与多糖提取率的关系随时间的延长而增加,最佳提取时间为60 min。随后随反应时间的延长,多糖已基本溶出,呈现平衡态,因此提取效率呈现平稳和缓慢下降的趋势。结果见图4。
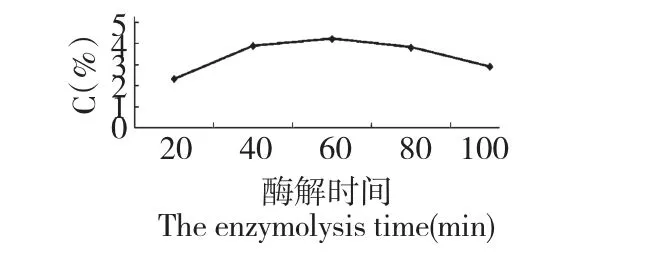
图4 酶解时间对猪苓多糖收率的影响Fig.4 Effects of enzymolysis time on the yield of PUPS
2.3 酶法提取正交实验结果
根据对正交试验结果的分析,各单因素对于提取结果影响的顺序大小为:温度>pH 值>酶用量>提取时间。即加酶比例的影响最小,温度的影响最大,最佳提取工艺为:A2B2C1D3,反应温度50 ℃,pH=6.5,纤维素酶与果胶酶加酶比例1∶1(1%),酶解时间60 min。
2.4 酶解-超声联合提取
猪苓酶解后,进行超声提取,在10、20、30、40、50 min 时取样,测定多糖含量。
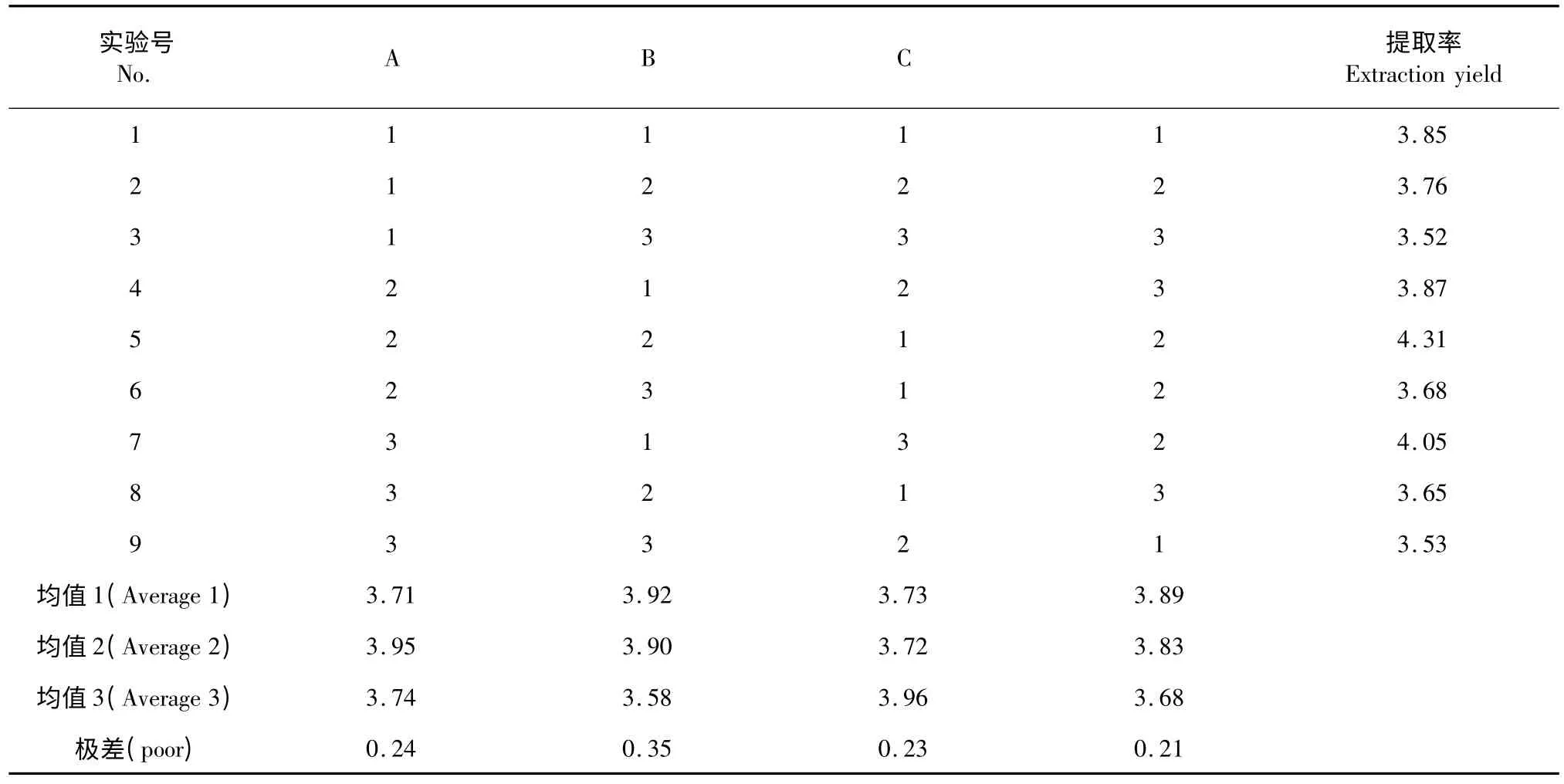
表3 酶解正交直观分析表Table 3 Results of orthogonal test
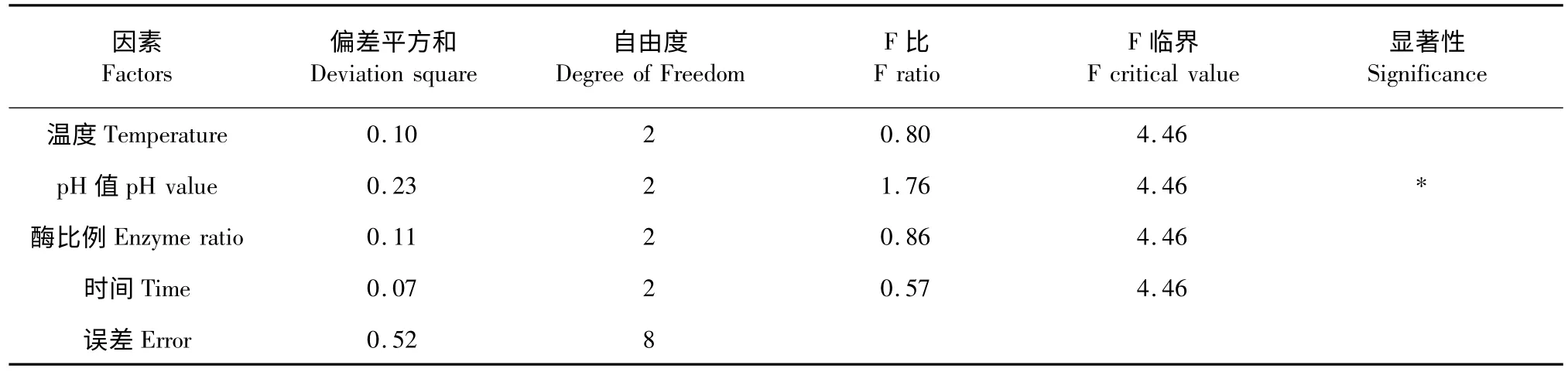
表4 酶解正交方差分析表(α=0.05)Table 4 Variance analysis table for enzymatic hydrolysis extraction
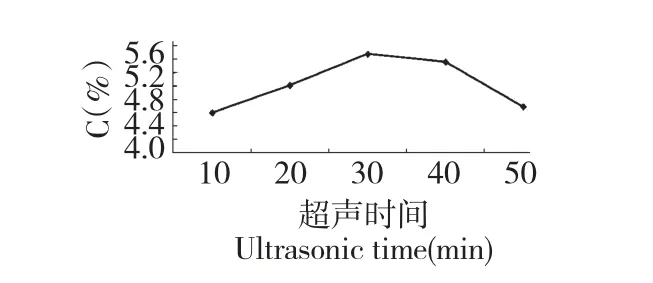
图5 酶解-超声联合提取条件与猪苓多糖提取率关系Fig.5 Effects of enzymolysis and ultrasonic time on the yield of PUPS
由图5 可得超声处理30 min,多糖得率最高6.48%,较处理前4.31%提高了27.12%。联合提取最佳方案:猪苓5 g,纤维素酶与果胶酶用量比例为1∶1(1%),蒸馏水200 mL,50 ℃水浴振荡60 min,超声提取30 min。
2.5 羟基自由基(·OH)清除能力
猪苓多糖对羟基自由基(·OH)清除作用,并以相同浓度的VC进行对比,结果见图6 所示,猪苓多糖样品液对羟基自由基(·OH)有一定的清除作用,且清除率与猪苓多糖的浓度成正比,当多糖液加人量小于3 mg/mL 时,其清除率与VC大致相同相同,当大于4 mg/mL 时,其清除率略高于VC,说明酶法超声提取的猪苓多糖的抗氧化能力与VC大致相当。
2.6 超氧阴离子自由基清除率
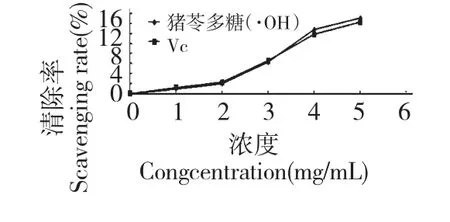
图6 样品对羟基自由基的清除作用Fig.6 ·OH scavenging effects of PUPS

图7 样品对氧自由基清除作用Fig.7 scavenging effects of PUPS
3 讨论
我国野生猪苓分布广泛、资源丰富,具有巨大的开发潜力。中药提取技术不仅是中药制药过程的重要环节,也是中药制药工业技术转型升级的关键。酶法水解提取多糖具有条件温和、杂质易除和效率高等优点。本实验采用复合酶水解猪苓提取猪苓多糖,提取效率较传统的溶剂提取法大幅提高了49.65%。酶法提取多糖的过程中溶剂的用量是影响多糖提取效率的首要因素,这也是生产过程中不可低估的重要经济指标之一,一般以能浸没原料的最低的水用量为基础。实验前期预实验结果表明,多糖的浸出率随溶剂量增加而增加,传统提取当料液比超过1∶20,并两次提取后,多糖增加的幅度不大。通过实验酶法提取的料液比定为1∶40,料液比固定后,就不再将其作为主要的影响因子。复合酶法对中药的提取效率的提高,原因主要是通过分解破坏中药材细胞壁的纤维素、半纤维素,以及果胶,从而产生局部的坍塌、溶解,造成组织疏松,这样就减少了溶剂提取过程中来自于细胞壁和细胞间质的阻力,加快有效组分的溶出速率[12]。实验表明,复合酶的联合作用较单一酶的单独作用的效率要高,原因与复合酶解共同水解破壁效率较单酶效率高,另一方面还与纤维素、半纤维素、果胶酶的水解也会部分增加糖的含量有关。在考察超声对多糖提取的影响时,超声对多糖的收率的贡献进一步从4.31%提高到5.46%。原因与超声波促进了猪苓组织结构的疏松程度,增大了溶剂提取的渗透性,超声振动强化了介质的扩散与传质,避免长时间和高温对提取物质的降解,同时通过机械作用、热效应等加速促进猪苓多糖的溶出有关[13]。因此利用酶法-超声优化提取猪苓多糖,较传统的溶剂提取猪苓多糖具有反应条件温和、高效节能、成本低廉、设备简单、操作方便等优势,在生产上有很大的发展空间。
对超声酶法提取的猪苓多糖进行了体外抗氧化活性的验证实验,表明它对羟基自由基和超氧阴离子自由基具有较好的清除作用,其清除能力与多糖的浓度成正比。猪苓多糖对Fenton 法羟自由基清除率在5 mg/mL 浓度条件下达到25.1%,对·OH的清除率达到15.2%,与Vc 的体外抗氧化能力相当,甚至优于Vc。其抗氧化的机理可能与多糖的羟基、羧基、氨基以及硫酸基等复杂的基团结构直接作用于多种活性氧有关,多糖直接参与减少脂质过氧化反应链的长度,捕捉脂质过氧化链式反应产生的活性氧,从而阻断或减缓脂质过氧化的进行[14];其次对于生物体内羟基自由基可快速摄取利用多糖碳链上的氢原子生成水;对于氧自由基,多糖的活性基团可与之直接发生氧化反应而清除;对于单线态氧可将激发能量传递给多糖使其处于激发态而本身回归到基态(猝灭)[15]。再次多糖可通过激活体内原有的抗氧化酶的活力如SODGSH-Px 等来清除机体内的脂质过氧化产物,间接发挥抗氧化的作用[16]。
通过酶法-超声提取猪苓多糖的实验,不仅提取收率大幅增加,而且提取物体外抗氧化活性的能力与Vc 相当。实验证实通过该方法能有效的提高猪苓多糖的提取效率,并保持了多糖的活性。这为猪苓多糖的中药提取制造技术转型升级和工业化提取应用探索了一条新的路径。
1 Wang FH(王福海),Huang CH(黄成华).Research progress of reactive oxygen species.Guangzhou Chem Ind (广州化工),2013,16(41):10-12.
2 Kozarski M,Klaus A,Niksic M,et al.Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agarivus bisporus,Agaricus brasiliensis,Ganoderma lucidum and Phellinus linteus.Food Chem,2011,129:1667-1675.
3 Kankaanranta H,Giembycz MA,Barnes PJ,et al.Hydrogen peroxide reverses IL-5 afforded eosinophil survival and promotes consltutive human eosinophil apoptosis.Int Arch Allergy Immunol,2002,127:73-78.
4 Zhang DL(张德莉),Zhu SJ(朱圣姬),Luo GF (罗光富),et al.Development of free radical-induced oxidative damage to DNA.J China Three Gorges Univ,Nat Sci(三峡大学学报,自科版),2004,26:563-567.
5 Piao XL(朴香兰).Natural Antioxidant Research.Beijing:Central University for Nationalities Publishing House,2008.2.
6 Lin Q(林强),Ge XZ(葛喜珍).Introduction to Traditional Chinese Medicine.Beijing:Chemical Industry Press,2008.211.
7 Qi SW(戚淑威),Zhao Q(赵琪),Cheng YH(程远辉).Research progress of Polyporus umbellatus.Yunnan Agric Sci Technol (云南农业科技),2011,257(5):9-11.
8 Liu HC(刘洪超),Yang XL(杨小龙),Wang SY(王淑英).Advances in pharmacological effects polyporus.Henan Univ Sci Technol,Med Sci(河南科技大学学报,医学版),2011,3(2):84-85.
9 Zhang Y(张元),Lin Q(林强),Wei JN (魏静娜),et al.Study on extraction process of polysaccharide from Chinese yamby enzymatic method.Chin J Tradit Chin Med (中国中药杂志),2008,33:374-376.
10 Zhang ZL (张志良),Qu WJ(翟伟菁).Plant PhysiologyExperimental Guidance.Beijing:Higher Education Press,2004.
11 Li HS(李合生).The Principle and Technology of Plant Physiology and Biochemistry Experiment.Beijing:Higher Education Press,2000.
12 Chen D(陈栋),Zhou YC(周永传).The enzymatic extraction of the application and progress in Chinese medicine.Chin J Tradit Chin Med(中国中药杂志),2007,32:99-101.
13 Wang SJ(王赛君),Wu ZF(伍振峰),Yang M (杨明),et al.Traditional Chinese medicine extraction transformation and application of new technology and its application in domestic research.Chin J Tradit Chin Med (中国中药杂志),2014,39:1360-1361.
14 Ak T,Gulcn I.Antioxidant and radical scavenging properties of cureumin.Chem Biol Inter,2008,174:27-37.
15 Tong LL(佟丽丽),Li BX(李滨辛).Research progress of polysaccharide.J Anhui Agric Sci(安徽农业科学),2014,42:10973-10975.
16 Liu J(刘洁),Li WX(李文香),Wang WL (王文亮),et al.Research progress of biological polysaccharide.Shandong Agric Sci (山东农业科学),2011,5:98-101.
