曼氏无针乌贼墨汁黑色素对亚急性衰老模型小鼠抗氧化功能的影响
2015-01-09周月越王力东杜美凤王春琳母昌考李荣华宋微微
周月越,王力东,杜美凤,王春琳,母昌考,李荣华,宋微微
宁波大学海洋学院 应用海洋生物技术教育部重点实验室,宁波 315211
衰老是一种极其复杂的多因子过程,它具有普遍性、内生性、渐进性和危害性的特点。关于衰老的理论也是多种多样,总体可以分为两大类即“程序性”衰老理论和“错误性”衰老理论[1]。随着世界人口加速老龄化,针对不同的衰老理论,各种抗衰老药物的研究已经成为研究的热点。由于D-半乳糖小鼠能引起许多类似衰老的改变如抗氧化酶活力及免疫能力的下降,1991年龚国清等首次用D-半乳糖构建了小鼠衰老模型,该模型现已经广泛应用于各种抗衰老药物的研究中[2]。
曼氏无针乌贼(Sepiella maindroni,Rochebrune)俗称墨斗鱼、海猫等,隶属于软体动物门、头足纲、十腕目、乌贼科,是我国近海广布性种,其墨汁是由直径120~180 nm 的颗粒形成的黑色悬浊液,摄食或遇敌时喷出以麻醉捕食者及保护自身安全。曼氏无针乌贼墨汁中主要成分为黑色素,它是由两种基本结构单元(5,6-二羟基吲哚和5,6-二羟基-2-吲哚羧酸)形成的多聚物。黑色素参加许多生理、病理活动,黑色素具有抗紫外辐射作用[3,4],DNA 光保护作用,黑色素还具有抗脂质过氧化、清除超氧化物自由基、螯合金属离子的能力[5]。最近的研究表明,泰和乌骨鸡[6]、工程菌[5]、人体毛发[7]、茶叶[8]中的黑色素都具有抗氧化抗衰老的功能。曼氏无针乌贼墨汁为海产品加工过程中的废弃物,它的墨汁约为总体重的1.28%,比例较大,且墨汁中黑色素纯度很高,是开发保健黑色素产品的价廉质高的原料。而迄今为止关于曼氏无针乌贼墨汁黑色素(MSMI)在体内的抗氧化研究还未见报道。
本研究通过测定不同MSMI 处理组小鼠血清、肝脏、脑、心脏中的丙二醛(MDA)含量、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性,对MSMI 小鼠体内的抗氧化作用进行评价,为进一步开发墨汁黑色素提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物ICR 小鼠54 只,雌雄各半,体重(20±2)g,由宁波大学实验动物中心提供(合格证:0023472)。
1.1.2 试剂与仪器
碱性蛋白酶(solarbio 公司);冰醋酸、D-半乳糖、无水乙醇(国药集团化学试剂有限公司);抗坏血酸(Sigma 公司);丙二醛MDA 测定试剂盒,过氧化氢CAT 试剂盒,总超氧化物歧化酶T-SOD 测试盒,谷胱甘肽过氧化物酶GSH-Px 测试盒(南京建成生物工程研究所);FreeZone4.5 台式冷冻干燥机(Labconco 公司);SPECTRA max190 酶标仪(Molecular Devices 公司);T-18Basic 内切式匀浆机购(IKA公司)。
1.1.3 MSMI 的制备
取曼氏无针乌贼墨囊300 只,挤压冲洗墨囊获得墨汁,三层纱布过滤防止破碎组织混入,8000 rpm离心10 min,去上清液,冷冻干燥,获得黑色素粗品。用酶解法精制黑色素,用1.5%碱性蛋白酶在温度为50 ℃,pH 为10.5 和底物浓度为2%的条件下酶解4 h 获得高纯度MSMI。
1.2 试验方法
1.2.1 小鼠亚急性氧化衰老模型的建立和MSMI的灌胃
将54 只ICR 小鼠分成6 组,分别为空白对照组、衰老模型组、阳性对照组、MSMI 低剂量组、MSMI中剂组和MSMI 高剂量组。除空白对照组皮下注射生理盐水外,其他5 组小鼠皮下注射120 mg/(kg·d)的D-半乳糖,建立小鼠亚急性氧化衰老模型。对低中高三组分别灌胃25 mg/(kg·d)、120 mg/(kg·d)、200 mg/(kg·d)的MSMI。阳性对照组灌胃120 mg/(kg·d)的维生素C,空白对照组灌胃等量生理盐水。45 d 后颈椎脱臼处死,最后一次给药后禁食不禁水12 h,称完体重后,进行小鼠眼球取血,剥离脾脏、肝脏、心脏、脑,其中脾脏和肝脏称湿重,血清4 ℃保存,其他所有样品-80 ℃保存。
1.2.2 肝脏指数和脾脏指数的计算
1.2.3 生化指标的测定
将6 组小鼠的肝脏、脑、心脏取出,精确称取其重量,按重量(g):体积(mL)为1∶9 的比例加入9 倍体积的生理盐水,用内切式组织匀浆机坐冰匀浆后2500 rpm 离心10 min,取上清液即10%的组织匀浆备用。测定小鼠血清、肝脏、脑、心脏中丙二醛(MDA)含量,以及过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,测定过程均按照试剂盒中的说明书进行操作。
1.3 统计学分析
所测得结果用平均值±标准差表示,采用SPSSV19.0 完成统计处理,组间差异性采用t 检验,以P<0.05 为统计学显著意义。
2 结果与分析
2.1 MSMI 对小鼠脏器指数的影响
45 d 处理后,6 组小鼠的脏器指数如表1 所示。与空白对照组相比,衰老模型组体重有显著下降(P<0.05),肝脏指数,脾脏指数无明显改变。与衰老模型组相比,Vc 组(P<0.05)、MSMI 低剂量组(P<0.01)、MSMI 中剂量组(P<0.01)的体重都明显上升,肝脏指数,脾脏指数无明显改变。MSMI 高剂量组与衰老模型组相比体重明显改变,肝脏指数明显上升(P<0.05),脾脏指数无明显改变。
2.2 MSMI 对小鼠血清中MDA 含量及CAT、SOD、GSH-Px 活性的影响
6 组小鼠血清中MDA 含量及CAT、SOD、GSH-Px 活性如表2 所示。与空白对照组相比,衰老模型组MDA 含量有显著上升(P<0.01),CAT(P<0.01)、SOD(P<0.05)活力都明显下降,GSH-Px 活力也有所下降,但并不显著。阳性对照组即Vc 组与衰老模型组相比MDA 含量有显著下降(P<0.05),CAT(P<0.01)、GSH-Px(P<0.05)活力都明显提高,SOD 活力无显著差异。MSMI 低剂量组与衰老模型组相比,MDA 含量有显著下降(P<0.01),CAT(P<0.01)、SOD(P<0.01)活力显著提高,GSH-Px 活力无显著差异。与衰老模型组相比,MSMI 中剂量组(P<0.01)、MSMI 高剂量组(P<0.05)的MDA 的含量都显著下降,CAT(P<0.01)、SOD(P<0.05)、GSH-Px(P<0.01)的活力都明显上升。
表1 MSMI 对小鼠脏器指数的影响(n=9,)Table 1 The effect of MSMI on organ indexes in mice (n=9,)
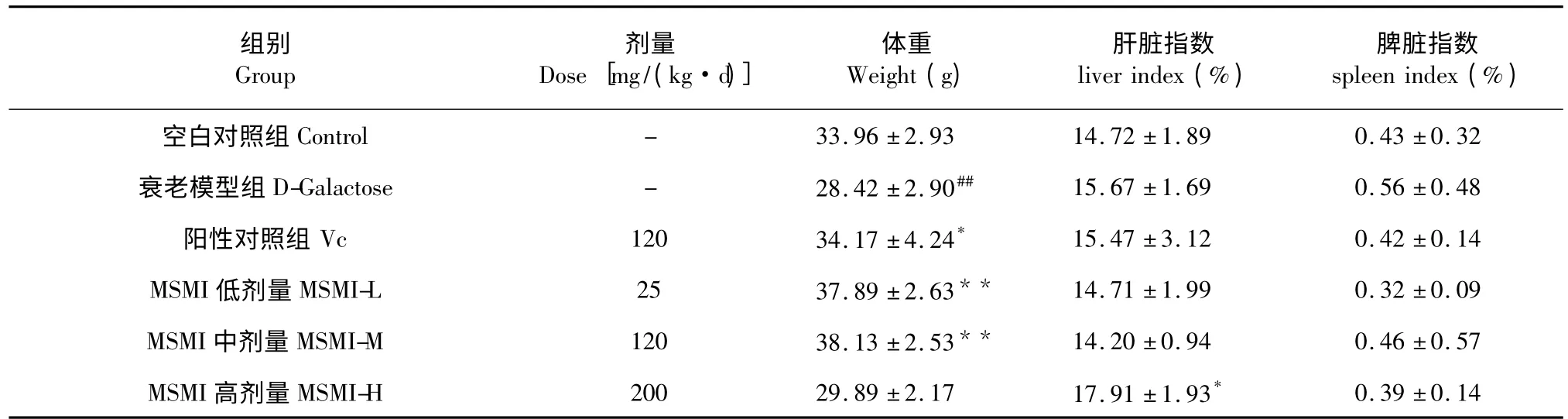
表1 MSMI 对小鼠脏器指数的影响(n=9,)Table 1 The effect of MSMI on organ indexes in mice (n=9,)
注:与正常对照组相比,# P<0.05,##P<0.01;与模型对照组相比,* P<0.05,**P<0.01。Note:# P<0.05,##P<0.01 versus normal group;* P<0.05,**P<0.01 versus the model group.
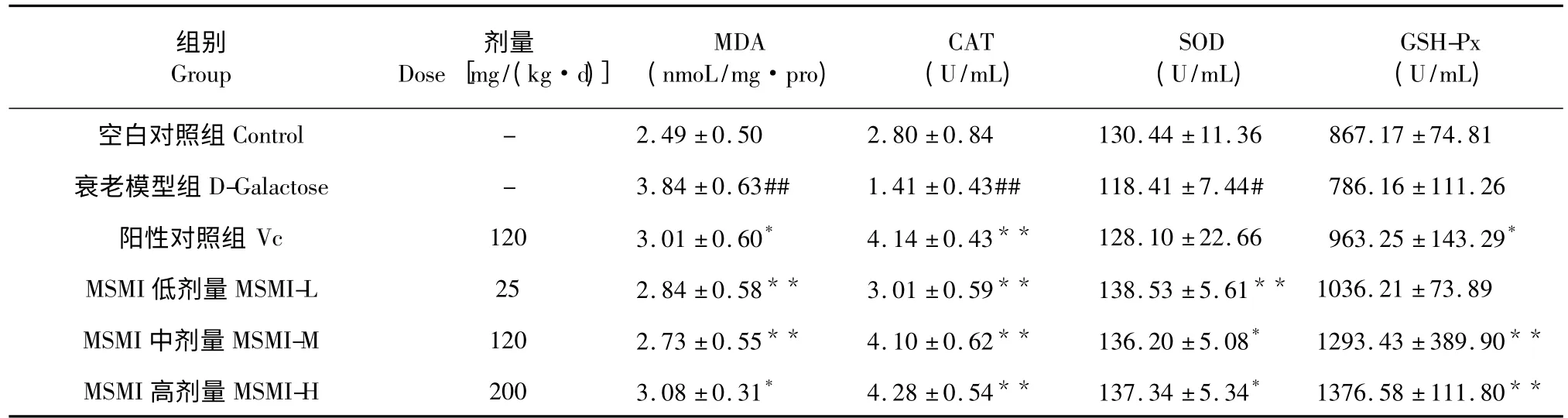
表2 MSMI 对小鼠血清中MDA 含量及CAT、SOD、GSH-Px 活性的影响Table 2 The effect of MSMI on MDA content and the activities of CAT,SOD,GSH-Px in mice serum
2.3 MSMI 对小鼠肝脏中MDA 含量及CAT、SOD、GSH-Px 活性的影响
6 组小鼠肝脏中MDA 含量及CAT、SOD、GSHPx 活性如表3 所示。衰老模型组与空白对照相比MDA 含量有显著上升(P<0.01),Vc 组、低中高剂量MSMI 组与衰老模型组相比MDA 含量有显著下降(P<0.01)。衰老模型组与空白对照相比CAT活力有显著下降(P<0.01),Vc 组、低中高剂量MSMI 组与衰老模型组相比CAT 活力有显著上升(P<0.05)。衰老模型组与正常组相比SOD 活力有显著下降(P<0.01),Vc 组、低中高剂量黑色素组与MSMI 组相比SOD 活力有显著上升(P<0.01)。衰老模型组与正常组相比GSH-Px 活力显著下降(P<0.01),Vc 组、低中高剂量MSMI 组与衰老模型组相比GSH-Px 活力有显著上升(P<0.01)。
2.4 MSMI 对小鼠脑中MDA 含量及CAT、SOD、GSH-Px 活性的影响
6 组小鼠脑中MDA 含量及CAT、SOD、GSH-Px活性如表4 所示。与空白对照组相比,衰老模型组MDA 含量有显著上升(P<0.01),CAT、SOD、GSHPx 活力有显著下降(P<0.05)。Vc 组与衰老模型组相比MDA 含量有显著下降(P<0.05),CAT(P<0.01)、SOD(P<0.05)活力明显提高,GSH-Px 活力无显著变化。与衰老模型组相比,MSMI 低剂量组MDA 含量无明显改变,CAT(P<0.01)、SOD(P<0.05)、GSH-Px(P<0.01)活力明显提高。与衰老模型组相比,MSMI 中剂量组MDA 含量明显下降(P<0.05),CAT、SOD、GSH-Px 活力明显提高(P<0.01)。与衰老模型组相比,MSMI 高剂量组MDA含量明显下降(P<0.05),CAT(P<0.05)、SOD(P<0.01)、GSH-Px(P<0.01)活力明显提高。
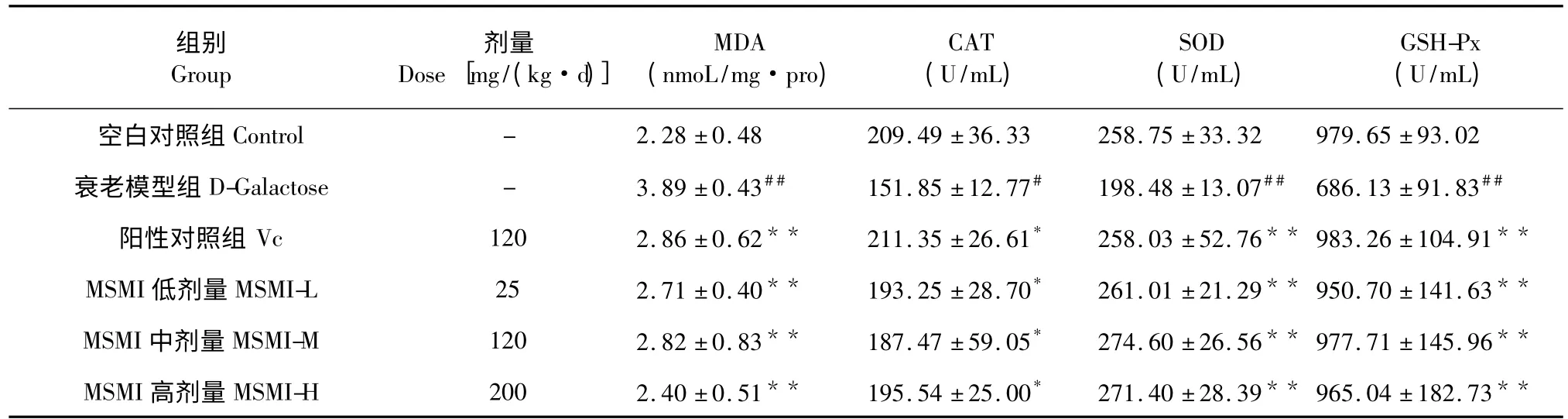
表3 MSMI 对小鼠肝脏中MDA 含量及CAT、SOD、GSH-Px 活性的影响Table 3 The effect of MSMI on MDA content and the activities of CAT,SOD,GSH-Px in mice liver
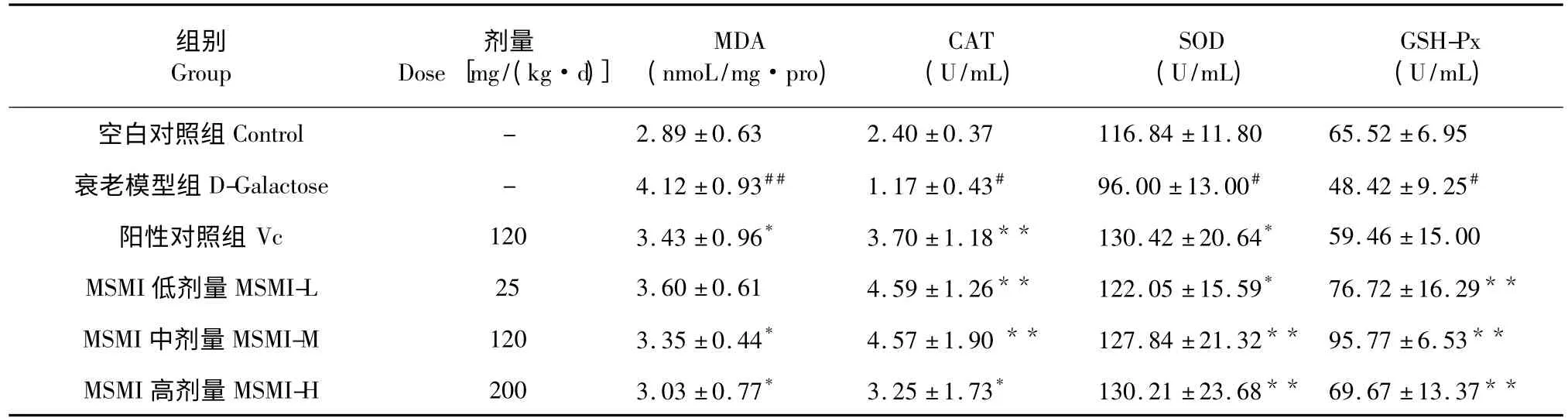
表4 MSMI 对小鼠脑中MDA 含量 及CAT、SOD、GSH-Px 活性的影响Table 4 The effect of MSMI on MDA content and the activities of CAT,SOD,GSH-Px in mice brain
2.5 MSMI 对小鼠心脏中MDA 含量及CAT、SOD、GSH-Px 活性的影响
6 组小鼠心脏中MDA 含量及CAT、SOD、GSHPx 活性测定结果如表5 所示。与空白对照组相比,衰老模型组的MDA 含量有显著上升(P<0.05),CAT(P<0.01)、SOD(P<0.01)、GSH-Px(P<0.05)的活力明显提高。Vc 组与衰老模型组相比MDA 含量有显著下降(P<0.05),CAT(P<0.05)、GSH-Px(P<0.05)活力明显上升,SOD 活力无明显改变。与衰老模型组相比,MSMI 低剂量组的MDA含量显著降低(P<0.05),GSH-Px 活力显著提高(P<0.05),CAT、SOD 活力无显著差异。MSMI 中剂量组与衰老模型组相比,MDA 含量显著提高(P<0.01),CAT、GSH-Px 活力显著提高(P<0.05),SOD 活力无显著差异。与衰老模型组相比,MSMI高剂量组的MDA 含量显著降低(P<0.05),CAT、SOD、GSH-Px 的活力无显著改变。
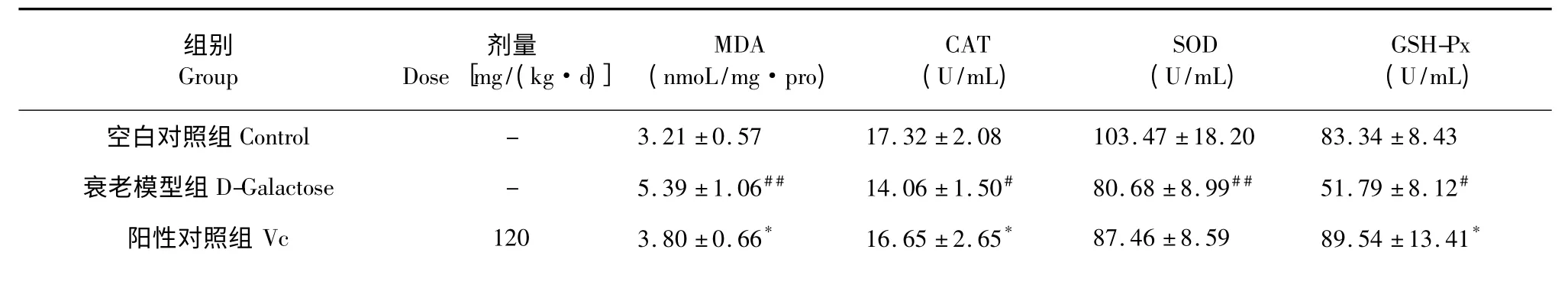
表5 MSMI 对小鼠心脏中MDA 含量 及CAT、SOD、GSH-Px 活性的影响Table 5 The effect of MSMI on MDA content and the activities of CAT,SOD,GSH-Px in mice heart

注:与正常对照组相比,# P<0.05,##P<0.01;与模型对照组相比,* P<0.05,**P<0.01Note:# P<0.05,##P<0.01 versus normal group;* P<0.05,**P<0.01 versus the model group
3 讨论
衰老是生命体随着年龄增长而发生的组织、器官衰退的复杂多因子过程,它具有有、普遍性、内生性、渐进性、危害性的特点。衰老的机制很复杂,有关衰老的理论、学说或假设已不下200 种,如线粒体学说、自由基学说、糖基化衰老学说、端粒学说、中医脾肾学说等[9]。1956年Harman 首次提出自由基衰老学说,该学说认为:机体正常代谢过程中会产生自由基和过氧化物会,它们攻击正常的细胞、组织,从而导致机体衰老[10],正常情况下机体可以通过各种抗氧化酶和各种抗氧化剂对这些损害进行防御:(1)各种抗氧化酶:过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等;(2)抗氧化剂:维生素C、维生素E、β-胡萝卜素等[11]。机体衰老时,自由基的产生会增多,机体和组织的抗氧化酶活力下降,导致过多的自自由基堆积。这些多余的自由基会引发含醛基的脂质过氧化,该反应会产生代谢产物丙二醛MDA,丙二醛还可与氨基酸蛋白质等大分子发生交联作用产生脂褐素,在脑、肝脏、皮肤等部位的细胞内大量堆积,通过测量MDA 含量可反应出组织的过氧化损伤程度。
在进行衰老研究时,通常需要造成接近临床衰老症状的动物模型,由于D-半乳糖小鼠能引起许多类似衰老的改变如抗氧化酶活力及免疫能力的下降,1991年龚国清等首次用D-半乳糖构建了小鼠衰老模型,该模型现已经广泛应用于各种抗衰老药物的药理学研究中[12,13]。D-半乳糖主要有3 种代谢途径,D-半乳糖可经半乳糖激酶、1-磷酸-半乳糖转尿苷酰酶、半乳糖尿苷-2-磷酸-4-异构酶的作用下形成1-磷酸葡萄糖,从而进入糖酵解途径,此途径为半乳糖体内代谢的主要途径。另外,D-半乳糖在醛糖还原酶的作用下可以形成有细胞毒性的半乳糖醇。前两条途径都没有产生自由基或过氧化物,半乳糖的第三条代谢途径涉及一种重要的酶即半乳糖氧化酶,它能够催化伯醇和O2反应产生醛类和H2O[14]2。Salganik 等通过电子顺磁共振(EPR)波谱技术检测到D-半乳糖衰老大鼠的肝脏中羟基自由基的水平显著上升[15],同样张熙等发现在大鼠脑中自由基显著增加[16]。这些都说明D-半乳糖致衰模型的原理可能是通过,至少部分通过自由基的增加从而加速衰老过程。
在本实验中,D-半乳糖衰老模型组与正常组相比,小鼠血清、肝脏、脑、心脏中丙二醛(MDA)含量都显著上升,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性明显下降,这些结果与以前研究所报道的一致[2,15],说明小鼠D-半乳糖亚急性衰老模型建模成功。阳性对照组(即维生素C 组)与衰老模型组相比,小鼠血清、肝脏、脑、心脏中丙二醛(MDA)含量都显著下降,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性都有所上升,说明维生素C 具有明显的抗氧化抗衰老功能,适合作为阳性对照。3 种不同剂量黑色素组与衰老模型组相比,小鼠血清、肝脏、脑、心脏中丙二醛(MDA)含量都显著下降且和黑色素剂量成正比例,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性都有所上升且和黑色素剂量成正比例,说明曼氏无针乌贼墨汁黑色素具有明显的抗氧化抗衰老功能且黑色素剂量越大抗氧化效果越好,该研究为黑色素抗氧化作用的机制及保健食品、化妆品的开发提供理论依据。
1 Vina J,Borras C,Abdelaziz KM,et al.The free radical theory of aging revisited:the cell signaling disruption theory of aging.Antioxid Redox Signal,2013,19:779-787.
2 Ho SC,Liu JH,Wu RY.Establishment of the mimetic aging effect in mice caused by D-galactose.Biogerontology,2003,4:15-18.
3 Huang S,Pan Y,Gan D,et al.Antioxidant activities and UVprotective properties of melanin from the berry of Cinnamomum burmannii and Osmanthus fragrans.Med Chem Res,2011,20:475-481.
4 Brenner M,Hearing VJ.The protective role of melanin against UV damage in human skin.Photochem Photobiol,2008,84:539-549.
5 Ye M,Wang Y,Guo GY,et al.Physicochemical characteristics and antioxidant activity of arginine-modified melanin from Lachnum YM-346.Food Chem,2012,135:2490-2497.
6 Tu YG,Sun YZ,Tian YG,et al.Physicochemical characterisation and antioxidant activity of melanin from the muscles of Taihe Black-bone silky fowl (Gallus gallus domesticus Brisson).Food Chem,2009,114:1345-1350.
7 Herrling T,Jung K,Fuchs J.The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair.Spectrochim Act A,2008,69:1429-1435.
8 Hung YC,Sava VM,Makan SY,et al.Antioxidant activity of melanins derived from tea:comparison between different oxidative states.Food Chem,2002,78:233-240.
9 Jang YC,Remmen HV.The mitochondrial theory of aging:Insight from transgenic and knockout mouse models.Exp Gerontol,2009,44:256-260.
10 Harman D.Aging:a theory based on free radical and radiation chemistry.J Gerontol,1956,11:298-300.
11 Beckman KB.The free radical theory of aging matures.Phys-iol Rev,1998,78:547-581.
12 Zhang XL,Jiang B,Li ZB,et al.Catalpol ameliorates cognition deficits and attenuates oxidative damage in the brain of senescent mice induced by d-galactose.Pharmacol Biochem Be,2007,88:64-72.
13 Zhang ZF,Fan SH,Zheng YL,et al.Purple sweet potato color attenuates oxidative stress and inflammatory response induced by d-galactose in mouse liver.Food Chem Toxicol,2009,47:496-501.
14 Bosch A.Classical galactosaemia revisited.J Inherit Metab Dis,2006,29:516-525.
15 Salganik RI,Solovyova NA,Dikalov SI,et al.Inherited enhancement of hydroxyl radical generation and lipid peroxidation in the S strain rats results in DNA rearrangements,degenerative diseases,and premature aging.Biochem Biophys Res Commun,1994,199:726-733.
16 Zhang X(张熙),Li WB(李文彬),Zhang BL(张炳烈).Biochemical changes of therat model of aging by inject D-galactose.Chin J Pharm Toxicol (中国药理学与毒理学杂志),1990,4:309-310.
