中药复方对大肠杆菌攻毒小鼠的保护作用
2015-01-09杨建英黄名钱肖莉春郭小权孔祥峰
杨建英,黄名钱,肖莉春,郭小权,孔祥峰
1中国科学院亚热带农业生态研究所 亚热带农业生态过程重点实验室 湖南省畜禽健康养殖工程技术研究中心,长沙 410125;2河南科技大学 医学技术与工程学院,洛阳 471003;3 江西农业大学 动物科学技术学院,南昌 330045
由大肠杆菌(E.coli)感染引起的细菌性传染病给畜牧业带来了极大的经济损失[1]。在畜牧生产中,由于抗菌药物的滥用导致E.coli 的耐药菌株不断出现,耐药谱不断扩大,不仅增加了治疗难度,也会产生严重的药物残留问题,并引起食品安全隐患[2]。我国中药的资源丰富、种类众多、作用各异,在防治疾病方面具有毒副作用小、无有害残留、不易产生耐药性等优势,愈来愈被大家所关注[3,4]。笔者前期研究测定了29 味中药的水提物和中性醇提物对10 个猪源耐药大肠杆菌分离株和3 个大肠杆菌标准菌株的体外抑制活性,发现五倍子和连翘对13 株受试菌的抑制作用最强,山楂、秦皮、大黄、大青叶、黄连和黄芩对部分受试菌也有一定抑制作用[5];同时测定了山楂、五味子、连翘和金银花的水提物对猪源耐四环素大肠杆菌的体外抑制活性,发现四种中药提取物均具有较强的抑菌活性,但与四环素混合使用其抑菌作用下降[6]。本试验利用前期筛选出的4 种中药提取物组成复方(下称中药复方),进一步观察其对大肠杆菌攻毒小鼠的保护作用,为其在大肠杆菌病防治中的应用提供依据。
1 材料与方法
1.1 药物制备
试验选用山楂(Fructus Crataegi,FC)、连翘(Fructus Forsythiae,FF)、金银花(Flos Lonicerae,FL)和五味子(Fructus Schisandrae,FS),均购自亳州长生中药饮片有限公司。每种中药各取100 g,分别加入500 mL 蒸馏水,武火加热至沸腾,然后文火加热,维持微沸1 h,期间不断搅拌,4 层纱布过滤得滤液;在药渣中再加入500 mL 蒸馏水,同法煎煮、过滤。合并滤液,加热浓缩至100 mL,即每mL 煎液中含有1 g 生药。4 种单味中药的水提液等比例混合,制得中药复方,-20 ℃保存备用。使用前加热完全溶解,混匀。
盐酸四环素(Tetracycline,TC),购自博美试剂公司。溶于蒸馏水后,配成1 mg/mL 溶液,-20 ℃保存备用。
1.2 小鼠饲料制备
试验用饲料为小鼠的商品饲料,由湖南斯莱克景达实验动物有限公司提供。饲粮的营养水平为:干物质88.55%、粗灰分7.4%、粗蛋白20.3%、粗脂肪8.19%、能量22.51 MJ/kg(以干物质为基础)。
称取3 份等量饲料并粉碎,每份加入适量双蒸水,使其成粘稠状。在3 份饲料中分别按1%的比例加入1 mg/mL 的TC 溶液、1 g/mL 的中药复方煎液、1 mg/mL 的TC 与1 g/mL 的中药复方煎液等比例混合液。制成棒状饲料后置于70 ℃烘48 h 后取出,作为试验小鼠的饲料。
1.3 菌液制备
试验攻毒使用的大肠杆菌标准株K88、K99 和K101,由中国科学院亚热带农业生态研究所畜禽健康养殖研究中心保存。攻毒前,取复壮的大肠杆菌标准株,分别接种到装有50 mL LB 液体培养基的锥形瓶中,37 ℃、200 rpm 条件下培养16~24 h,使菌液浓度为1 ×108CFU/L。用无菌LB 液体培养基将菌液稀释1000 倍,3 种菌液等比例混合,4 ℃保存备用。
1.4 试验动物、饲养管理及分组
试验选用体重为18~20 g 的昆明小鼠50 只,雌、雄各半,由湖南斯莱克景达实验动物有限公司提供。购入后在清洁环境中单笼饲养2 d,以消除运输应激等因素的影响,期间饲喂无菌蒸馏水和商品饲料。观察小鼠的健康状态和行为。
将小鼠随机分成5 组,每组10 只,雌、雄各半,分别为对照组、攻毒组、TC 组、中药复方组、中药复方+TC 组。对照组、攻毒组小鼠均饲喂商品饲料,其他各组饲喂制备好的相应饲料。自由采食,自由饮用无菌水。连续饲喂2 周后,除对照组小鼠腹腔注射无菌生理盐水外,其余各组小鼠均腹腔注射大肠杆菌菌液(0.1 mL/10 g),攻毒后每3 h 观察一次小鼠的精神状态、腹泻和死亡情况。
1.5 生长性能测定
试验开始前对每只小鼠进行称重,并记录。试验期间,记录每只小鼠的日采食量;攻毒前,对各组小鼠进行称重并记录,计算平均日增重、平均日采食量和料重比。
1.6 肠道损伤观察
各试验组取6 只刚死亡的小鼠,解剖并分离空肠和回肠组织,用生理盐水清洗内容物后,取2~3 cm 长的小肠组织置于10%中心福尔马林溶液固定,石蜡包埋后制作切片,H.E.染色后,在光学显微镜下观察其病理学变化,并用测微尺测定肠绒毛高度并进行统计。
1.7 数据统计与分析
数据以“平均值±标准差”表示,用SAS 8.0 统计软件按单因素设计对数据进行方差分析,不同处理组间平均值采用Duncan 法进行多重比较。P<0.05 为差异显著。
2 结果与分析
2.1 中药复方对大肠杆菌攻毒小鼠生长性能的影响
由表1 可见,试验各组小鼠的初始重无显著差异;连续给药14 d 后,试验各组小鼠的平均日增重、平均日采食量、料重比和末重差异均不显著。
2.2 中药复方对大肠杆菌攻毒小鼠死亡情况与存活率的影响
由表2 可见,攻毒后3 h,小鼠开始死亡,死亡小鼠数量依次为,中药复方组3 只<攻毒组4 只、中药复方+四环素组4 只<四环素组5 只;攻毒后6 h,死亡小鼠数量依次为,中药复方组5 只<中药复方+四环素组7 只<四环素组8 只<攻毒组9 只;攻毒后12 h,死亡小鼠数量依次为,中药复方组5 只<中药复方+四环素组8 只<四环素组10 只、攻毒组10 只;攻毒后24 h,中药复方组又死亡1 只,其他各组均停止死亡。整个试验期间,对照组小鼠无发病或死亡发生。攻毒后48 h,中药复方组的存活率最高,为40%;其次是中药复方+四环素组,保护率为20%;但是攻毒组和四环素组小鼠均全部死亡。攻毒后,试验各组小鼠均未见腹泻症状。
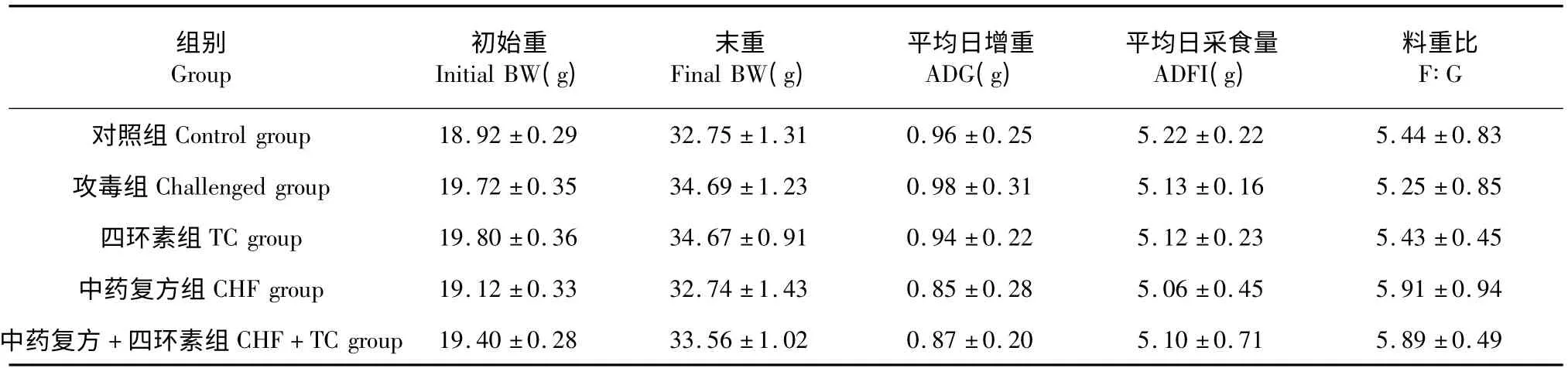
表1 试验各组小鼠的生长性能(n=10)Table 1 Growth performance of mice in each experiment group (n=10)
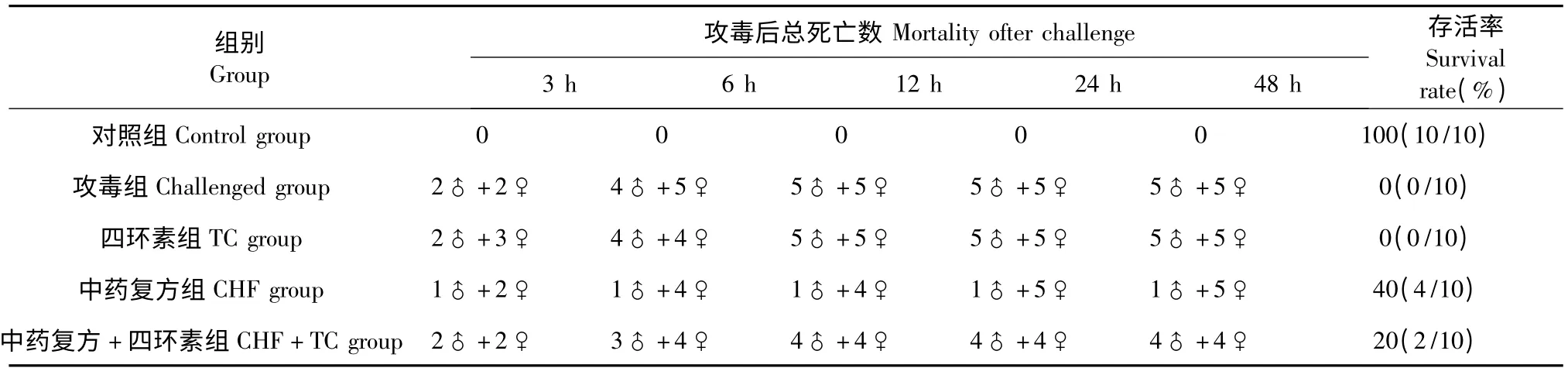
表2 试验各组小鼠死亡情况及存活率Table 2 Mortality information and survival rate of mice in each experiment group
2.3 中药复方对大肠杆菌攻毒小鼠小肠绒毛高度的影响
各试验组小鼠的小肠形态学结构变化见图1。大肠杆菌攻毒组小鼠的空肠和回肠形态结构严重受损,出现出血、炎症细胞浸润等病变,用药组上述病变得到不同程度的改善。由表3 可知,小鼠空肠绒毛高度,攻毒组、四环素组、中药复方组和中药复方+四环素组均显著低于对照组(P<0.05),且4 个组之间差异不显著;与攻毒组相比,四环素组、中药复方组和中药复方+四环素组有升高趋势。小鼠回肠绒毛高度,对照组、四环素组、中药复方组和中药复方+四环素组均显著高于攻毒组(P<0.05),且4个组之间差异不显著;与对照组相比,四环素组、中药复方组和中药复方+四环素组均有降低趋势。
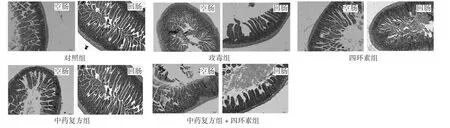
图1 各组小鼠的小肠形态学结构(H.E.)Fig.1 Morphological structure of small intestine in mice of each group (H.E.)
3 讨论
大肠杆菌感染可引起动物发病,主要表现为腹泻、精神沉郁、反应迟钝,严重者因脱水、代谢性酸中毒而死亡,有时在没有出现腹泻等临床症状前就突然死亡。剖检表现为肠道充气、充血明显,肠壁变薄、松弛,肠黏膜上皮脱落等[7]。本试验以大肠杆菌标准株K88、K99 和K101 联合攻毒后,死亡小鼠剖检可见肠道肿胀、充血,十二指肠和空肠中充满黄绿色积液,回肠中充满乳白色黏稠液体,肠壁上有出血点或出血斑;病理切片可见出血、炎症细胞浸润等病变;严重者,小肠黏膜、黏膜下层和肌层均有充血、出血等病变,与自然发病动物的临床症状和病理变化相同,说明用本方法能够成功制备小鼠的大肠杆菌病模型。
本试验以自拟的中药复方预防小鼠的大肠杆菌病,产生了一定的保护作用,其中中药复方组小鼠的存活率高达40%,中药复方+四环素组小鼠的存活率为20%,显著高于攻毒组和四环素组小鼠的存活率。中药复方对大肠杆菌攻毒小鼠的保护作用与其组份药具有较强的体外抑菌作用有关[6]。攻毒后试验各组小鼠的死亡时间表现出一定的差异。攻毒后3 h,死亡小鼠数量依次为,中药复方组3 只<攻毒组4 只、中药复方+四环素组4 只<四环素组5只,在一定意义上也说明了中药复方提高了机体的抵抗力。攻毒后3 h 四环素组小鼠死亡最多,可能与使用四环素后细菌内毒素大量释放引起机体毒血症有关[8,9]。另外,该中药复方对不同性别的大肠杆菌病患鼠的保护作用存在差异,是否提示性激素参与了其保护作用的调节过程尚需要进一步研究。
肠道是机体消化、吸收和代谢营养物质的重要器官,也是重要的免疫器官[10]。肠绒毛是小肠的重要组成部分,其强有力、有规则地摆动有助于阻止有害菌的定植;同时,肠绒毛的长度与形态变化也直接影响其表面积,进而影响肠道对营养物质的吸收能力[11]。本试验病理学观察发现,大肠杆菌攻毒后,小鼠的空肠和回肠形态结构严重受损,绒毛高度显著降低;提前2 周饲喂添加四环素、中药复方、中药复方+四环素的饲料,可对大肠杆菌攻毒引起的空肠和回肠损伤表现出一定的抵抗作用,其中中药复方的效果最为明显。这说明中药复方的预防给药一定程度上可以保护小肠的形态结构与功能,使其免受大肠杆菌的攻击与感染,所以中药复方组的大肠杆菌攻毒小鼠的成活率较高。
综上所述,本试验选择四种对猪源耐药大肠杆菌分离株具有较强抑制作用的中药提取物组成中药复方,可以一定程度地保护大肠杆菌攻毒小鼠的小肠结构和功能,显著降低病死率,对大肠杆菌病有较好的保护作用。
1 Yin YL (印遇龙),Kong XF (孔祥峰),Li TJ (李铁军).The main problem of livestock and poultry breeding in China facing the new century and counter measures.Feed Ind (饲料工业),2007,28(14):1-5.
2 Kong XF (孔祥峰),Kong XG (孔祥国),Hu YL (胡元亮).Progress in research on etiology of cow endometritis.Anim Husb Vet Med (畜牧与兽医),2005,37(11):56-58.
3 Kong XF (孔祥峰),Wu X (吴信),Yin YL (印遇龙),et al.Research and development of Chinese medicine feed additive.Anim Husb Vet Med (畜牧与兽医),2007,39(11):35-37.
4 Liu FL (刘富来),Chen ZH (陈志华),Feng CL (冯翠兰),et al.In vitro bacteriostatic test of Chinese herbal medicine on avian Escherichia coli.Liaoning J Anim Husb Vet Med(辽宁畜牧兽医),2002,6:1-3.
5 Xiao LC (肖莉春),Kong XF (孔祥峰),Huang MQ (黄名钱),et al.Antimicrobial activities of Chinese herb extracts against antibiotic-resistant solates of E.coli from swine farms.Acta Agric Univ Jiangxiensis (江西农业大学学报),2013,35:1248-1254.
6 Huang MQ (黄名钱),Kong XF (孔祥峰),Xiao LC (肖莉春),et al.Inhibitory activity of Chinese herbal aqueous extracts to tetracycline-resistant E.coli of swine.Sci Agric Sin(中国农业科学),2013,46:2370-2376.
7 Miao DN (缪德年),Hui FN (绘福南),Fang MS (方明生).Pathological changes of diarrhea caused by E.coli in piglets.Anim Husb Vet Med (畜牧与兽医),1998,30:202-204.
8 Wang ZJ (王志军),Sun X (孙鑫),Chen W (陈伟).Reg-ulation of removing blood stasis on the immune dysfunction induced by antibiotic-induced release of endotoxin.Jiangsu J Tradit Chin Med (江苏中医药),2014,46(3):36-37.
9 Li D (李丹),Zhang JM (张建梅),Chen XF (程秀芳),et al.The effects of antibiotics and probiotics on broiler body of toxins and cytokines.Fees Husb (饲料与畜牧),2013(9):39-41.
10 Cheng LZ (成令忠).Histology,2nd ed(组织学,第2 版).Beijing:People's Medical Publishing House,1994.102-125.
11 Yang Q (杨倩).Animal Histology and Embryology (动物组织学与胚胎学).Beijing:China Agricultural University Publishing House,2008.213-215.
