响应面法优化忽地笑多糖提取工艺及石蒜属植物多糖含量比较研究
2015-01-09刘小攀田春莲姚姝凤董爱文田启建
刘小攀,田春莲,姚姝凤,董爱文,田启建
吉首大学林产化工工程湖南省重点实验室,张家界 427000
多糖是由多个单糖分子缩合、失水而成,是一类分子结构复杂且庞大的糖类物质,植物多糖是多糖的重要组成部分。大量的药理与临床研究证明,植物多糖具有抗肿瘤、防衰老、抗病毒、免疫、抗氧化、降血糖、降血脂等多种药理作用,尤其是一种高效免疫调节剂,它能激活免疫细胞而对正常细胞无毒副作用,目前已广泛应用于医药保健品行业[1-8]。石蒜属植物虽富含生物碱、多糖和及黄酮类化合物[9-11],但目前研究热点是石蒜生物碱及药理活性[12],石蒜多糖作为燃料酒精[13]有报道,多糖提取仅见于吴彦等[14]的研究,但未优化工艺且提取率低。石蒜属植物全世界约20 余种,我国有15 种,主要分布于长江以南,尤以温暖地区种类较多[15]。湖南湘西地区石蒜属植物主要有忽地笑[Lycoris aurea (L’Her.)Herb.]、中国石蒜(Lycoris chinensis Traub)、稻草石蒜(Lycoris straminea Lindl.)、石蒜[Lycoris radiata(L’Her.)Herb.]和玫瑰石蒜(Lycoris rosea Traub et Moldenke)等,其药用价值未能得到深度开发。因此,本研究立足当地资源,运用响应面分析软件优化了石蒜多糖传统水提的工艺条件,并比较了忽地笑等五种石蒜属植物的不同营养器官的多糖含量,旨在获得石蒜多糖低成本、高得率的绿色提取工艺,筛选出高石蒜多糖含量的种质资源,为综合开发石蒜,进一步提高石蒜深加工的附加值提供基础数据和技术支撑。
1 材料与方法
1.1 材料与试剂
忽地笑等实验材料采自吉首大学张家界校区后山石蒜栽培基地,经吉首大学廖博儒研究员鉴定为石蒜科石蒜属植物忽地笑、中国石蒜、稻草石蒜、石蒜及玫瑰石蒜。葡萄糖标准品(批号:130410-1)购自西陇化工股份有限公司;蒽酮、浓硫酸、无水乙醇和石油醚均为分析纯;实验用水为去离子水。
1.2 仪器
AEL-40SM 十万分之一分析天平(日本岛津公司);UV-3900 型紫外可见分光光度计(日本日立公司);数显恒温水浴箱(金坛市富华仪器有限公司);TDL-40B 低速台式大容量离心机(上海安亭科学仪器)。
1.3 实验方法
1.3.1 原料预处理
分别将忽地笑、中国石蒜、稻草石蒜、石蒜和玫瑰石蒜的根茎叶洗净,干燥,粉碎,过40 目筛,称取一定量的各样品加入一定量石油醚浸泡24 h,然后用一定量95%乙醇浸泡24 h,以除去其中的脂溶性物质及部分色素,将残渣45 ℃烘干,备用。
1.3.2 忽地笑多糖的提取
准确称取经处理的忽地笑鳞茎粉末2.0 g 于50 mL 锥形瓶中,加入一定量的水,于一定温度下水提,提取液4000 rpm 离心10 min,过滤,定容至100 mL,得忽地笑粗多糖溶液。根据蒽酮-硫酸法测定吸光度,计算忽地笑多糖含量。
1.3.2.1 单因素实验设计
以忽地笑多糖得率为指标,按照1.3.2 的方法,在一定条件下,分别考察液料比10∶1、15∶1、20∶1、25∶1 和30∶1(mL∶g);提取温度55、65、75、85、95℃;提取时间3、4、5、6、7、8 h,对忽地笑多糖得率的影响。
1.3.2.2 响应面实验设计
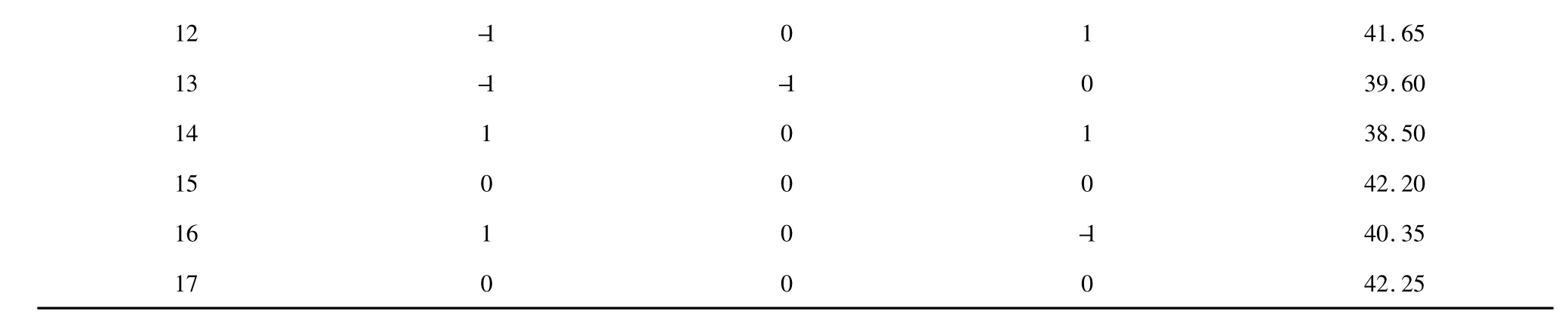
为进一步得出忽地笑多糖最佳提取工艺和综合考察各因素的交互影响,在单因素实验基础上,根据Box-Benhnken 实验设计原理,设计三因素三水平的响应面分析实验(表1)。以提取温度(A)、液料比(B)、提取时间(C)为自变量,以忽地笑多糖得率为响应值,通过Design-Expert 8.0.6.1 软件,对提取工艺进行响应面分析。求出数学模型,得到最佳工艺参数。

表1 Box-Benhnken 实验因素水平表Table 1 Factors and levels of Box-Benhnken design
1.3.3 标准曲线的绘制
参照文献[16]并改进,称取105 ℃真空干燥至质量恒定的葡萄糖50 mg,用去离子水定容至100 mL容量瓶中,摇匀,制成0.5 mg/mL 葡萄糖溶液。分别取1.0、2.0、4.0、6.0、8.0、10.0 mL 于50 mL 容量瓶中,去离子水定容至刻度。各取以上6 组溶液2 mL 于50 mL 锥形瓶中,冰水中加入0.2%的蒽酮-硫酸试剂(80%的浓硫酸)8 mL,摇匀,沸水浴10 min,冷却至室温,于625 nm 处测吸光度(A625),以2 mL去离子为空白。以葡萄糖浓度C(mg/mL)为横坐标,吸光度A 为纵坐标,得回归方程A=9.285C +0.004,r=0.9995,在0.01~0.10 mg/mL 之间葡萄糖对照品浓度与吸光度呈良好的线性关系。
1.3.4 忽地笑多糖得率计算
采用蒽酮-硫酸法测定忽地笑中多糖的含量,根据实验所得回归方程A=9.285C+0.004,r=0.9995 计算样品中多糖的含量,从而得到每个实验组鳞茎中多糖得率,忽地笑多糖得率计算公式如下:
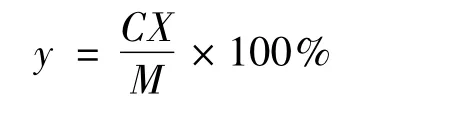
式中:C 为忽地笑粗多糖质量浓度(mg/mL);X为稀释倍数;M 为忽地笑鳞茎粉末质量/g;y 为忽地笑多糖得率/%。
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对多糖得率的影响
液料比是提取忽地笑多糖的一个很重要因素。结果如图1(a),液料比在10∶1~20∶1 (mL∶g)内,多糖得率随液料比的增加而上升,当液料比达到20∶1(mL∶g)时多糖得率达到最高,之后随液料比的增加多糖得率逐渐下降。这可能是由于随着液料比的增加,多糖在水溶剂中逐渐达到饱和,再增大溶剂的体积,易提取出大量的杂质而且不利于后续的处理。所以,选最佳液料比为20∶1(mL∶g)。
2.1.2 提取温度对多糖得率的影响
由图1(b)可知,在55~75 ℃内,随着温度的升高,多糖得率逐渐上升,75 ℃时达最大值,然后随浸提温度升高多糖得率逐渐降低,可能由于温度过高导致多糖的分子结构遭到破坏,故选取75 ℃为宜。
2.1.3 提取时间对多糖得率的影响
据图1(c)所知,忽地笑多糖得率在3~7 h 内随提取时间延长而增加,7 h 时达最大,超过7 h 多糖得率急剧下降。可能由于随着时间的延长,忽地笑粉末得到充分的浸泡而有利于多糖的溢出,超过一定时间后多糖发生水解而使提取率下降。因此,选取提取时间7 h。
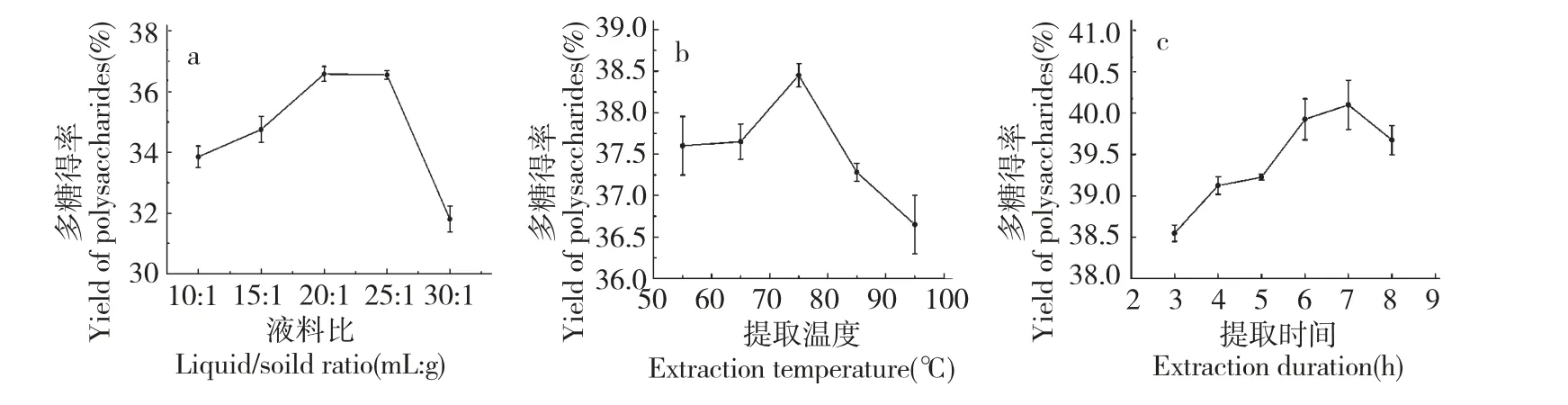
图1 液料比(a)、提取温度(b)、提取时间(c)对忽地笑多糖得率的影响Fig.1 Effect of liquid/solid ratio (a),extraction temperature (b),extraction duration (c)on extraction yield of L.aurea polysaccharides
2.2 响应面实验结果
2.2.1 响应面实验分析
通过Design-Expert 8.0.6.1 软件对表2 中实验结果进行回归拟合分析,经二次回归拟合后得回归方程:Y=42.01-0.50A +0.39B +0.29C-0.59AB-1.06AC-0.18BC-1.53 A2-0.44 B2-0.54 C2。
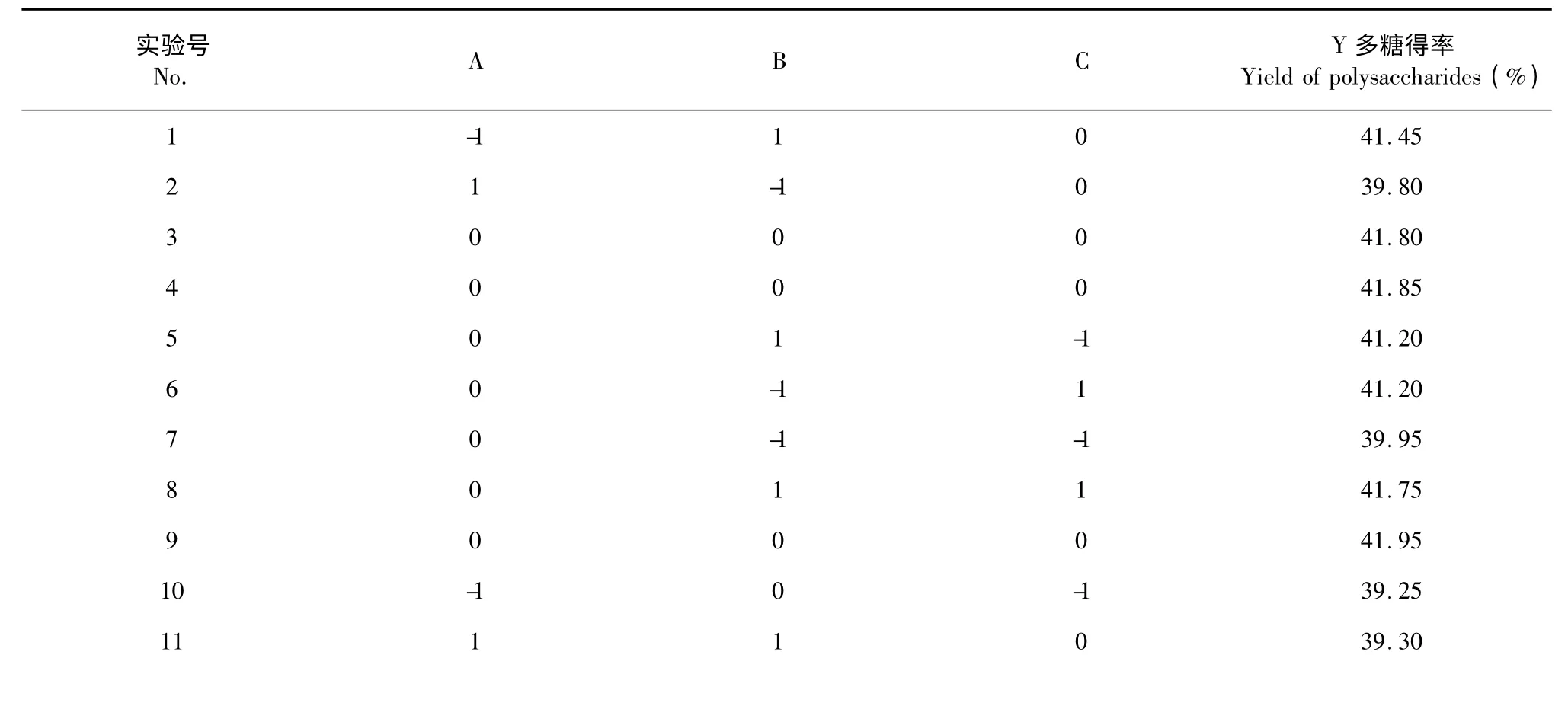
表2 Box-Benhnken 设计方案及结果Table 2 Box-Benhnken design and experimental results
方差分析结果见表3。从表3 可知,较高的F值(45.53)和较低的P(<0.0001)表明Quadratic 回归方差模型极其显著,模型的确定系数R2=0.9832,接近1,说明其因变量与全体自变量之间的多元回归关系显著,真实值与预测值之间有很好的相关性,回归方程能够很好地模拟真实曲面,该实验方法是可靠的。模型的调整系数=0.9616,这就意味着该模型能预测大部分(>96%)多糖提取率的变化,只有不到4%不能通过该模型去解释。因而该模型拟合程度良好,实验误差小。失拟项是用来评估方程可靠性的一个重要数据,本实验失拟项F 值为1.77,P 值为0.2914>0.05,说明该模型失拟项不显著,能很好地预测相关的反应。另外,实验变异系数C.V.%越小表明实验越可靠,本实验的变异系数C.V.%为0.58,说明实验值精密度高,可靠。因此,可用该模型方程来分析和预测不同提取条件下忽地笑多糖得率的变化。
P 值是用来检测每个变量以及变量之间的显著水平,P 值越小,说明变量对实验的影响越显著,由表3 可知A、B 和C 对忽地笑多糖得率都有显著影响,且影响顺序为:A>B>C;二次项A2、B2和C2对忽地笑多糖得率也有显著影响,且A2对忽地笑多糖得率有极显著影响(P<0.0001),交互项AB、AC也对得率有显著影响,且AC 对忽地笑多糖得率也有极显著影响(P<0.0001),BC 影响不显著。
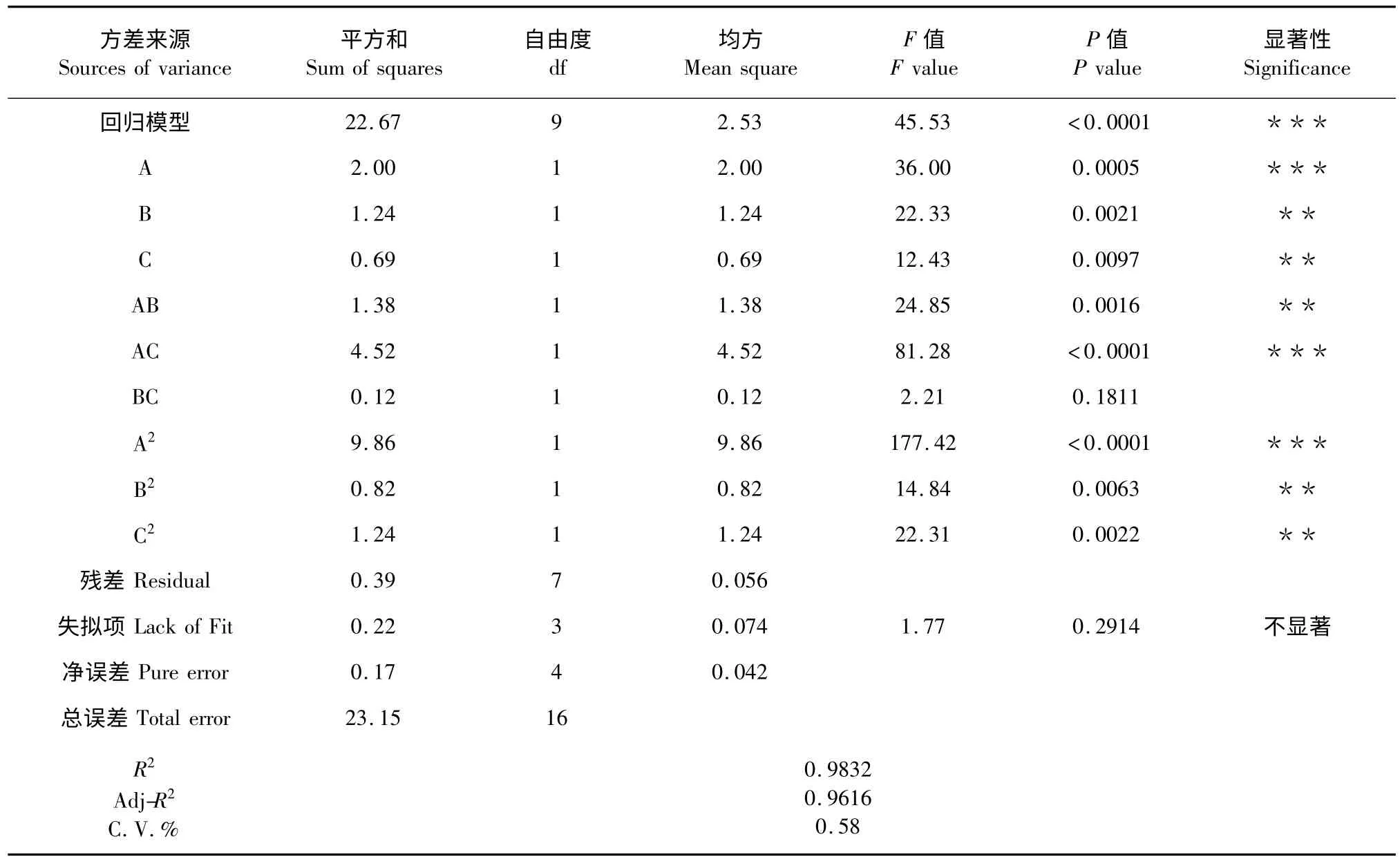
表3 回归模型方差分析结果Table 3 Results of the variance analysis of regression model
2.2.2 响应面及最优化分析
3D 响应面和2D 等高线是回归方程的图形化表示,它提供了实验值与预测值的关系和各个变量之间的相互作用,圆形和椭圆形等高线表示各变量之间的显著水平,圆形等高线表示相应变量的交互作用不显著,椭圆等高线表示相应变量的交互作用显著。本实验的曲面图和等高线图见图2。
图2(a)说明在提取时间一定时,提取温度和液料比对忽地笑多糖得率的作用,随着液料比的增大,忽地笑多糖得率逐渐增大,而随着提取温度的升高多糖得率先上升后减少。图2(b)表示液料比一定时,提取温度和提取时间对忽地笑多糖得率的影响,提取时间一定时,多糖得率随着提取温度的增加呈现先增大后减小的趋势,提取温度一定时,多糖得率随着时间的延长逐渐增大。由图2(c)可知,在提取温度一定时,在等高线图中,等高线形状接近圆形,说明B 和C 两个因素交互作用不明显,也就是对忽地笑多糖得率的影响不显著。
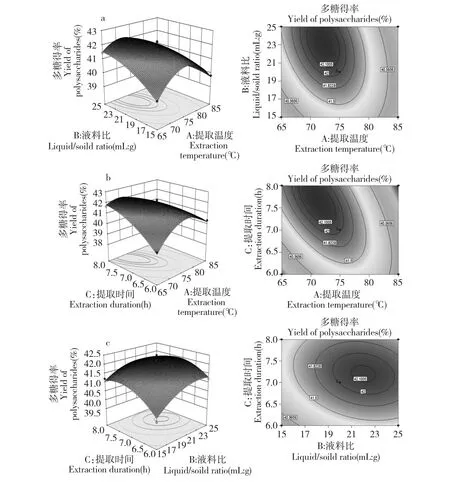
图2 各两因素交互作用对忽地笑多糖得率影响的响应面图及等高线Fig.2 Response surface plots and contour plots showing the interactive effects of four extraction parameters on L.aurea polysaccharide yield
2.3 最佳工艺确定与验证性实验
根据所得到的模型,利用Design-Expert 8.0.6.1软件进行分析,得到在最佳提取温度69.74 ℃、提取时间7.68 h、液料比23.30∶1(mL∶g)时,多糖的理论得率为42.37%。为了检验响应面法的可行性,对回归得到的最佳提取条件进行验证实验,但是考虑到实验操作的可行性与简便性,将最优提取条件该为:提取温度70 ℃、提取时间7.7 h、液料比23∶1(mL∶g)、在此条件下进行5 次平行实验,忽地笑多糖的得率为42.00%,与预测值的相对误差为0.87%。说明实验值与预测值基本吻合。因此,响应面法优化所得的提取条件参数准确可靠,具有一定的实用价值。
2.4 不同石蒜属植物的不同形态学部位多糖含量比较
石蒜属植物根、茎、叶等部位均含有多糖,但其含量在植物种类和组织器官间有显著差异。如图3所示,营养器官相比较,鳞茎最高,其次是根,叶中多糖含量最低,可能由于鳞茎为库,叶片为源,同时,采集样品是在2015年4 月初,而春出叶型的中国石蒜叶未成熟,导致含量最低;另一方面,多糖在五种石蒜属植物间差异明显,石蒜供试器官多糖含量均高于其他各种,尤其石蒜鳞茎中多糖最高可达49.21%;其次是稻草石蒜,除鳞茎和叶含量较高外,根中最高可达36.47%,相比之下,中国石蒜各器官多糖含量最低,可能因为中国石蒜由1000 m 以上的高海拔地区引入低海拔地区造成品种退化所致。因此,石蒜多糖提取适宜采用的石蒜属植物为石蒜和稻草石蒜,除鳞茎作为提取材料外,根、叶也可采用,这样对于充分利用石蒜属植物资源,物尽其用具有重要意义。
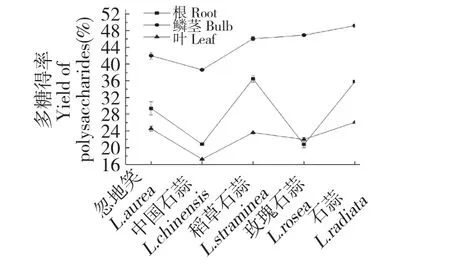
图3 不同石蒜属植物多糖含量比较Fig.3 Comparison of polysaccharides contents in different Lycoris plant
3 结论
本实验采用传统的热水提取忽地笑多糖,并比较了石蒜属植物不同部位多糖含量,对石蒜属多糖的后续开发和利用有较大的现实意义。探索了提取温度、提取时间、和液料比对多糖得率的影响,经单因素和响应面实验,得出热水提取忽地笑多糖的最佳工艺为提取温度70 ℃、提取时间7.7 h、液料比23∶1(mL∶g),在此条件下得到的实际多糖提取率与预测值的相对误差仅为0.87%,表明Box-Behnken 设计法用于石蒜多糖提取工艺的优化筛选是可行的。
石蒜属植物不同器官多糖含量分布有差异,以鳞茎中多糖含量明显高于根与叶;就种间鳞茎多糖比较,石蒜鳞茎含量最高,可达49.21%。因此选用良种是首要环节,故选择石蒜鳞茎进行多糖提取,具有高效节能的效果。此研究可为合理开发利用石蒜源提供一定参考。
1 Zhao CJ,Li Z,Li CY,et al.Optimized extraction of polysaccharides from Taxus chinensis var.mairei fruits and its antitumor activity.Int J Biol Macromol,2015,75:192-198.
2 Li GF(李广富),Chen W(陈伟),Li TT(李听听),et al.Study on the anti-senile effect of Ganoderma lucidum polysaccharides probiotic yogurt.Food Ferment Ind(食品与发酵工业),2015,41(2):41-45.
3 Saha S,Navid MH,Bandyopadhyay SS,et al.Sulfated polysaccharides from Laminaria angustata:Structural features and in vitro antiviral activities.Carbohydr Polym,2012,87:123-130.
4 Wang XM(王雪梅),Jia TY(贾天玉),Guan B(管彬),et al.Effects of Astragalus polysaccharide on CD4+CD25+Treg cell and Th17 cell in immunesuppressed mice.Nat Prod Res Dev (天然产物研究与开发),2015,27:153-157.
5 Liu JL,Zheng SL,Fan QJ,et al.Optimisation of high-pressure ultrasonic-assisted extraction and antioxidant capacity of polysaccharides from the rhizome of Ligusticum chuanxiong.Int J Biol Macromol,2015,76:80-85.
6 Dai R(代荣),Liu RM(刘如明),Xiao JH(肖建辉).Research progress on hypoglycemic effect and its mechanism of action of medicinal fungal polysaccharides.China J Chin Mater Med(中国中药杂志),2015,40:174-179.
7 Li MJ(李孟婕),Fan XP(范秀萍),Wu HM(吴红棉),et al.Hypolipidemic effect of crude polysaccharides from Perna viridis.Food Sci(食品科学),2012,33:257-261.
8 Liu Q(刘齐),Du P(杜萍),Wang FS(王飞生),et al.Study on ultrasonic extraction of polysaccharides in chestnut shell by response surface methodology.Sci Technol Food Ind(食品工业科技),2014,35:221-223.
9 Wang H(王欢),Wang YH(王跃虎),Chen LJ(陈丽娟),et al.Research progress of alkaliods from Lycoris.Nat Prod Res Dev (天然产物研究与开发),2012,24:691-697.
10 Wu Y(吴彦),Zhou SB(周守标),Wan A(万安).Analysis and comparison of polysaccharide content in Lycoris.Guihaia(广西植物),2005,25:264-268.
11 Yang Y(杨郁),Huang SX(黄胜雄),Zhao YM(赵毅民),et al.Flavonoids from Lycoris aurea.Nat Prod Res Dev (天然产物研究与开发),2005,17:539-541.
12 Song DF(宋德芳),Shi ZQ(石子琪),Xin GZ(辛贵忠),et al.Research advances in pharmacological effects of Amaryllidaceae alkaloids.Chin New Drug J(中国新药杂志),2013,22:1519-1524.
13 Yang X(杨鑫).The extraction of alkaloids and polysaccharide from Lycoris radiate and Study Their Relationships with The Ethanol Fermentation.Wuxi:Jiangnan University (江南大学),PhD.2011.
14 Wu Y(吴彦),et al.The extraction technique of polysaccharide from Lycoris radiata.J Anqing Teachers Coll,Nat Sci(安庆师范学院学报,自科版),2004,10(2):90-91.
15 Editorial Board of Flora China(中国科学院中国植物志编委会).Flora of China (中国植物志).Beijing:Science Press,1985.16,16.
16 Zhang H(张红),Wang T(王腾),Li CQ(李翠清).Determination of polysaccharides from mulberry leaf by optimization of anthrone-sulfuric acid method by response surface methodology.Sci Technol Food Ind (食品工业科技),2012,24:62-65.
