新斯的明拮抗银环蛇毒素对大鼠膈肌张力的影响
2015-01-08陈少英梁子敬
陈少英 李 燕 梁子敬* 梁 庆 刘 荣
(1广州医科大学附属第一医院急诊科,广东广州510120;2广东省中医院急诊科,广东广州,510120)
银环蛇毒主要以神经毒素为主,包含多种成分,毒性强,中毒者常因神经肌肉传导阻滞表现为横纹肌无力,严重者可因呼吸肌肉呈弛缓性瘫痪而无力出现呼吸停止,导致窒息死亡。临床上应用新斯的明拮抗银环蛇引起的肌无力存在争议且缺乏随机对照研究[1,2],国内外有离体实验证明新斯的明对银环蛇的成分毒所致的肌无力有拮抗作用,但疗效不确定[3,4]。本实验应用新斯的明干预经银环蛇毒处理过的膈肌肌条,通过记录离体膈肌肌条张力大小,以探讨新斯的明对银环蛇毒处理后的膈肌收缩性的早期影响。
1 资料与方法
1.1 一般资料
银环蛇粗毒(南昌农大特种动物蛇类养殖场),甲硫酸新斯的明注射液(上海信谊金朱药业有限公司,国药准字:H31022770),氯化乙酰胆碱(阿拉丁试剂公司),苛氏液(pH 7.4)组成(mmol/L)[4]:NaCl(118);KCl(4.8);KH2PO4(1.2);CaCl2(2.5);NaHCO3(25);MgSO4(2.4)and D-(+)glucose(11),溶解于去离子水。试剂购置于阿拉丁试剂公司。成年SPF级SD雌性大鼠,购置于广东省医学动物中心,体质量为200~220 g,共24只。
1.2 方法
实验大鼠均经3%戊巴比妥钠腹腔麻醉,分别与腹腔、胸腔分离并取出膈肌后立即浸入通有混合气(95%O2,5%CO2)的苛氏液中。去除膈肌周围的残留血液、脂肪组织等后,将膈肌沿肌纤维方向分离制成实验用肌条(1 cm×1.5 cm),肌条一端用丝线固定并连于高精度张力换能器(JZ300型,北京新航兴业科贸有限公司)上,通过桥式放大器由8导生理记录仪记录张力改变情况,后由Labchat 7软件分析并显示肌条张力大小。另一端固定于固定杆上并使整个肌条浸于麦氏槽中,槽中液体为苛氏液,容积为10 mL,且持续通入混合气,温度维持37℃。整个准备过程中,注意实验用肌条不能过度牵拉。调节膈肌肌条前负荷为1 g[4],平衡45 ~60 min,每15 分钟更换苛氏液。平衡后用10-4mmol/L浓度[5]的乙酰胆碱刺激,待再次达到平衡后,给予银环蛇粗毒毒素(浓度:5μg/mL),5 min后冲洗并给予不同浓度的新斯的明(1、3、10 μmol/L)或生理盐水(对照组),记录不同时间段(5、10、15、30、60 min)膈肌肌条张力(g)大小。
1.3 统计学分析
实验数据以¯x±s表示。应用SPSS 16.0统计软件进行统计分析。多组比较采用单因素方差分析,选择dunnetts检验方法,P<0.05为差异有统计学意义。
2 结果
各组肌条在不同时间段的影响见图1及表1:①5 min:1、3、10μmol/L浓度新斯的明较对照组的肌力恢复均不明显,差异均无统计学意义(P>0.05);②10 min:1、3μmol/L浓度新斯的明较对照组的肌力均有恢复,但差异无统计学意义(P>0.05)。10μmol/L浓度新斯的明较对照组的肌力恢复明显,差异有统计学意义(P<0.01)。③15和30 min:1、3、10μmol/L浓度新斯的明的肌力均有恢复;其中只有10μmol/L组与对照组差异有统计学意义(P<0.05)。随新斯的明浓度增加,肌力恢复程度增加。10μmol/L比1和3μmol/L两组差异明显。④60 min:1、3、10μmol/L浓度新斯的明的肌力均有恢复;其中3、10μmol/L组与对照组差异有统计学意义(P<0.05)。且随新斯的明浓度增加,肌力恢复程度增加。不同浓度组之间差异有统计学意义(P<0.05)。
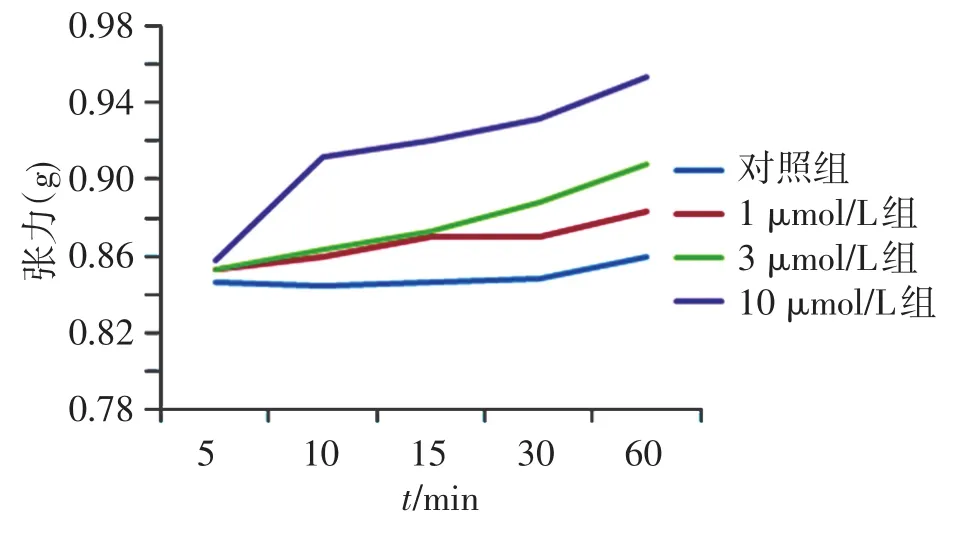
图1 实验各组不同时间段肌张力变化(g)
3 讨论
银环蛇毒含有含多种多肽成分,具有不同的生物学活性[6]。目前已知其蛇毒主要含有α-银环蛇毒和β-银环蛇毒,这两种毒素统称为“银环蛇毒”。此外,银环蛇毒还含有 Candoxin[4]、P-银环蛇毒[7]、κ-银环蛇毒(κ-BGT)、γ-银环蛇毒(γ-BGT)、磷脂酶A[8]和心脏毒素(cardiotoxin)[9]等。各种毒素作用机制及毒性各不相同,最终导致神经肌肉传导阻滞[10-12]。中毒者常表现为横纹肌无力,严重者可因膈肌无力出现呼吸停止,是急诊的一种常见危重急症。目前国际公认的治疗蛇咬伤的方法是应用抗蛇毒血清及快速清除毒素分子等,但鉴于抗蛇毒血清保存难、过敏、无特异性抗蛇毒血清等原因,抗蛇毒血清的应用尚不易普及。而且蛇咬伤的患者常为山区者,因医疗资源受限,往往在蛇咬伤之后不能马上使用抗蛇毒血清,故寻求更多的治疗方式,既可以尽早、便捷、安全、广泛的使用,又可以为蛇咬伤患者争取救治时间就显得十分必要。新斯的明是医保和农合基本用药,如证明有效,可在社区和广大农村、山区广泛推广,争取时间送有条件救治毒蛇伤的医院进一步抢救治疗,从而提高抢救成功率,减少致残率和死亡率。
表1 不同时间段各组肌力恢复情况 (g¯±s)
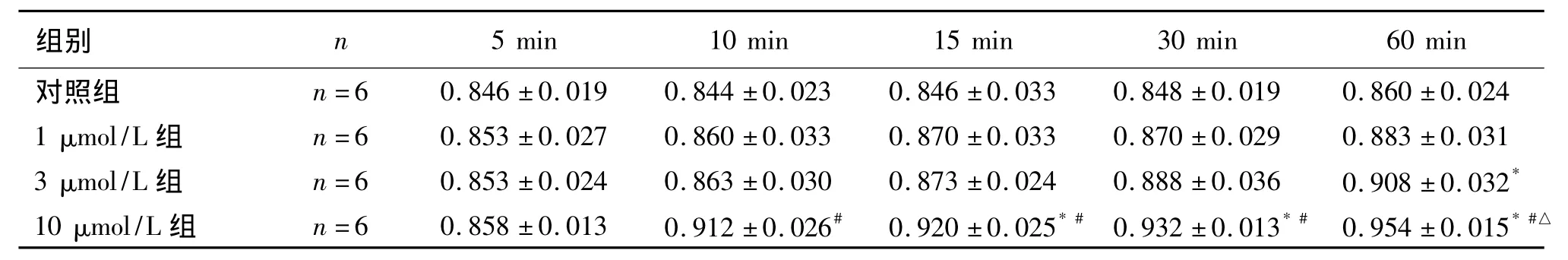
表1 不同时间段各组肌力恢复情况 (g¯±s)
注 :与对照组比较,*P <0.05;与1μmol/L组比较,#P <0.05;与3 μmol/L组比较,△P <0.05
组别 n 8 ±0.019 0.860 ±0.024 1 μmol/L 组 n=6 0.853 ±0.027 0.860 ±0.033 0.870 ±0.033 0.870 ±0.029 0.883 ±0.031 3 μmol/L 组 n=6 0.853 ±0.024 0.863 ±0.030 0.873 ±0.024 0.888 ±0.036 0.908 ±0.032*10 μmol/L 组 n=6 0.858 ±0.013 0.912 ±0.026# 0.920 ±0.025*# 0.932 ±0.013*# 0.954 ±0.015*#△5 min 10 min 15 min 30 min 60 min对照组 n=6 0.846 ±0.019 0.844 ±0.023 0.846 ±0.033 0.84
目前发现以肌无力为症状的重症肌无力、手术中使用肌松剂等疾病中,其病机均为神经肌肉传导阻滞,与银环蛇毒中毒机制非常相似。临床对于重症肌无力、使用肌松剂的患者采用胆碱酯酶抑制剂(如:新斯的明)治疗且疗效明确[13-14],更有相关使用剂量、时机等深入研究[15-16]。国内外也曾对新斯的明拮抗不同类型的银环蛇毒(成分毒素)所致肌无力进行研究,结果表明其影响不确定[3-4]。呼吸活动的强度是由膈肌等吸气肌和腹肌等呼气肌的活动共同决定[17],本实验通过观察膈肌的张力,明确新斯的明拮抗银环蛇毒所致膈肌无力的影响。
本实验发现,在实验各组中,随着时间的推移,肌力均有不同程度的恢复,但在60min时尚未有肌力完全恢复的情况。曾有对比实验[5],用一定浓度的新斯的明拮抗不同类型的蛇毒所致的肌肉无力,结果表明Candoxin的神经肌肉传导功能能快速而且完全恢复,而 α-BGT的神经肌肉传导功能在180min后完全没有恢复。不同时间段各组张力不同程度的恢复,可能原因是部分毒素(例如:Candoxin)从突触后受体清除使得部分的神经肌肉传导功能恢复。但60 min时毒素尚未完全清除,或许是部分毒素(例如 α-BGT)与突触后受体不可逆结合所致和(或)毒素作用的清除需要更多的时间(毒素的清除具有时间依赖性)。
加入新斯的明的各组均有不同程度的神经肌肉功能恢复,可能有以下原因:新斯的明抑制了乙酰胆碱的分解,使得突触间隙中乙酰胆碱的含量升高,从而高浓度乙酰胆碱有利于与毒素竞争性地和受体结合,使得神经肌肉的传导功能得到不同程度的恢复。另高浓度的乙酰胆碱增加了占有原来空闲的乙酰胆碱受体的可能性,加强了神经肌肉功能的传导。故整体表现出新斯的明增加了神经肌肉传导,使得膈肌肌条张力恢复。
本实验中,10μmol/L新斯的明组拮抗效果明显优于1、3μmol/L新斯的明组,提示新斯的明的拮抗效果与其浓度有一定的相关性。既往关于肌松剂筒箭毒碱的研究表明:从数字上讲,如果筒箭毒碱剂量是双倍的,乙酰胆碱浓度必须是4倍才能够与筒箭毒碱相竞争[18]。结合以上研究结果,考虑10 μmol/L新斯的明较1、3μmol/L新斯的明拮抗效果明显是因为:在神经肌肉接头处,新斯的明通过抑制胆碱酯酶使突触间隙的乙酰胆碱含量增加,从数量上讲,10μmol/L新斯的明能产生更多的乙酰胆碱,使其与实验中5μg/mL银环蛇毒相竞争。而1及3μmol/L新斯的明组产生的乙酰胆碱含量未能与5 μg/mL银环蛇毒产生明显的竞争性。
已有的研究表明:达到最大效应剂量前,大剂量的胆碱酯酶抑制剂应该比小剂量的胆碱酯酶抑制剂的拮抗作用更加迅速和完全。但是超过最大效应剂量之后,再加大剂量也不会产生进一步的拮抗作用。对新斯的明来说,最大剂量在60~80μg/kg之间。Donati等[19]研究了筒箭毒碱90%阻滞麻醉的恢复情况,证明了新斯的明的剂量与恢复速度的关系,发现新斯的明由5μg/kg增加到50μg/kg时,早期其拮抗作用不断增强,但后期50μg/kg的新斯的明,肌肉颤搐值只达到正常的80%。另临床过量应用新斯的明可能会导致“胆碱能危象”。表现为大汗、瞳孔缩小、前额痛、激动不安、心动过缓、低血压、肌肉震颤、心悸、支气管收缩伴分泌增加、喘鸣等。最后肌无力加重、大小便失禁、惊厥、昏迷,严重者可因心跳停止、中枢性呼吸麻痹和肺水肿而死亡。综合考虑新斯的明在拮抗银环蛇毒所致肌无力时,其浓度并非越高越好,所以寻找更为合适的新斯的明的浓度可以成为以后研究的新方向。
本实验结果提示新斯的明拮抗银环蛇毒所致膈肌无力的作用明确,且疗效与剂量有相关性。但有关新斯的明拮抗银环蛇毒所致膈肌无力的时机、疗程等实际临床效应,尚需更多的研究论证。
[1]Warrell,David A.Guidelines for the management of snakebites[M].WHO Library Cataloguing-in-Publication data,2010:106-107.[2]Anil A,Singh S,Bhalla A,et al.Role of neostigmine and polyvalent antivenom in Indian common krait(Bungarus caeruleus)bite[J].J Infect Public Health,2010,3(2):83-87.
[3]Plomp JJ,van Kempen GT,Molenaar PC.Adaptation of quantal content to decreased postsynaptic sensitivity at single endplates in α-Bungarotoxin-treated rats[J].Journal of Physiology,1992,458:487-499.
[4]Nirthanan S,Charpantier E,Gopalakrishnakone P,et al.Effects of candoxin,a novel toxin from the venom of the Malayan krait(Bungarus candidus)[J].British Journal of Pharmacology,2003,139(4):832-844.
[5]Grishin SN,Teplov AY,Galkin AV,et al.Different effects of ATP on the contractile activity of mice diaphragmatic skeletal muscles[J].Neurochemistry International,2006,49(8):756-763.
[6] Koh DC,Armugam A,Jeyaseelan K.Snake venorn components and their applications in biomedicine[J].Cell Mol Life SCi,2006,63(4):3030-3041.
[7]吴红棉,刘洁生,陈式楞.阻断神经节烟碱乙酰胆碱传递的P-银环蛇毒[J].暨南大学学报(自然科学版),1994,15(3):137-141.
[8]Aird SD,Womble GC,Yates JR,et al.Primary structure of Gamma-bungarotoxin,a new postsynaptic neurotoxin from venom of Bungarus multicinctus[J].Toxicon,1999,37(4):609-625.
[9] Qian YC,Fan CY,Gong Y,et al.cDNA cloning and sequence analysis of six neuro-toxin-like proteins from Chinese continental banded kraft[J].Biochemistry and MolBiolInt,1998,46(4):821-828.
[10] Rowan EG.What does beta-bungarotoxin do at the neuromuscular junction[J]?Toxicon,2001,39(1):107-18.
[11] Dellisanti CD,Yao Y,Stroud JC,et al.Structural determinants for alpha-neurotoxin sensitivity in muscle nAChR and their implications for the gating mechanism[J].Channels(Austin),2007,1(4):234-237.
[12]蓝 海,陈远聪.中国毒蛇及蛇伤救治[M].上海:上海科学技术出版社,2008:191-204.
[13] Sauer M,Stahn A,Soltesz S,et al.The influence of residual neuromuscular block on the incidence of critical respiratory events.A randomised,prospective,placebocontrolled trial[J].Eur J Anaesthesiol,2011,28(12):842-848.
[14]Haines SR,Thurtell MJ.Treatment of ocular myasthenia gravis.[J].Curr Treat Options Neurol,2012,14(1):103-112.
[15]Fuchs-Buder T,Baumann C,De Guis J,et al.Low-dose neostigmine to antagonise shallow atracurium neuromuscular block during inhalational anaesthesia:A prospective randomised controlled trial[J].Eur J Anaesthesiol,2013,30(10):594-598.
[16]李颖芬,欧阳葆怡,冉 建.新斯的明拮抗顺阿曲库铵肌松效应时机分析[J].广东医学,2010,31(15):2022-2024.
[17]郑则广,陈荣昌,王 鑫,等.递增呼气相阻力的呼吸应答及其对人机同步的影响[J].中华生物医学工程杂志,2008,14(1):22-26.
[18]曾因明,邓小明,译.米勒麻醉学(第6版)[M].北京:北京大学医学出版社,2006:888.
[19]Donati F,Mccarroll SM,Antzaka C,et al.Does-response curves for edrophonium,neostigmine,and pyridostigmine after pancuronium and d-tubocurarine[J].Anesthesiology,1987,66(4):471-476.
