新西兰白兔股静脉局部单纯注射脂多糖构建股静脉血栓形成模型的实验研究
2015-01-08邓方阁周大治吴贤生周志彪
邓方阁 王 静 周大治 江 梅 郑 侠 吴贤生 黄 威 周志彪
(1广州医科大学附属第一医院广州呼吸疾病研究所呼吸疾病国家重点实验室,广东广州510120;2广州医科大学临床医学2010级南山班,广东 广州510120;3广州医科大学附属第一医院超声科,广东广州510120;4广东省医学实验动物中心,广东佛山528248)
深静脉血栓形成(deep venous thrombosis,DVT)是最为常见和最为重要的一类具有潜在致死性疾病,预计发病率为每年0.6‰[1],美国每年诊断DVT病例超过100万[2],各种疾病死亡患者中,有DVT者占尸检的72%[3]。经典理论认为DVT形成的三要素为:血流缓慢、血管壁损伤、血液高凝状态[4]。然而,近年研究发现感染和炎症是诱发血栓性疾病急性发作的重要危险因素[5]。因此,本文通过对新西兰白兔股静脉局部单纯注射脂多糖来构建股静脉血栓形成,进一步证实炎症在静脉血栓形成中的作用。
1 材料与方法
1.1 实验动物
普通级健康新西兰大白兔共9只,均为雄性,体质量约2.0~2.5 kg,由广东省医学实验动物中心提供,单笼饲养,饲养期间给兔颗粒饲料,自由饮水,术前适应性饲养2周。
所有实验兔(9只)均采用自身对照研究,均以左侧股静脉为实验组,右侧股静脉为对照组。实验组除分离股静脉外,还在股静脉单纯注射脂多糖稀释液;而对照组则只进行股静脉分离,不注射脂多糖稀释液。此外,根据兔是否固定外科小夹板,分为小夹板固定组(5只)和非固定组(4只)两个亚组。
1.2 模型制备
3%戊巴比妥钠按1 mL/kg沿耳缘静脉注射,兔全麻麻醉后仰卧位固定,股三角区和腹股沟区剃毛暴露表皮,在一侧腹股沟下方沿股动脉搏动最强处作一自内上至外下的一长约3 cm的斜形切口,逐层切开皮肤并纯性分离腹外斜肌,游离股动脉、股静脉和股神经,显微血管夹局部横行完全阻滞股静脉近心端血流。取0.1 mL的脂多糖稀释液(Sigma,终浓度为50μg/mL)注入血管夹阻滞的股静脉内;再继续留观30 min后,去血管夹,逐层缝合皮肤,5只兔用小夹板固定,4只兔放回笼中,继续饲养72 h。模型制备后每天继续观察实验兔的一般状态并记录。另一侧为对照侧即只进行手术切开、分离股血管和缝合表皮。72 h后进行血管加压超声检测血栓形成,检测结束后,戊巴比妥钠处死实验兔,并对双侧股静脉迅速取材进行病理学检测。
1.3 病理学检查
每天观察兔体表大体形态变化。在术后72 h,在血管加压超声检测结束后,处死实验兔,并迅速取双侧实验段股静脉,4%多聚甲醛固定,HE染色,进行病理学检测。
1.4 统计学分析
所有数据均用SPSS 13.0处理,计数资料采用率表示,固定组和非固定组血栓形成模型成功率的比较用Fisher’s Exact test检验,当P<0.05认为差异没有统计学意义。
2 结果
2.1 一般状态观察
8只兔存活,固定组1只兔于60h后死于双侧DVT、肺栓塞;实验兔的精神状态尚可,固定组实验兔下肢活动受限,非固定组实验兔活动自由,所有兔均未见明显的皮肤颜色变化和肿胀。
2.2 血管加压超声检测
8只兔的实验侧股静脉均见血栓形成,而对照侧均未见明显血栓形成;1只兔的实验侧和对照侧的股静脉均未见明显血栓形成。
2.3 病理学检查
病理学HE染色显示所有兔的实验侧股静脉管壁均有不同程度的增厚和炎细胞浸润,除固定组1只兔未形成血栓形成外,8只兔实验侧均可见明显的血栓形成。而对照侧股静脉仅部分血管管壁轻度增厚,但均未见血栓形成及炎细胞浸润,见图1。
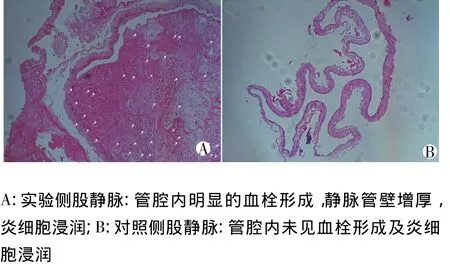
图1 股静脉的病理检测(HE染色 ×100)
2.4 固定组和非固定组血栓形成模型成功率的比较
固定组5只兔中有4只有血栓形成(80%),非固定组4只兔均有血栓形成(100%),两组相比,P=1.000,差异没有统计学意义。
3 讨论
与动脉硬化性疾病相似,静脉血栓形成也是一种炎症反应过程。血栓与炎症反应密切相关,并形成级联放大效应,尤其是血栓与炎症急性期反应相关[6-7]。炎症反应过程中多种炎症介质导致血管扩张、血管通透性增高;白细胞募集、活化以及发热、疼痛、组织损伤等病理生理变化,最终引起血管内皮损伤[6-7]。血管内皮损伤是静脉血栓形成的重要条件之一。内皮细胞损伤暴露出内皮下的胶原,激活血小板和凝血因子XII,启动了内源性凝血过程;内皮细胞本身具有促血凝作用,能合成组织因子,存在于内皮细胞内,当内皮细胞损伤时得以释出激活凝血因子VII,从而启动了外源性凝血过程。
脂多糖是革兰氏阴性菌细胞壁的重要组成成分,是存在于细菌、衣原体等上的致炎活性成分,脂多糖的释放可诱发炎症反应,并导致血管内皮损伤[8]。脂多糖可刺激血管内皮细胞释放黏附因子趋化炎细胞,促进单核细胞合成和释放白细胞介素 1、白细胞介素 6 和肿瘤坏死因子 α 等[8-9],这些炎性因子诱导组织因子表达,相互作用,导致病理性血栓形成。股静脉栓塞模型制作通常采用结扎股静脉、注射凝血酶或骨折等方式造模,而本实验仅仅是通过在实验侧单纯注射脂多糖即形成明显栓塞,证实炎症在栓塞形成中的作用。此外,本实验采用自身对照,对所有兔的双侧股静脉均进行了手术,主要是为了排除因手术操作可能导致炎症对实验的影响。
内科疾患长期卧床者、制动、手术后等因素是诱发DVT形成的高危因素,因此,本实验又分为固定和非固定2个亚组,然而,在本实验中,2组间并无明显差异,这主要是由于设置夹板固定和非固定组的样本量偏小,只能进一步说明炎症是致使血栓形成的最直接原因,还尚不能得出是否夹板固定导致的制动是高危因素的结论,这也是本实验的局限性,还需加大样本量进行深一步的研究。
[1]Kreidy R,Irani-Hakime N.Is thrombophilia a major risk factor for deep vein thrombosis of the lower extremities among Lebanese patients[J].Vasc Health Risk Manag,2009,5:627-633.
[2]de Oliveira A,França GJ,Vidal EA,et al.Duplex scan in patients with clinical suspicion of deep venous thrombosis[J].Cardiovasc Ultrasound,2008,6:53.
[3] Aqulia AM.Deep Venous thrombosis[J].J Cardiovasc Nurs,2001,15(4):25-44.
[4]Torbicki A,Perrier A,Konstantinides S,et al.Guidelines on the diagnosis and management of acute pulmonary embolism:the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology(ESC)[J].Eur Heart J,2008,29(18):2276-315.
[5]Pussinen PJ,Tuomisto K,Jousilahti P,et al.Endotoxemia,immune response to periodontal pathogens,and systemic inflammation associate with incident cardiovascular disease events[J].Arterioscl Thromb Vascul Biol,2007,27(6):1433-1439.
[6]Hald EM,Brakkan SK,Mathiesen EB,et al.Highsensitivity C-reactive protein is not a risk factor for venous thromboembolism:the Tromso study[J].Haematologica,2011,96(8):1189-1194.
[7] Folsom AR,Lutsey PL,Astor BC,et al.C-reactive protein and venous thromboembolism:a prospective investigation in the ARIC cohort[J].Thromb Haemost,2009,102(4):615-619.
[8]Juskewitch JE,Knudsen BE,Platt JL,et al.Systemic inflammation is driven by parenchymal cell activation and exclusively predicted by early MCP-1 plasma levels[J].Am JPathol,2012,180(1):32-40.
[9]Seehase S,Lauenstein HD,Schlumbohm C,et al.LPS-induced lung inflammation in marmoset monkeys-an acute model for anti-inflammatory drug testing[J].PLUS One,2012,7(8):e43709.
