氮素对印楝愈伤组织和悬浮细胞培养的影响
2015-01-08韩广建李兴林别振宇张国运
韩广建,李兴林,别振宇,张国运
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
印楝(Azadirachta indica A.Juss),楝科楝属植物,生长于印巴次大陆,内含多种生物活性物质,其中,活性最强的是印楝素[1].印楝素,四环三萜类化合物,属于柠檬苦素类物质,主要存在于印楝种仁中,具有广泛的生物杀虫效果.由于种仁的生产力有限,人们通过植物组织培养的技术对印楝素进行大规模生产.影响印楝组织培养的因素有很多[2-3],比如碳素、氮素、激素、溶氧量等.
氮素对植物生理代谢和生长有重要作用.印楝细胞中氮素含量的多少及氮素的存在形式都直接影响着印楝组织的生长和代谢产物的积累.氮素主要以硝态氮(-N)和铵态氮(-N)的形式被植物直接吸收和利用[4-5].在印楝的组织培养研究中,Prakash 等[6]指出,仅以硝态氮为氮素时,培养物有较高的细胞生长(7.1,g/L)和印楝素积累(每克细胞1.76,mg,每升培养物12.49,mg),而高铵态氮对细胞生长和印楝素形成有抑制作用.但是,同时以硝态氮和铵态氮为氮素时,有利于印楝素在胞内胞外积累的有效分配.Sujanya 等[7]研究表明,以MS 培养基[8]为基准,在其他成分及浓度相同条件下,当硝态氮与铵态氮的物质的量比为4∶1 时,印楝素从胞内几乎完全转移到了胞外.然而,作者对产生这种结果的机理没有探讨.众所周知,可溶性蛋白是植物中酶的重要组成部分,其直接或间接影响着植物生长代谢活动,是重要的生理生化指标之一.基于此,本文旨在探讨不同氮素对印楝愈伤组织和悬浮细胞培养的影响,主要通过考察细胞中生物量、可溶性蛋白、印楝素以及柠檬苦素类物质(AZRL)含量筛选最佳氮素,为利用细胞工程手段生产印楝素提供参考依据.
1 材料与方法
1.1 印楝来源
印楝种子购于云南天宇种子公司,种植于天津科技大学泰达校区.印楝幼叶采摘于印楝种子萌发生长两年后的幼株.
1.2 主要试剂及仪器
印楝素标准品,美国Sigma 公司;柠檬苦素标准品,上海纯优生物科技有限公司;考马斯亮蓝G-250、牛血清白蛋白(BSA)标准品,上海索莱宝生物科技有限公司.
TDL-40B 型离心机,上海安亭科学仪器厂;TU-1810 型紫外-可见光分光光度计,北京普析通用仪器有限责任公司;Agilent 1200 型高效液相色谱仪,安捷伦科技有限公司.
1.3 印楝愈伤组织的诱导
取幼嫩的叶片作为外植体,在流动自来水下冲洗3~5,h.然后将外植体移至无菌超净台上,用2%,的NaClO 浸泡消毒约10,min,无菌蒸馏水冲洗3 次,再用75%,酒精消毒3 次,每次30,s,并且每次酒精消毒后均用无菌蒸馏水冲洗3 次.继之,用无菌滤纸将外植体(幼叶)表面上的水珠吸干净,并将叶片的锯齿状边缘部分以及叶柄去除,之后再切割成约1,cm2的小块,分别转接到含有蔗糖3%,、琼脂0.65%,的MS[8]+NAA(1.0,mg/L)+6-BA(3.0,mg/L)、MS+NAA(1.0,mg/L)+6-BA(3.0,mg/L)+KNO3(1.99,g/L)、MS+NAA(1.0,mg/L)+6-BA(3.0,mg/L)+KNO3(3.98,g/L)固体培养基上,在(25±2)℃下进行黑暗培养[9].经20,d 后,分别将上述3 种愈伤组织在相应的培养基上进行继代培养.
1.4 印楝细胞培养的建立
在氮素的物质的量比不同的培养基上,分别取第3 次继代培养的浅黄松散愈伤组织适量,在无菌条件下切碎,称取 5,g(以鲜质量计),相应地转接到100,mL 含有3%,蔗糖的MS+NAA(1.0,mg/L)+6-BA(3.0,mg/L)、MS+NAA(1.0,mg/L)+6-BA(3.0,mg/L)+KNO3(1.99,g/L)、MS+NAA1.0,mg/L)+6-BA(3.0,mg/L)+KNO3(3.98,g/L)液体培养液中.然后在(25±2)℃、转速125,r/min、光/暗周期8,h/16,h[7]的条件下进行振荡培养.每隔12,d 继代培养1 次,继代培养接种量为30%,.
1.5 测定方法
1.5.1 印楝细胞生物量的测定
参考Raval 等[10]描述的生物量测定方法.将细胞悬浮液3,000,r/min 离心20,min,收集离心沉淀物,放入预称量的铝盘中称质量,与接种量相比,二者之差即为细胞鲜质量.然后对鲜细胞进行60,℃干燥至质量恒定,即为细胞干质量.
1.5.2 可溶性蛋白含量的测定[11-12]
最大吸收波长扫描:精确称取牛血清白蛋白(BSA)标准品0.020,0,g,用蒸馏水定容至100,mL,即得200,µg/mL 的BSA 标准溶液.然后分别量取BSA标准溶液 0.0、0.2、0.4、0.6,mL,用蒸馏水补充至1.0,mL,并加5,mL 的考马斯亮蓝G-250 溶液,充分混匀后静置5,min,然后在400~600,nm 波长范围内扫描.结果在590,nm 处呈现最大吸收峰.
可溶性蛋白含量标准曲线的确定:分别量取0.0、0.2、0.4、0.6、0.8、1.0,mL BSA 标准溶液于6 支10,mL 试管中,并用蒸馏水补充至1.0,mL.然后向各试管中加入5,mL 考马斯亮蓝G-250 溶液,混匀后静置5,min,在590,nm 波长处测定其吸光度.以吸光度对可溶性蛋白含量做回归处理,得到回归方程y=0.995,1,x+0.099,7,R2=0.993,6.
样品液的制备:称取印楝组织或细胞鲜样0.5,g,加入3,mL 磷酸缓冲液(PBS)和适量石英砂,冰浴研磨后移入10,mL 离心管中,再用5,mL pH 7.8 缓冲液冲洗,一并转入10,mL 离心管中,于4,℃、12,000g离心15,min,收集上清液即为可溶性蛋白质提取液,4,℃冰箱保存备用.
样品液中可溶性蛋白含量的测定:取上述提取液1.0,mL,加5,mL 的考马斯亮蓝G-250 溶液,在旋涡混合器上混合处理,静置5,min,在590,nm 处测定吸光度.结合回归方程和式(1)计算出鲜样中可溶性蛋白质含量(mg/g).
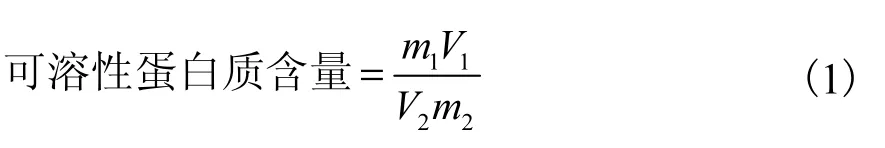
式中:m1为查标准曲线所得的每管可溶性蛋白的质量,mg;V1为提取液总体积,mL;V2为测定所提取液体积,mL;m2为取样量,g.
1.5.3 印楝素含量的测定[13]
印楝素标准曲线的确定:精确称取印楝素标准品0.002,0,g,用色谱纯甲醇定容至 10,mL,即得0.2,mg/mL 的印楝素标准溶液.然后分别量取印楝素标准溶液0.0、0.2、0.4、0.6、0.8、1.0,mL,用色谱纯甲醇补充至1.0,mL,过膜(0.22,µm)后用高效液相色谱仪进行测定.以吸收峰面积对印楝素含量做回归处理,得到回归方程y=1.611,x+62.231,R2=0.991,3.依据回归方程可计算样品中印楝素的含量.
印楝素高效液相测定条件:固定相为C18 柱(250,mm×4.6,mm,45,℃),流动相为甲醇与水(体积比为55∶45),流量1.0,mL/min,检测波长217,nm,出峰时间约为4.8,min.
样品中印楝素含量的测定:称取1.0,g(以干质量计)愈伤组织(或悬浮细胞),浸泡于10,mL 甲醇中进行提取,并按体积比60∶40 的比例向甲醇提取液中添加无菌蒸馏水,然后用与甲醇提取液体积相同的二氯甲烷萃取15,min,萃取两次,合并两次萃取液,之后进行40,℃真空旋转蒸发.旋转蒸发后的产物用5,mL 色谱纯甲醇重溶并过膜(0.22,µm),运用高效液相色谱(HPLC)法进行印楝素含量测定.由回归方程计算样品溶液中印楝素的含量.
1.5.4 柠檬苦素含量的测定
柠檬苦素标准曲线的确定:精确称取柠檬苦素标准品5.00,mg 置于50,mL 容量瓶中,用二氯甲烷定容,即得0.1,mg/mL 的柠檬苦素标准溶液.分别量取0.0、0.3、0.5、0.7、0.9、1.1、1.4,mL 标准溶液置于7 支10,mL 试管中,用二氯甲烷分别定容至1.4,mL;加入0.02,g/mL 香草醛甲醇溶液0.4,mL,混匀后室温放置2,min;添加0.6,mL 浓硫酸,并迅速振荡10,s,再加入1.4,mL 的甲醇溶液;静置10,min 后于579,nm 处测定其吸光度.以吸光度对柠檬苦素含量做回归处理,得到回归方程 y=2.696,5,x-0.120,4,R2=0.993,0.依据回归方程计算样品中柠檬苦素的含量.
样品中柠檬苦素含量的测定[14]:将印楝组织在40,℃下烘干至质量恒定;称取样品0.15,g(以干质量计),浸泡于10,mL 甲醇中进行提取,并按体积比60∶40 的比例向甲醇提取液中添加无菌蒸馏水,然后用与甲醇提取液体积相同的二氯甲烷萃取15,min,萃取两次,合并两次萃取液,之后进行40,℃真空旋转蒸发.旋转蒸发后的产物用5,mL 二氯甲烷重溶,即得样液.取1.4,mL 样液于试管中,加入0.02,g/mL 香草醛甲醇溶液0.4,mL,混匀后室温静置2,min;然后加入 0.6,mL 浓硫酸,并迅速振荡10,s;再加入1.4,mL 的甲醇溶液,以二氯甲烷作为空白对照,测定其吸光度.由回归方程计算样品溶液中柠檬苦素的含量.
1.5.5 数据处理
通过Excel 和SPSS 软件对实验数据进行统计检验和显著性分析.
2 结果与讨论
2.1 氮素对生物量的影响
硝态氮与铵态氮物质的量比对生物量的影响见表1.在3 种不同的硝态氮与铵态氮物质的量比下,印楝愈伤组织和悬浮细胞中的生物量均随硝态氮与铵态氮物质的量比的增加而增加,并在硝态氮与铵态氮物质的量比为4∶1 时达到最大,分别为35.85,g/L和92.13,g/L.硝态氮含量增加的同时培养系统中的氮素含量也增加,而氮素的增加有利于生物量的增加.这与Rodrigues 等[15]所报道高氮素增加了生物量的结果相同.

表1 硝态氮与铵态氮物质的量比对生物量的影响(n=3)Tab.1 Effect of the ratio of nitrate to ammonium on the biomass of Azadirachta indica A.Juss (n=3)
同时,由表1 也可以看出:在3 种不同硝态氮与铵态氮物质的量比的情况下,悬浮细胞的生物量两两间有显著性差异;但是愈伤组织的生物量,在硝态氮与铵态氮物质的量比为2∶1 和3∶1 时没有显著性差异.这可能是由于印楝细胞呈悬浮状态时,有利于细胞对氧的吸收,有利于细胞的新陈代谢,从而有利于细胞的生长.溶氧量对细胞生物量的影响在多种文献中[15-16]也有报道.
2.2 氮素对可溶性蛋白含量的影响
如表2 所示,在3 种不同的硝态氮与铵态氮物质的量比下,印楝愈伤组织中的可溶性蛋白含量随硝态氮与铵态氮物质的量比的增加而增加,在硝态氮与铵态氮物质的量比为4∶1 时达到最大(12.67,mg/g),但在硝态氮与铵态氮物质的量比为3∶1 和4∶1 时,二者的可溶性蛋白含量几乎相同,并没有显著性差异.
印楝悬浮细胞中的可溶性蛋白随硝态氮与铵态氮物质的量比的增加而先升高再降低,在硝态氮与铵态氮物质的量比为3∶1 时达到最大(10.18,mg/g).并且,在硝态氮与铵态氮物质的量比为4∶1 的悬浮细胞中的可溶性蛋白比2∶1 的少,但也没有显著性差异.

表2 硝态氮与铵态氮物质的量比对可溶性蛋白含量的影响(n=3)Tab.2 Effect of the ratio of nitrate to ammonium on soluble protein content of Azadirachta indica A.Juss(n=3)
可溶性蛋白质是植物所有蛋白质组分中最活跃的一部分,包括各种酶源、酶分子和代谢调节物[17].硝酸盐含量的增加,可能刺激了印楝愈伤组织中代谢酶的活性,从而使得硝态氮与铵态氮物质的量比为3∶1 和4∶1 的愈伤组织中可溶性蛋白含量提高.但是,同种植物不同组织的生物特性也不尽相同,因此,即使都是由幼叶产生的在相同氮素比例下的愈伤组织和悬浮细胞,二者中的可溶性蛋白变化趋势不同,含量也不同.
2.3 氮素对印楝素含量的影响
在3 种不同的硝态氮与铵态氮物质的量比下,印楝愈伤组织中的印楝素含量随硝态氮与铵态氮物质的量比的增加而增加,并在硝态氮与铵态氮物质的量比为4∶1 时达到最大(37.55,µg/g,以鲜质量计),硝态氮的增加提高了代谢物印楝素的含量(表3),这与Prakash 等[6]所报道的硝酸盐有利于印楝素的积累结果相似.但是,印楝悬浮细胞中的印楝素含量却是随着硝态氮与铵态氮物质的量比的增加而先升高再降低,在硝态氮与铵态氮物质的量比为3∶1 时达到最大(35.61,µg/g,以鲜质量计),这与Sujanya 等[7]所报道的当硝态氮与铵态氮物质的量比为3∶1 时胞内印楝素含量达到最大的结果相近.
由印楝素在愈伤组织中的递增变化以及在悬浮细胞中先增后减的变化结果可以看出,相同的诱导源,不同的印楝组织细胞,其生理特性也不同.这与Kumar 等[18-19]所报道的生理特性和环境因素影响印楝组织中的印楝素含量结果相一致.

表3 硝态氮与铵态氮物质的量比对印楝素含量的影响(n=3)Tab.3 Effect of the ratio of nitrate to ammonium on azadirachtin content of of Azadirachta indica A.Juss (n=3)
2.4 氮素对柠檬苦素含量的影响
如表4 所示,在3 种不同的硝态氮与铵态氮物质的量比下,印楝愈伤组织中的柠檬苦素含量随硝态氮与铵态氮物质的量比的增加而增加,并在硝态氮与铵态氮物质的量比为4∶1 时达到最大(116.10,µg/g,以鲜质量计),而在悬浮细胞中的柠檬苦素含量却随着硝态氮与铵态氮物质的量比的增加而先升高再降低,在硝态氮与铵态氮物质的量比为3∶1 时达到最大(123.20,µg/g,以鲜质量计).但是,无论在愈伤组织中还是在悬浮细胞中,印楝素含量与柠檬苦素含量表现出同样的变化趋势,并且在各个不同的硝态氮与铵态氮物质的量比下,印楝素含量总保持低于柠檬苦素含量水平,并呈正相关,这由印楝素属于一种柠檬苦素类物质[20]的性质决定.

表4 硝态氮与铵态氮物质的量比对柠檬苦素含量的影响(n=3)Tab.4 Effect of the ratio of nitrate to ammonium on limonoid content of of Azadirachta indica A.Juss(n=3)
尽管培养物中可溶性蛋白含量与印楝素和柠檬苦素含量的变化趋势相同,但同样的可溶性蛋白含量,在愈伤组织和悬浮细胞中却表现出不同的变化趋势.在愈伤组织中表现出递增趋势,而在悬浮细胞中表现出先升后降的趋势,这可能与其组织中相关代谢酶的活性变化有关[21].
3 结论
[1]Prakash G,Bhojwani S S,Srivastava A K.Production of azadirachtin from plant tissue culture:State of the art and future prospects[J].Biotechnology and Bioprocess Engineering,2002,7(4):185-193.
[2]杨国荣.印楝固体组织培养条件及对印楝素含量的影响[D].北京:中国农业大学,2005.
[3]Plata N,Islam I K,Jayram S.Effect of methyl jasmonate and pcoumaric acid on anthocyanin composition in a sweet potato cell suspension culture[J].Biochemical Engineering Journal,2003,14(3):171-177.
[4]曹翠玲,李生秀,苗芳.氮素对植物某些生理生化过程影响的研究进展[J].西北农业大学学报,1999,27(4):96-101.
[5]Malagoli M,Canal A D,Quaggiotti S.Differences in nitrate and ammonium uptake between Scots pine and European larch[J].Plant and Soil,2000,221:1-3.
[6]Prakash G,Srivastava A K.Statistical media optimization for cell growth and azadirachtin production in Azadirachta indica(A.Juss)suspension cultures[J].Process Biochemistry,2005,40(12):3795-3800.
[7]Sujanya S,Debi B P,Sai I.In vitro production of azadirachtin from cell suspension cultures of Azadirachta indica[J].Journal of Bioscience and Bioengineering,2008,33(1):113-120.
[8]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Physiologia Plantarum,1962,15(3):473-497.
[9]Singh M,Chaturvedi R.Statistical optimization of media for enhanced azadirachtin production from redifferentiated zygotic embryo cultures of neem(Azadirachta indica A.Juss.)[J].In Vitro Cellular &Developmental Biology Plant,2012,48(1):92-98.
[10]Raval K N,Hellwig S,Prakash G,et al.Necessity of a two-stage process for the production of azadirachtinrelated limonoids in suspension cultures of Azadirachta indica[J].Journal of Bioscience and Bioengineering,2003,96(1):16-22.
[11]邓丽莉,潘晓倩,生吉萍,等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J].食品科学,2012,33(24):185-189.
[12]古炳明,曾宝,熊艺花,等.紫外-可见分光光度法测定巴豆中可溶性蛋白的含量[J].医学研究杂志,2013,42(8):43-45.
[13]Srivastava S,Srivastava A K.In vitro azadirachtin production by hairy root cultivation of Azadirachta indica in nutrient mist bioreactor[J].Applied Biochemistry and Biotechnology,2012,166:365-378.
[14]Yaylayan V A,Dai Jianming,Raghavan G S V.Extraction and colorimetric determination of azadirachtinrelated limonoids in neem seed kernel[J].Journal of Agricultural and Food Chemistry,1999,47(1):3738-3742.
[15]Rodrigues M,Festucci-Buselli R A,Silva L C.Azadirachtin biosynthesis induction in Azadirachta indica A.Juss cotyledonary calli with elicitor agents[J].Brazilian Archives of Biology and Technology,2014,57(2):155-162.
[16]Prakash G,Srivastava A K.Azadirachtin production in stirred tank reactors by Azadirachta indica suspension culture[J].Process Biochemistry,2007,(42):93-97.
[17]蔡柏岩,葛菁萍,祖伟.施磷水平对不同基因型大豆叶片及子粒可溶性蛋白含量的影响[J].植物营养与肥料学报,2007,13(6):1185-1188.
[18]Kumar J,Parmar B S.Neem oil content and its key chemical constituents in relation to the agroclimatic factors and regions of India[J].Pestic Res,1997(9):216-225.
[19]de Carvalho D C,da Silva A L L,Schuck M R.Fox grape cv.Bordô(Vitis labrusca L.)and grapevine cv.Chardonnay(Vitis vinifera L.)cultivated in vitro under different carbohydrates,amino acids and 6-Benzylaminopurine levels [J].Brazilian Archives of Biology and Technology,2013,56 (2):191-201.
[20]Siddiqui S,Siddiqui B S,Faizi S.Tetracyclic triterpenoids and their derivatives from Azadirachta indica[J].Journal of Natural Products,1988,51(1):30-43.
[21]王凌健,方欣,杨长青,等.植物萜类次生代谢及其调控植物萜类次生代谢及其调控[J].中国科学:生命科学,2013,43(12):1030-1046.
