基于近红外光谱法的枳实含量测定
2015-01-08雷敬卫樊明月谢彩侠张迪文
雷敬卫,樊明月,2,白 雁*,谢彩侠,张迪文
1河南中医学院,郑州 450046;2 新乡市第二人民医院,新乡 453002
枳实为芸香科植物酸橙Citrus aurantium L.及其栽培变种或甜橙C.sinensis Osbeck 的干燥幼果,5~6 月果实自落后采集,除去杂质,从中部横切为两半,低温干燥或晒干。枳实味苦、辛、酸,温,归脾、胃、大肠经,辛行苦降,破气除痞,消积导滞,化痰,是中医上常用的中药之一。2010 版《中国药典》对枳实的质量控制做出了明确的规定,其辛弗林的含量不得少于0.30%,醇浸出物不得少于12.0%。由于枳实中辛弗林、醇浸出物含量的高低影响枳实药材的质量,故控制其两者的含量对评价枳实质量有重要的意义。虽然HPLC、热浸法测定结果准确可靠,但实验操作繁琐,其过程费时费力,难以满足制药过程中对原药材的快速检测。
近红外光谱分析技术作为一种快速无损的绿色分析技术,具有快速分析样品、处理简单、无需试剂消耗等特点[1,2],目前已用于药效成分的含量测定[3]、中药纯化过程分析[4]、天然药物鉴别[5,6]和药材的快速模式识别[7,8]等。这种快速分析检测技术是最有希望应用于中药的工业化生产中。本研究以枳实为研究对象,采用近红外漫反射光谱技术结合PLS 建立了枳实中辛弗林、醇浸出物的定量分析模型,为大批量枳实的含量测定提供一种新的方法,同时也为枳实的快速评价与在线检测提供参考和依据。
1 材料与仪器
1.1 样品来源
101 份枳实药材由河南某药厂提供,由河南中医学院董诚明教授鉴定为芸香科植物酸橙Citrus aurantium L.栽培变种的干燥幼果。
1.2 仪器
Nicolet 6700 型傅立叶变换近红外光谱仪(配有InGaAs 检测器、外接积分球、样品旋转器、OMNIC 光谱采集软件和TQ Analyst8 分析软件,美国Thermo Nicolet 公司),Agilent1200 型高效液相色谱仪(美国安捷伦科技公司),AE240 十万分之一精密天平、AL204 型分析天平(瑞士梅特勒-托利多仪器有限公司),KQ-500DE 数控超声波清洗器(昆山市超声仪器有限公司),Milli-Q Academic A10 超纯水机(美国Millipore 公司),FW-100 高速万能粉碎机、101-3AB电热鼓风干燥箱、DZKW-4 电子恒温水浴锅(北京中兴伟业仪器有限公司)。
1.3 试剂
辛弗林对照品(批号:110727-201107)购自中国食品药品检定研究院,甲醇(色谱纯,TEDIA),甲醇(天津市四友精细化学品有限公司),磷酸二氢钾、十二烷基磺酸钠、冰乙酸(天津市登科化学试剂有限公司),无水乙醇(天津市富宇精细化工有限公司),聚酰胺(浙江省台州市路桥四甲生化塑料出品),超纯水,蒸馏水。
2 方法与结果
2.1 近红外光谱的采集
取上述101 份样品适量,粉碎,过65 目筛,取约5 g 粉末装入石英杯,混合均匀,依以下条件进行扫描,采集光谱图。测样方式:积分球漫反射;分辨率8 cm-1;扫描次数64 次;扫描范围12000~4000 cm-1;温度25~30℃;相对湿度25%~35%。每个样品重复扫描3 次,计算平均光谱以建立模型,101份样品的近红外光谱叠加图见图1。

图1 101 份枳实的NIR 原始光谱叠加图Fig.1 Overlaid NIRS spectra of 101 C.aurantium samples
由图1 可知每份样品的近红外原始图谱基本一致,且谱带相互重叠,仅单单根据此图无法确定枳实中各指标性成分的含量与吸光度之间的相关性,故必须通过化学计量学方法建立其定量分析模型,才能确定枳实中各指标性成分的含量与其近红外光谱图之间的关系。
2.2 参考值的测定
2.2.1 辛弗林的含量测定
按照2010 年版《中国药典》一部中枳实项下辛弗林的HPLC 含量测定方法进行测定。取枳实粉末约1 g,精密称定,置具塞锥形瓶中,加甲醇50 mL,称定重量,加热回流1.5 h,放冷,再称定重量,用甲醇补足,滤过,精密量取10 mL,蒸干,残渣加水10 mL 溶解,通过聚酰胺柱(2.5 g,内径1.5 cm),用水25 mL 洗脱,收集洗脱液,转移至25 mL 量瓶中,加水至刻度,摇匀,即得。
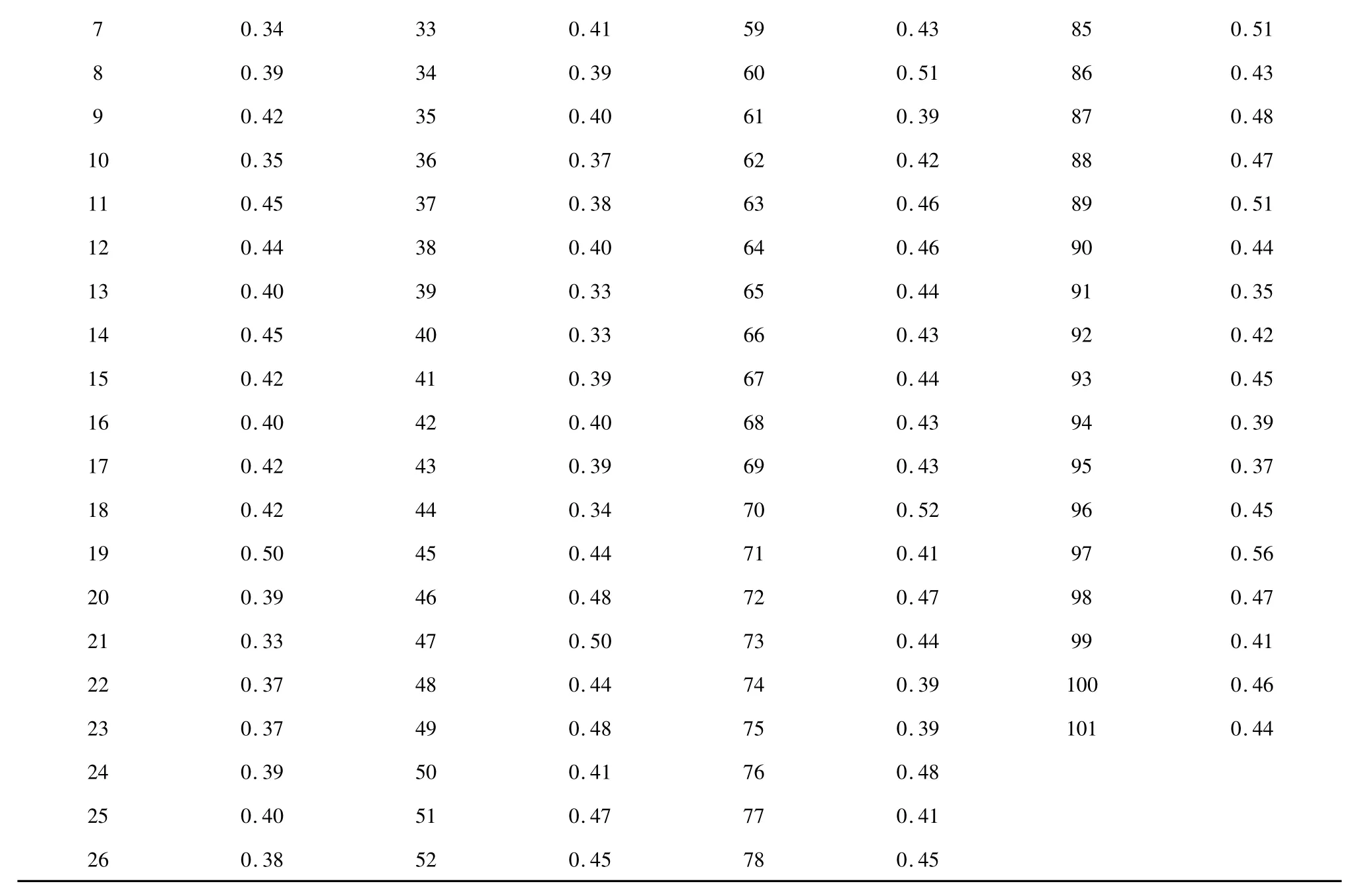
色谱条件:Diamonsil ® C18(5 μm,4.6 mm ×200 mm)色谱柱,以甲醇:磷酸二氢钾溶液(磷酸二氢钾0.6 g,十二烷基磺酸钠1.0 g,冰醋酸1 mL,稀释至1000 mL)50∶50 为流动相,柱温30 ℃,进样量10 μL,流速1.0 mL/min,检测波长275 nm。每份样品平行测定两次,计算平均值,并以其作为参考值。以干燥品计算供试品中辛弗林的含量(%),101 份样品的辛弗林含量为0.33%~0.56%。结果见表1。

表1 枳实中辛弗林的含量测定结果Table 1 Content determination results of synephrine in C.aurantium
2.2.2 醇浸出物的含量测定
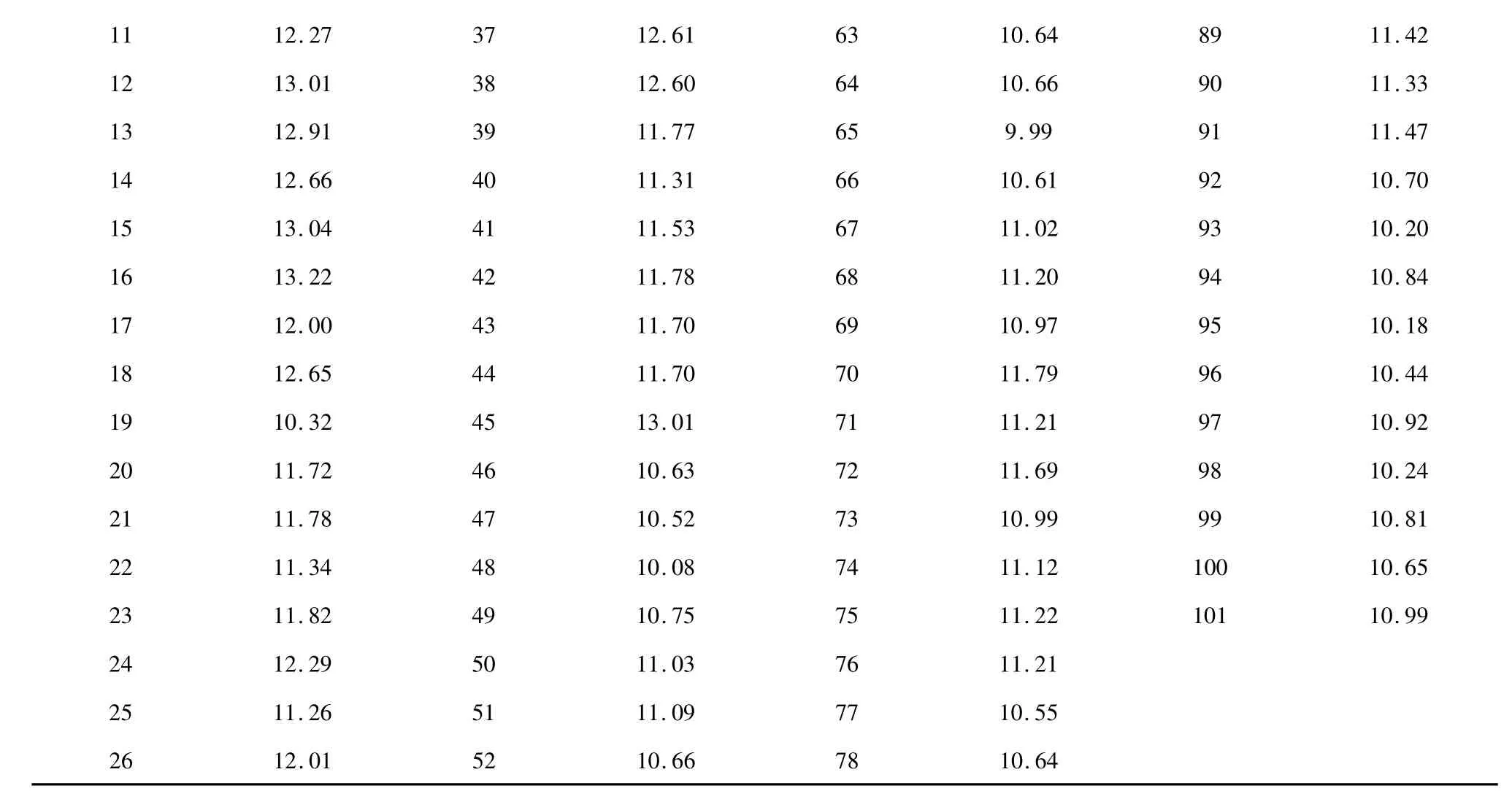
按照2010 年版《中国药典》一部附录X A 项下的醇溶性浸出物测定法的热浸法测定。用70%乙醇作为溶剂,对枳实中的醇浸出物进行测定。取枳实粉末约2 g,精密称定,置100 mL 的锥形瓶中,精密加70%乙醇50 mL,密塞,称定重量,静置1 h 后,加热回流至沸腾,并保持微沸1 h。放冷后,再称定重量,用70 %乙醇补足减失的重量,摇匀,滤过,精密量取滤液25 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量。以干燥品计算供试品中醇溶性浸出物的含量(%),101 份样品的醇浸出物含量为9.99%~13.22%。结果见表2。

表2 枳实中醇浸出物的含量测定结果Table 2 Content determination results of ethanol-extract in C.aurantium
2.3 模型的建立与验证
根据枳实中辛弗林、醇浸出物含量的分布范围,将101 份样品分为校正集和验证集,验证集样品各指标含量范围处于校正集样品含量范围之内。表3为校正集和验证集样品辛弗林、醇浸出物含量的分布范围。

表3 校正集和验证集辛弗林、醇浸出物含量分布范围Table 3 Sample distribution of calibration set and validation set
2.3.1 模型的建立
建模时所选回归方法的不同,对模型的准确性有较大的影响。常用的回归方法有CLS(经典的最小二乘法)、SMLR(逐步多元线性回归法)、PLS(偏最小二乘法)、PCR(主成分回归法)等。每一种方法均有各自的优点和缺点,而对于组成复杂的天然产物如中药、烟草等通常使用PLS。必须对原始光谱进行预处理,常用的预处理方法有多元散射校正法(MSC),标准归一化法(SNV),一阶导数法(First derivative),二阶导数法(Second derivative)等。
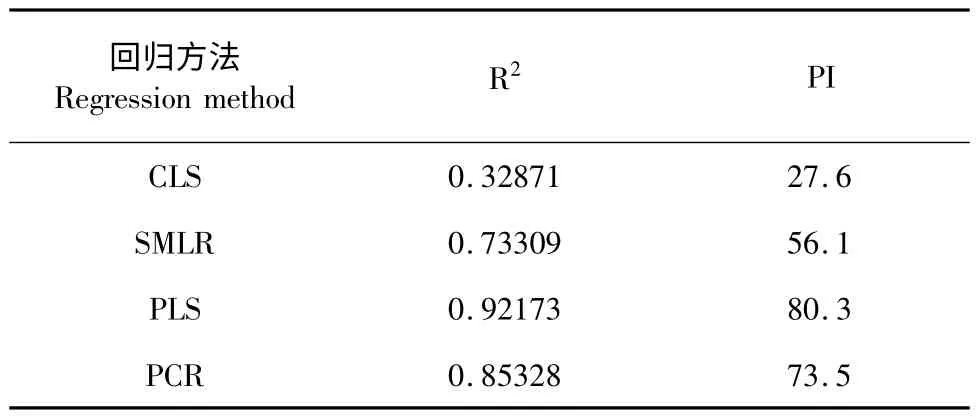
表4 不同回归方法对R2 和PI 的影响Table 4 The influence of different regression methods on R2 and PI
建模时所选的光谱区间不仅包含待测组分的信息量,同时也包含了少部分的冗余信息以及噪声干扰。所以在建立模型时需要不断选择特征波段以调整模型的准确性。
用PLS 法建立近红外定量模型时,主成分数的选择对模型的优劣有显著影响。主成分数太多,使模型包含过多的冗余信息与噪音,出现过拟合现象;主成分数过少,导致建模信息不全,预测能力差[9]。
通过回归方法的选择,对光谱预处理与模型优化,辛弗林、醇浸出物的建模参数及评价指标见表5,辛弗林、醇浸出物的定量分析模型见图2。
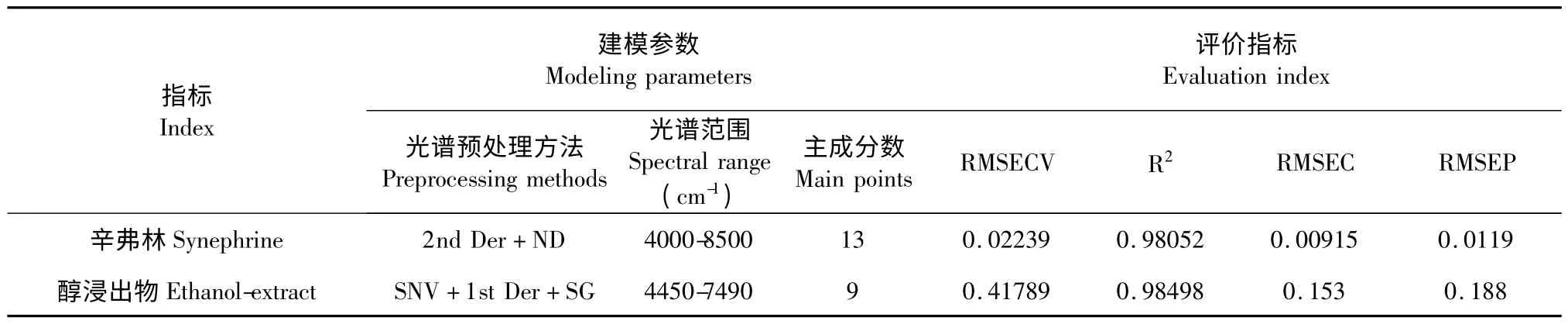
表5 辛弗林及醇浸出物的建模参数及评价指标Table 5 Modeling parameters and evaluation index of synephrine and ethanol-extract
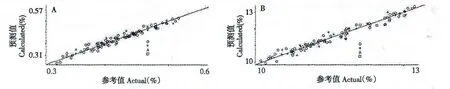
图2 辛弗林(A)及醇浸出物(B)的定量分析模型图Fig.2 Quantitative models of synephrine (A)and ethanol-extract (B)
2.3.2 模型的验证
运用所建定量分析模型对预测样品进行定量分析,从而验证模型的准确性。辛弗林、醇浸出物的RMSEP 分别为0.0119、0.188,相关系数r 分别为0.9106、0.9484,各指标参考值与预测值相关图见图3。
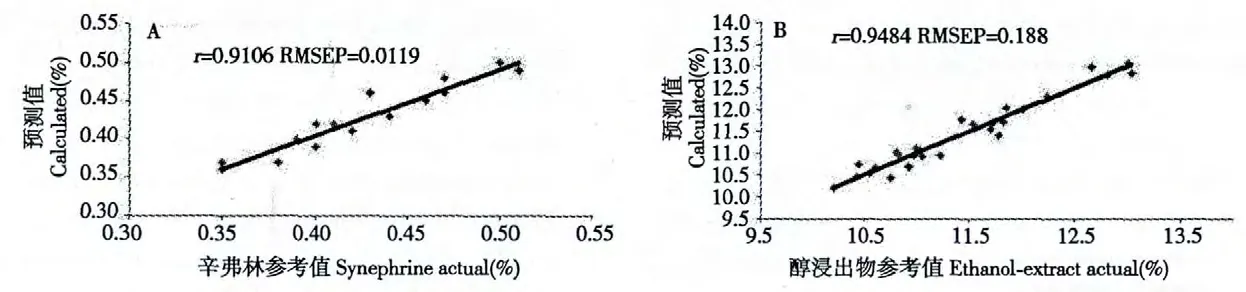
图3 辛弗林参考值(A)和醇浸出物参考值(B)与预测值相关图Fig.3 Correlation plots of predicted values and reference values of synephrine and ethanol-extract
从各指标定量分析模型图及参考值与预测值相关图可以看出,枳实近红外光谱与其辛弗林及醇浸出物含量之间存在一定的相关性,NIR 预测值较准确接近药典法测定的参考值,建立的NIR 定量分析模型具有较好的预测效果,可快速预测其覆盖范围内枳实中辛弗林、醇浸出物的含量。
3 讨论
本试验与厂家合作,利用近红外光谱分析技术结合PLS 建立了枳实中辛弗林、醇浸出物的定量分析模型,该方法分析速度快、结果准确、无损害、无化学污染等优点恰恰弥补了传统分析方法的不足,可用于厂家在枳实原药材的质量控制中的快速、批量检测。同时,该方法对其他中药及有效成分的质量分析也具有一定的借鉴意义。
1 Wang N(王宁),Fu CH(傅春华),Zhou AM(周爱敏),et al.Direct determination of total organic acids in Xiaoerxiaoshi tablets by near infrared diffuse reflection spectroscopy.Chin J Chin Mater Med (中国中药杂志),2007,32:1597-1598.
2 Ren WB(任卫波),Han JG(韩建国),Zhang YW(张蕴薇),et al.The principle and application prospect in forage space breeding of near infrared spectroscopy analysis.Spectrosc Spectral Anal (光谱学与光谱分析),2008,28:303-307.
3 Liu XS(刘雪松),Cheng YY(程翼宇).Fuzzy neural network classifier for fast evaluating the quality of Chinese traditional medicine products using near infrared spectroscopy.Acta Chim Sin(化学学报),2005,63:2216-2220.
4 Yang NL(杨南林),Cheng YY(程翼宇),Qu HB(瞿海斌).An approach to purifying process analysis of Chineseherbal extracts using NIRS.Acta Chim Sin(化学学报),2003,61:742-747.
5 Laasonen M,Harmia PT,Simard CL,et al.Fast identification of Echinacea purpurea dried roots using near-infrared spectroscopy.Anal Chem,2002,74:2493-2496.
6 Tang YF(汤彦丰),Zhang ZY(张卓勇),Fan GQ(范国强).Study on the discrimination of near infrared spectra of rhubarb and artificial neural network.Spectrosc Spectral Anal(光谱学与光谱分析),2004,24:1348-1351.
7 Woo YA,Kim HJ,Ze KR.Near-infrared (NIR)spectroscopy for the non-destructive and fast determination of geographical origin of Angelica egigantis Radix.J Pharm Biomed,2005,36:955-957.
8 Qu HB(瞿海斌),Yang HL(杨海雷),Cheng YY(程翼宇).Nondestructive identification of donkey hide gelatin of authenticity by near infrared diffuse reflectance spectra.Spectrosc Spectral Anal (光谱学与光谱分析),2006,26:60-62.
9 Lu WZ(陆婉珍).Modern Near Infrared Spectroscopy Analytical Technology.Beijing:China Petrochemical Press(中国石化出版社),2007.44.
