不同品种芹菜叶中精油的提取及其功效测定
2015-01-08张玲希董荧荧卓如雄宣贵达
张玲希,郦 帅,董荧荧,何 霞,卓如雄,宣贵达
浙江大学城市学院,杭州 310015
芹菜(Apium graveolens L.)属于伞形科植物,常见的芹菜品种有旱芹、水芹。芹菜具有特殊的辛香气味,特别是芹菜叶。植物精油也称挥发油,具有特殊气味,被广泛用于化妆品、香水等工业中[1]。部分植物精油具有较强的抗菌作用以及抗氧化作用[2-6]。而目前对于植物精油的研究也多在于对其抗菌、抗氧化方面的研究。
现今对芹菜叶的研究多在于对芹菜叶水溶性物质的研究[7-9],有极少学者对于芹菜叶挥发性物质的成分分析进行了探究[10],芹菜叶作为一种生活废弃料,天然无害且成本低廉,故具有一定的经济价值。本研究优化了芹菜叶精油的提取工艺、测定了其抗菌作用、抗氧化作用。研究了常见的废弃芹菜叶的药理作用,为更好地利用芹菜叶提供了理论基础,又因其成本低廉,故具有有较好的商业前景。
1 材料与方法
1.1 材料与试剂
芹菜购于杭州,经浙江大学城市学院植物学专家李林林鉴定属旱芹的铁杆芹菜及细杆芹菜。
金黄色葡萄球菌(Staphylococcus aureu)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)购于杭州天和微生物试剂有限公司。
牛肉膏蛋白胨培养基(g/L,细菌用):牛肉膏3 g,蛋白胨10 g,葡萄糖10 g(仅枯草芽孢杆菌的培养基),NaCl 5 g,琼脂20 g,pH:7.0~7.2
无水乙醇和石油醚均为分析纯试剂。DPPH(日本东京化工业株式会社),二丁基羟基甲苯(BHT)(广东省化学试剂工程技术研究开发中心),抗坏血酸(广东省化学试剂工程技术研究开发中心)。
1.2 仪器与设备
高压蒸汽灭菌锅HVE-50(HILAYAMA),生化培养箱SPX-250B-Z 型(上海博迅实业有限公司医疗设备厂),电热恒温鼓风干燥箱DHG-9240A(上海精宏实验设备有限公司),可见分光光度计22PC(上海棱光技术有限公司),旋转蒸发器RE-2000(上海亚荣生化仪器厂)。
1.3 实验方法
1.3.1 芹菜叶精油的提取及工艺优化
取芹菜叶部分,洗净后自然风干48 h 后放入恒温鼓风干燥箱中在25 ℃条件下烘干24 h,剪碎后称重装保鲜袋中密封备用。根据正交试验法[11]以料液比、浸泡时间、蒸馏时间为3 个因素,每个因素设3 个水平进行实验确定芹菜叶精油提取的最佳条件。具体因素水平如表1 所示。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
1.3.2 MIC 值的测定[12]
MIC 为最小抑菌浓度,即指在体外培养细菌18~24 h 后能抑制培养基内可见菌生长的最低药物浓度。
芹菜叶精油MIC 值的测定采用平板法。将芹菜叶精油用低熔点的石油醚将稀释为系列浓度,加入培养基中后混合均匀,将0.1 mL 的菌悬液均匀地涂布于凝固的培养基表面,各实验菌株在相应培养条件下培养,每个浓度重复试验三次。
1.3.3 抑菌圈的测定[13]
抑菌圈直径的测定采用琼脂扩散法。将0.1 mL 的菌悬液均匀地涂布于凝固的培养基表面,盖好平皿,室温干燥5 min,将已灭菌的滤纸片(直径6.0 mm)每片滴加浓度不同的芹菜叶精油(100、200、300 mg/mL)20 μL,自然晾干后用无菌镊子取样片轻轻贴放于平板表面,每个平板贴3 片试验样片,3片石油醚作对照片。各实验菌株在相应培养条件下培养,测量抑菌直径,实验重复三次。
1.3.4 清除DPPH·能力的测定
将芹菜叶精油用无水乙醇配制成一系列浓度,取0.1 mL 样品加入3.9 mL DPPH 乙醇溶液(25 mg/L),混合放置于室温条件下避光30 min 后,在517 nm 处测定吸光度。
计算公式为:抑制率(%)=[1-(Ai-Aj)/Ac]×100
式中,Ai 为0.1 mL 样品与3.9 mL DPPH 液的吸光度;Aj 为0.1 mL 无水乙醇与3.9 mL DPPH 液的吸光度;Ac 为0.1 mL 样品与3.9 mL 无水乙醇的吸光度。
以上实验用二丁基羟基甲苯(BHT)作阳性对照,重复两次,实验数据作统计分析。
1.3.5 还原铁离子能力的测定[14]
将样品用无水乙醇配制称一系列的浓度,取2.5 mL 不同浓度的样品溶液,加入2.5 mL 的磷酸盐缓冲液(0.2 mol/L,pH=6.6)及2.5 mL 1%的K3Fe(CN)6溶液,于50 ℃水浴反应20 min 后急速冷却,加入2.5 mL 10%的三氯乙酸溶液,取反应液5 mL,加入5 mL 的H2O 和0.1% FeCl3溶液1 mL,混合均匀,10 min 后于700 nm 处测定其吸光光度值,以水为空白。以上实验用抗坏血酸作阳性对照,重复两次,实验数据作统计分析。
1.3.6 数据分析
本文中的实验数据分析均使用SPSS 19.0 中文版软件作统计分析。
2 结果与讨论
2.1 正交实验结果及方差分析
在实验中得出铁杆芹菜与细杆芹菜的精油提取率分别约为1.27%、1.23%。其两种芹菜叶的精油提取率值相近。
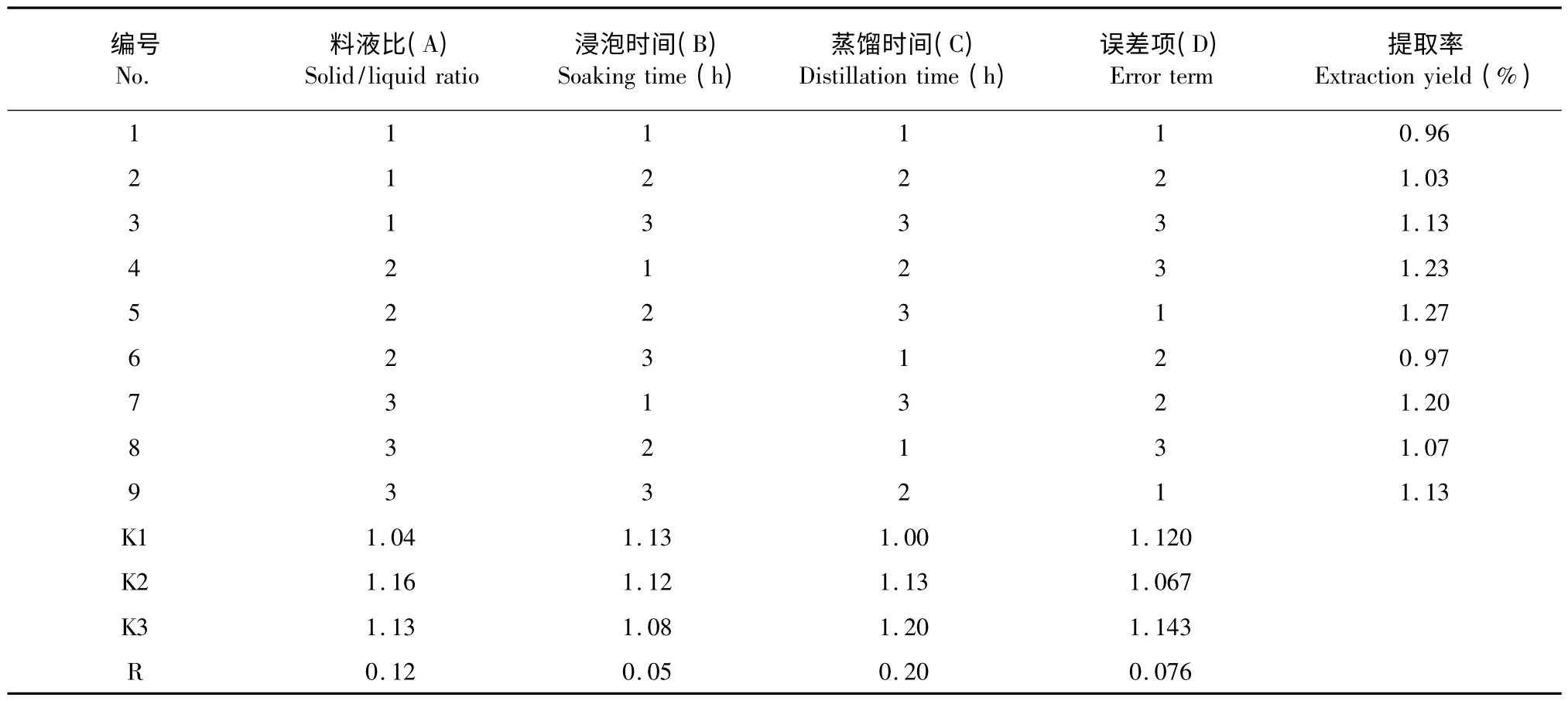
表2 不同实验条件下芹菜叶精油的提取率Table 2 The extraction yields of A.graveolens L.leaves essential oil under different experimental conditions
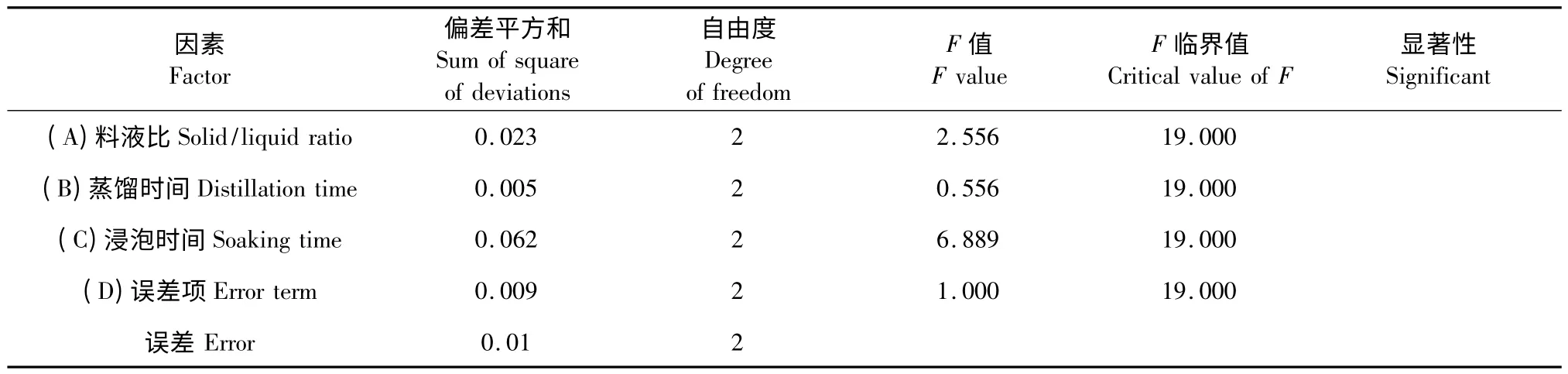
表3 正交试验的方差分析Table 3 Analysis of variance for the orthogonal experiment
由表2 可知,3 个因素对芹菜叶精油提取率的影响程度从大到小依次为:蒸馏时间>料液比>浸泡时间。进一步对实验结果进行方差分析,由表3可知,这3 个因素的各水平之间差异并不显著。因此,芹菜叶精油的最佳提取条件为:A2B1C3,即料液比1∶8 g/mL,浸泡时间0.5 h,蒸馏时间3 h。
在此最佳工艺条件下进行验证实验,芹菜叶精油的得率为1.20%以上。
2.2 芹菜叶精油的MIC 值[12]
MIC 值是评价防腐剂抗菌能力的指标,防腐剂的MIC 值越大,其抗菌能力就越强。
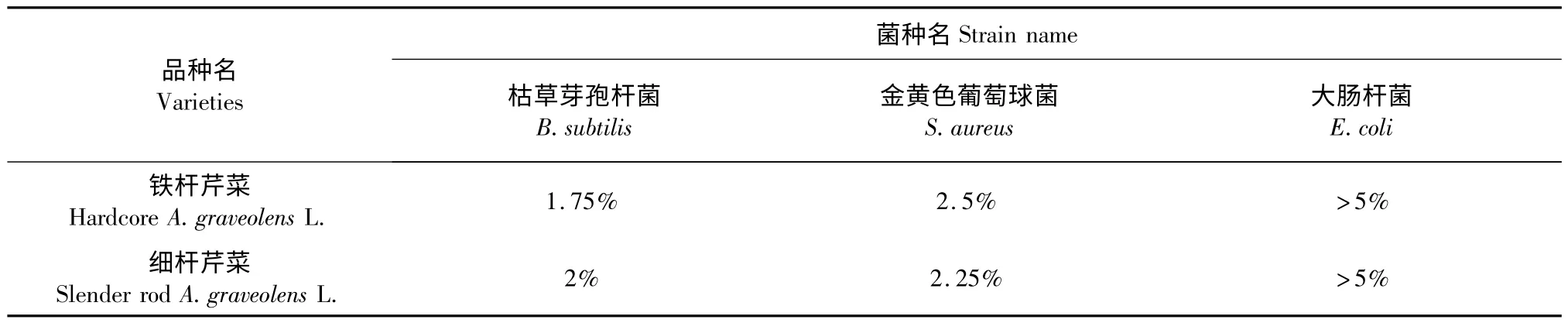
表4 不同品种芹菜叶精油的MIC 值(V/V)Table 4 MICs of different varieties of A.graveolens L.leaves essential oil
由表4 均可知,两个品种的芹菜叶精油对枯草芽孢杆菌、金黄色葡萄球菌的抑菌能力更强,即对于革兰氏阳性菌的抑菌能力更强。而铁杆芹菜的芹菜叶精油对于枯草芽孢杆菌的抗菌活性大于细杆芹菜,细杆芹菜对于金黄色葡萄球菌的抗菌活性大于铁杆芹菜,但总体来说相差不大。
2.3 芹菜叶精油的抑菌圈直径[13]
测定抑菌圈直径亦能评价防腐剂的抗菌能力,抗菌直径越大即抗菌活性越大。
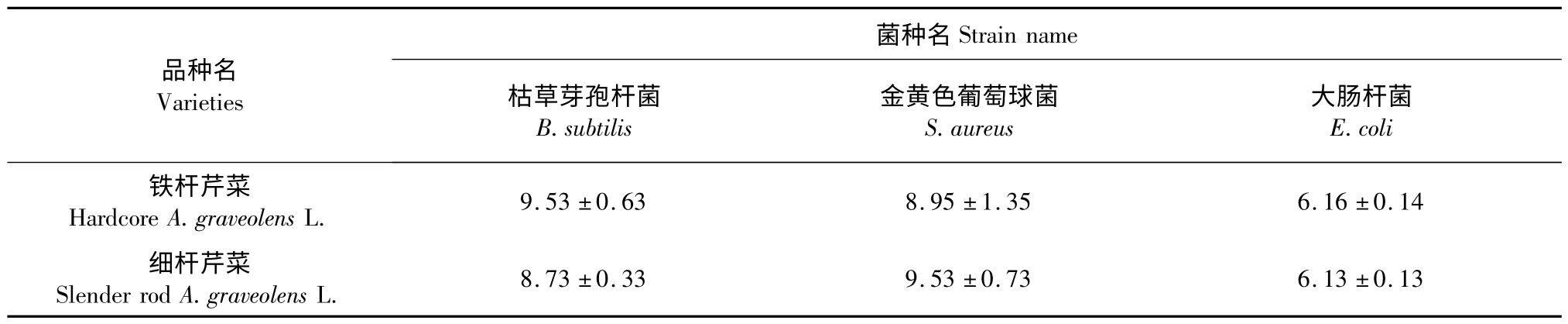
表5 不同品种芹菜叶精油抑菌圈直径(mm)Table 5 Inhibition zone diameter of different varieties of A.graveolens L.leaves essential oil
由表5 可知,芹菜叶精油对枯草芽孢杆菌、金黄色葡萄球菌的抑菌能力更强,即对于革兰氏阳性菌的抑菌能力更强。同样能证明上述结论。
2.4 芹菜叶精油清除自由基能力测定
DPPH·是一种很稳定的以氮为中心的自由基,若提取物能将其清除,则提示提取物具有降低羟自由基、烷自由基或氧化自由基的有效浓度和打断脂质过氧化链反应的作用。
由表6 可知,两个品种芹菜叶精油的清除自由基能力远远低于同等浓度的BHT 试剂清除自由基的能力。细杆芹菜叶精油的抗氧化性明显优于铁杆芹菜叶精油的抗氧化性。
2.5 还原铁离子能力测定[14]
还原能力的测定,可检验化合物是否为良好的电子供应者,它所提供的电子可以使Fe3+还原为Fe2+,使体系溶液颜色改变,从而影响溶液吸光度值的改变,即可反映出体系中氧化和还原状态的改变。吸光度越大,表示样品的抗氧化性越强,反之越弱。

表6 各样品自由基清除率Table 6 Free radical scavenging rate of samples
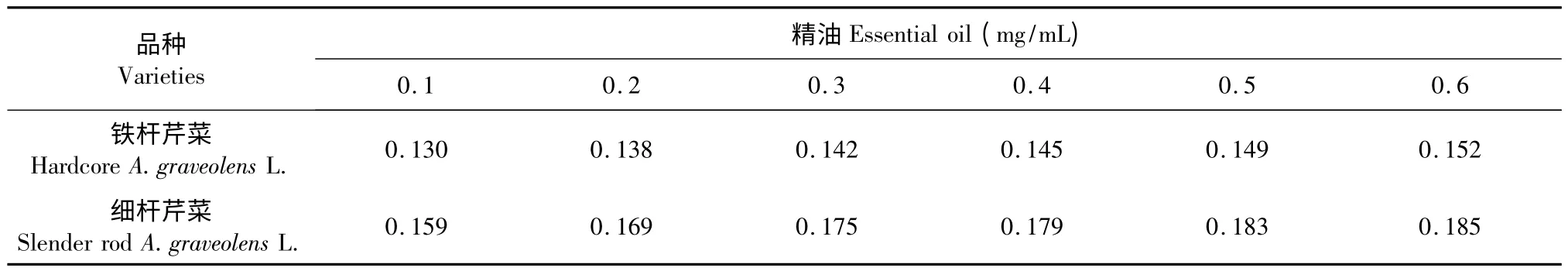
表7 不同品种芹菜叶精油还原铁离子能力(吸光度A)测定Table 7 Fe2+ reducing capacity of different varieties of A.graveolens L.leaves essential oil
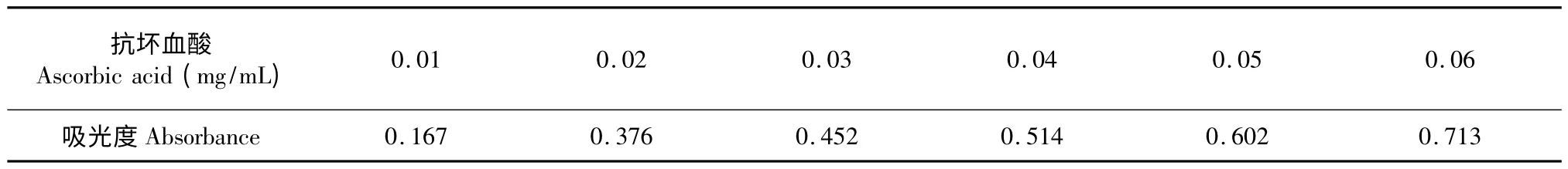
表8 抗坏血酸还原铁离子能力测定Table 8 Fe2+ reducing capacity of Vc
芹菜叶精油和抗坏血酸溶液还原Fe3+能力如表7、表8 所示,其还原铁离子能力随浓度的增加而增加,而芹菜叶精油的还原能力远远低于抗坏血酸。但也可看出,细杆芹菜叶精油的抗氧化性明显优于铁杆芹菜叶精油的抗氧化性。
3 结论
芹菜叶精油的最佳提取条件为:料液比1∶8,浸泡时间0.5 h,蒸馏时间3 h。两个品种的芹菜叶精油提取率相近。两个品种的芹菜叶精油抗菌效果有些许差异,但均对于革兰氏阳性菌的抗菌效果明显。两个品种的芹菜叶精油的抗氧化效果相近且都不明显。但细杆芹菜叶精油的抗氧化效果明显优于铁杆芹菜的抗氧化效果。
1 Wang GY(王广要),Zhou H(周虎),Zeng XF(曾晓峰).Research progress of application of plant essential oil.Food Sci Technol(食品科技),2006,31(5):11-13.
2 Tan LF(谭龙飞),Yang LS(杨连生).Study on bacteriostasis of extracts from two species of five spice powder mildew.Cereals Oils Proc (粮油加工与食品机械),2004,3:58-60.
3 Yuan P(袁萍),Wang GL(王国亮),Gong FJ(龚复俊),et al.Inhibition of 13 kinds of plant essential oil on the mould.J Wuhan Bot Res (武汉植物学研究),2001,19:521-523.
4 Sun W(孙伟),Wang CK(王淳凯),et al.A comparative study of 16 kinds of aromatic plant essential oils antioxidant activity.Food Sci Technol (食品科技),2004,11(11):55-57.
5 Li YJ(李玉杰),Liu XL(刘晓蕾),Liu X(刘霞),et al.Chemical constituents and antifungal activity of rose essential oil.Bull Bot Res (植物研究),2009,29:488-491.
6 Li R(李荣),Jiang ZT(姜子涛),Ma L(马丽).The antioxidant properties of lauric oils and study on free radical scavenging capacity.Chin Condiment(中国调味品),2009,34(11):58-62.
7 Tang SF(唐淑芬).Study on extraction process of total flavonoids in celery leaves.J Anhui Agric Sci (安徽农业科学),2011,39:13409-13411.
8 Wang C(王辰),Zhang J M(张金木).Study on the antioxidant activity of extracts of celery leaf.J Anhui Agric Sci (安徽农业科学),2006,34:3174-3175.
9 Shen MG(沈铭高),Jin Y(金阳),Li WY(李薇雅).The chemical constituents and pharmacological effects of celery.J Anhui Agric Sci (安徽农业科学),2008,36:1474-1475.
10 Zhao WH(赵卫红).Analysis of volatile components of celery GC/MS.J Anshan Norm Univ(鞍山师范学院学报),2006,8(6):25-26.
11 Qiu H(邱洪),Wang LP(王利平),Zhang TJ(张天监),et al.Decoction technology of orthogonal test Xiao Fu Yan capsule.Chin Pharm (中国药业),2010,19(20):50-51.
12 Li N(李楠),Zu YG(祖元刚),Wang W(王微).Antibacterial and antioxidant of celery seed essential oil.Chin Condiment(中国调味品),2012,37(5):28-30.
13 Deng S(邓双),Liang ZY(梁志远),Zhang LL(张丽丽),et al.Three kinds of antibacterial activity of essential oils.J Guizhou Norm Univ(贵州师范学院学报),2012,28(12):30-32.
14 Liu ZX(刘朝霞),Wang N(王宁),Zou K(邹坤),et al.Dendranthema antibacterial and antioxidant activity of essential oil (I).J Chin Three Gorges,Uni Nat Sci(三峡大学学报,自科版),2006,28:181-184.
