6-氰基-(3R,5R)二羟基己酸叔丁酯合成的补料生物转化工艺
2015-01-07刘小青王亚军沈伟良郑裕国
刘小青,王亚军,沈伟良,罗 希,郑裕国
浙江工业大学生物与环境工程学院,浙江 杭州 310014
6-氰基-(3R,5R)二羟基己酸叔丁酯合成的补料生物转化工艺
刘小青,王亚军,沈伟良,罗 希,郑裕国
浙江工业大学生物与环境工程学院,浙江 杭州 310014
通过对羰基还原酶工程菌E.coliBL21/pET28a(+)-cr与葡萄糖脱氢酶工程菌E.coliBL21/pET28a(+)-gdh的全细胞协同生物转化工艺进行优化,实现高浓度投料的6-氰基-(5R)-羟基-3-羰基己酸叔丁酯[(5R)-CHOHB]不对称还原合成6-氰基-(3R,5R)-二羟基己酸叔丁酯[(3R,5R)-CDHHB]。采用全细胞分批转化方式,确定底物(5R)-CHOHB和葡萄糖的一次性投料浓度为300 g/L。进一步考察了补料转化方式对提高转化效率的影响。结果表明,相对于一次性投料的全细胞分批转化工艺,采用连续补料方式和分批补料方式均能使底物投料量达到400 g/L。相对于以往报道,底物投料量提高了33.3%,产物(3R,5R)-CDHHB非对映体过量值(d.e.值)为99.5 %,具有良好的工业应用前景。
补料生物转化 羰基还原酶 6-氰基-(5R)-羟基-3-羰基己酸叔丁酯 6-氰基-(3R,5R)-二羟基己酸叔丁酯
阿托伐他汀是临床上治疗高血脂症的首选药物[1],作为甲羟戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,能有效抑制HMG-CoA向甲羟戊酸的还原性转化,降低了低密度脂蛋白胆固醇的水平,达到降低血脂的目的[2,3]。6-氰基-(3R,5R)-二羟基己酸叔丁酯[(3R,5R)-CDHHB]是合成阿托伐他汀的关键手性中间体[4],含有两个手性中心。化学法合成(3R,5R)-CDHHB需要使用易燃试剂硼烷[5],且差向选择性诱导不充分,产物光学纯度低。生物催化具有高对映体选择、高区域选择性以及环保低耗的优势,在倡导绿色环保低碳节能的大趋势下,采用生物催化技术合成(3R,5R)-CDHHB具有优势[6,7]。
羰基还原酶来源广泛,是一种具有高度的化学、区域和立体选择性的生物催化剂,常用于生物还原前手性酮制备手性醇[8]。近几年来,用羰基还原酶作为生物催化剂参与合成(3R,5R)-CDHHB的研究与工业应用日益增多,曹政等[9]在研究中所用底物(5R)-CHOHB质量浓度达到了200 g/L,且底物转化率达到100%,产物非对映体过量值(d.e.)大于99.5%。本课题组前期已经成功开发了羰基还原酶工程菌E.coliBL21(DE3)/pET28a(+)-cr与葡萄糖脱氢酶工程菌E.coliBL21/pET28a(+)-gdh双菌破碎液协同催化6-氰基-(5R)-羟基-3-羰基己酸叔丁酯[(5R)-CHOHB]选择性还原合成(3R,5R)-CDHHB的技术[9-11],如图1所示。由于细胞内源性NADP+足够满足反应要求,该工艺无需添加外源性辅酶II,然而,细胞破碎处理增加了酶制备的操作成本,且会降低酶的稳定性。同时,在有机溶剂/水两相中进行的微生物催化反应,有机溶剂作为反应介质的一个重要障碍是有机溶剂一般都对微生物有明显的毒害作用。de Snett等[12]在研究有机溶剂对大肠杆菌的影响中发现,在一定浓度有机溶剂存在情况下,细胞膜会从片层的双层状态变成蜂窝状,显然,有机溶剂的介入对细胞膜结构造成了影响,破坏了其完整性。考虑到以上涉及到的因素,本研究考察双菌全细胞协同催化的可行性,并适时建立(3R,5R)-CDHHB的补料生物转化工艺。

图1 (3R,5R)-CDHHB生物转化合成[9]Fig.1 Bioconversion asymmetric reduction of (5R)-CHOHB to (3R,5R)-CDHHB[9]
1 材料及方法
1.1 菌株和主要试剂
E. coliBL21/pET28a-cr与E. coliBL21/pET28a-gdh,由浙江工业大学生物工程研究所构建、保藏。卡那霉素购自TaKaRa公司;底物(5R)-CHOHB(质量含量66.0%),新东港药业赠送;(3R,5R)-CDHHB购自Toronto Research Chemicals Inc(多伦多,加拿大);进口胰蛋白酶和进口酵母粉购自Oxoid公司;其他化学试剂均为市售分析纯试剂,其他培养基原料均为市售生化试剂。
1.2 培养基及培养方法
1.2.1 培养基
斜面培养基,采用LB固体培养基。
种子培养基采用LB液体培养基,组成:10 g/L进口胰蛋白胨,5 g/L进口酵母粉,10 g/L NaCl。培养基灭菌后加入终浓度30 μg/mL卡那霉素。
发酵培养基组成:15 g/L甘油,15 g/L蛋白胨(国产),12 g/L酵母粉(国产),10 g/L NaCl,5 g/L (NH4)2SO4,1.36 g/L KH2PO4,2.28 g/L K2HPO4·3H2O,0.375 g/L MgSO4·7H2O。培养基灭菌后加入终浓度30 μg/mL卡那霉素。
1.2.2 培养方法
种子培养:从斜面培养基中挑取一接种环的菌落接种于装有100 mL种子培养基的500 mL三角瓶中,置于旋转式摇床(37 ℃,150 r/min)培养7~8 h。
5 L发酵罐培养方法:配制3 L发酵培养基,按照说明安装好pH电极与溶氧电极等附件,实消灭菌(121 ℃,20 min)后,加卡那霉素至终浓度30 μg/mL。按接种量3%接种后,搅拌转速500 r/min,通气量0.24 m3/h(通气比约为1.33 vvm),罐压0.05 MPa,发酵过程中用氨水和磷酸调节发酵液pH值维持在7.0左右。发酵培养温度为37 ℃,当菌体生长到对数生长期(发酵液细菌细胞光密度OD600为10~15)后,28 ℃降温诱导培养。培养过程中定时取样,一部分用于测定发酵液OD600,另一部分离心后收集菌体细胞用于测定酶活。当OD600开始下降后,终止发酵,离心收集菌体。
1.3 全细胞催化合成(3R,5R)-CDHHB
反应体系为100 mL(6.5 g/L三乙醇胺缓冲体系),10 g DCW/LE.coliBL21/pET28a-cr,5 g DCW/LE.coliBL21/pET28a-gdh,所用底物与葡萄糖的起始质量浓度相同(终浓度为0~400 g/L)。在转化过程中利用梅特勒双通道恒pH滴定仪控制蠕动泵,通过滴加1.0 mol/L Na2CO3溶液来控制转化液pH值在7左右,反应温度30 ℃,磁力搅拌转速500 r/min。定时取样,样品用无水乙醇稀释适当的倍数后12 000 r/min离心5 min,上清液经0.22 μm微滤膜过滤,透过液采用高效液相色谱分析。
1.4 全细胞催化制备(3R,5R)-CDHHB的补料工艺
1.4.1 分批转化
初始反应体系100 mL(6.5 g/L三乙醇胺缓冲体系),10 g DCW/LE.coliBL21/pET28a-cr,5 g DCW/LE.coliBL21/pET28a-gdh,(5R)-CHOHB与葡萄糖的质量浓度相同(终浓度均为300 g/L)。设置两种不同的补料料液组成:基础转化液中(5R)-CHOHB、葡萄糖的浓度均为100 g/L,反应过程中每隔1 h补料100 g/L (5R)-CHOHB、葡萄糖;基础转化液中一次性投入300 g/L葡萄糖,反应过程中每隔1 h补料100 g/L (5R)-CHOHB、葡萄糖。转化反应在30 ℃,pH 7.0条件下转化8 h。
1.4.2 分批补料转化
基础转化液体积100 mL(6.5 g/L三乙醇胺缓冲体系),10 g DCW/LE.coliBL21/pET28a-cr,5 g DCW/LE.coliBL21/pET28a-gdh,100 g/L (5R)-CHOHB,100 g/L 葡萄糖,转化温度30 ℃,转化液pH值7.0。当基础转化液中转化率达到99%以上时,投入(5R)-CHOHB、葡萄糖(终浓度均为100 g/L);当底物转化率达到99%以上时,开始下一次投料。
1.4.3 连续补料转化
基础转化液组成及反应条件同上。当基础转化液中转化率达到99%以上时,在4 h内匀速泵入(5R)-CHOHB和葡萄糖溶液,两者终浓度均为400 g/L。
1.5 分析方法
采用岛津HPLC LC-20AD高效液相色谱法测定(5R)-CHOHB与产物(3R,5R)-CDHHB及其异构体(3S,5R)-CDHHB浓度。选择J&K CHEMICA C18色谱柱(4.6 mm×250 mm),流动相组成为乙腈与水的体积比1:3,流速1.0 mL/min,紫外检测波长210 nm,进样量20 μL,柱温40 ℃。(5R)-CHOHB与产物(3R,5R)-CDHHB、(3S,5R)-CDHHB保留时间分别为11.5,7.8,7.4 min。
底物(5R)-CHOHB转化率η(%)以质量浓度计算(g/L);产物(3R,5R)-CDHHB非对映体过量值(d.e.值)为(3R,5R)-CDHHB的峰面积和(3S,5R)-CDHHB的峰面积之差与两者峰面积之和的比值。实验过程中测得各反应液产物 (3R,5R)-CDHHB的d.e.值均为99.5%。
2 结果与讨论
2.1 全细胞分批转化合成(3R,5R)-CDHHB
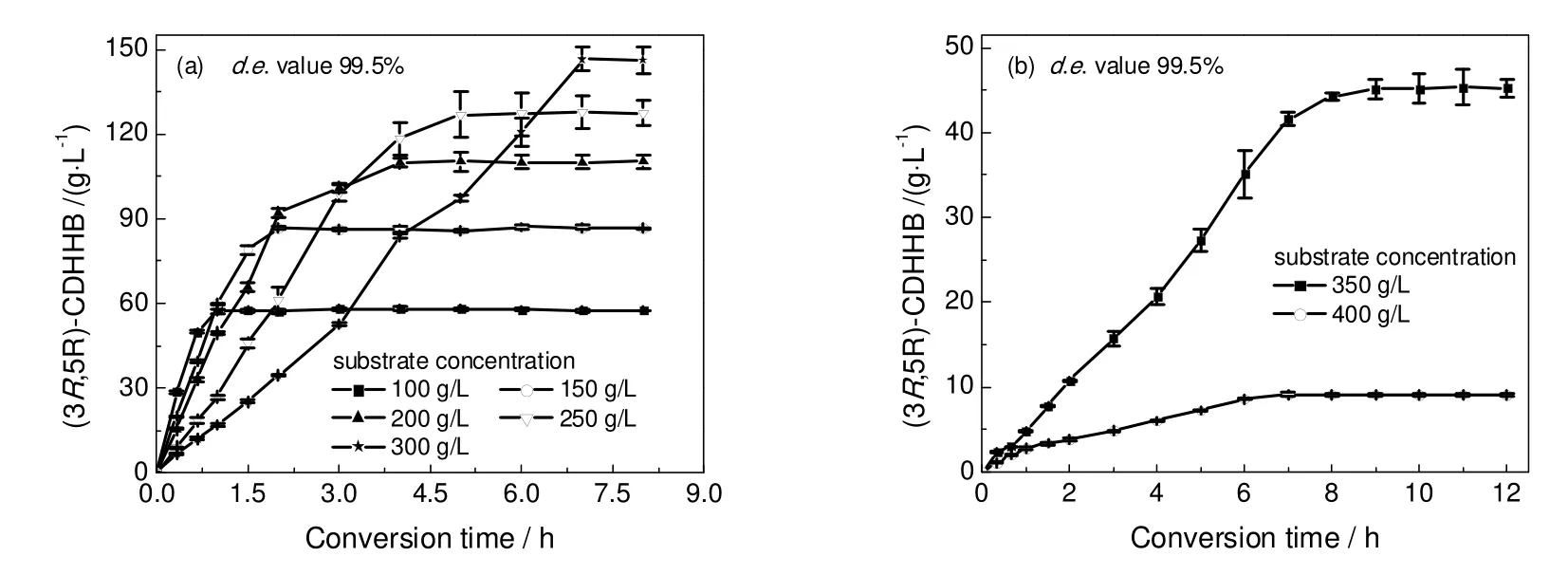
图2 底物浓度对(5R)-CHOHB分批转化效率的影响Fig.2 Effect of the substrate concentration on the conversion efficiency of (5R)-CHOHB under the batch bioconversion mode
图2所示为底物浓度对(5R)-CHOHB全细胞分批转化效率的影响。可以看到,100 g/L (5R)-CHOHB在1 h内完全转化;底物浓度增加至200 g/L、300 g/L时,转化时间分别延长至4 h和7 h。当底物浓度增大至350 g/L时,反应到9 h达到平台期,底物转化率仅为19.6%;当底物浓度进一步增大到400 g/L时,反应7 h后底物不再被还原,底物转化率仅为3.5%。有研究发现大肠杆菌对有机溶剂耐受性比革兰氏阳性菌强[13],有机溶剂深层次的毒害是由它在细胞膜中浓度大小决定的[14]。可以解释为,少量的溶剂分子进人细胞膜内并不足以破坏整个细胞,只有浓度达到一定限度超过了界限浓度,就会对细胞膜结构破坏,影响其作为屏障和转换的功能。因此,综合考虑有机溶剂影响以及时空产率和转化率,采用全细胞转化工艺时,分批转化底物与葡萄糖投料量控制在300 g/L水平。
2.2 补料物料组成对分批补料转化效率的影响
底物分批投料是提高催化反应效率的有效措施[15]。首先考察了补料物料组成对(5R)-CHOHB分批补料转化效率的影响,结果见图3。实验结果显示,相比于300 g/L (5R)-CHOHB催化底物和300 g/L葡萄糖一次性投料的分批转化方式,两种补料物料组成下的补料方式均提高(5R)-CHOHB转化速率,且底物均能完全转化。其中,(5R)-CHOHB与葡萄糖同时等量补料情况下的底物转化速率最快。

图3 补料物料组成对(5R)-CHOHB转化效率的影响Fig.3 Effect of feed composition on (5R)-CHOHB stereoselective reduction
2.3 (3R,5R)-CDHHB分批补料转化进程
分批补料模式下的(5R)-CHOHB转化进程曲线示于图4。如图4所示,第1批底物在投料后40 min时完全转化;第2批、第3批底物分别在总反应时间2 h和4 h反应完全,第4批底物在总反应时间6 h完全转化,此时(5R)-CHOHB累计投料400 g/L;投入第5批底物后,在总反应时间9 h时转化达到平衡,但底物转化率下降至93%,这可能与高浓度(3R,5R)-CDHHB导致的产物抑制以及酶失活有关。相比于间隙转化操作方式,分批补料转化方式提高底物投料量33.3%。

图4 分批补料对(5R)-CHOHB-还原反应的影响Fig.4 Effect of the fed-batch feeding on (5R)-CHOHB stereoselective reduction

图5 连续补料与分批补料时的还原反应结果Fig.5 Stereoselective reduction results under continuous feeding and fed-batch operations
2.4 (3R,5R)-CDHHB连续补料转化
连续补料与分批补料都能有效提高催化反应效率,图5所示为两种投料方式时(5R)-CHOHB生物还原结果。可以看出,在转化前3 h内,连续补料操作方式的反应速率高于分批补料操作;随着反应进行,底物累计投料量增大、产物累积浓度增大,两种操作方式对底物转化速率的影响逐渐减小;转化6 h,连续补料和分批补料操作两种操作模式下400 g/L底物均能完全转化,产物d.e.值均保持在99.5%。依据以上结果,与本课题组前期工作以及相关研究报道[9-11]相比,底物投料量有很大提升,而且对于400 g/L的底物投料量,无论采用连续补料还是分批补料操作方式都能满足工业生产要求。
3 结 论
建立了重组大肠杆菌全细胞双酶催化合成阿托伐他汀钙的关键手性中间体(3R,5R)-CDHHB的催化工艺,高浓度的(5R)-CHOHB暴露破坏了E.coli细胞膜结构,提高了(5R)-CHOHB、辅酶II和(3R,5R)-CDHHB的细胞通透性。全细胞分批催化工艺较细胞破碎液工艺节省了细胞破碎操作成本,提高了酶的储存稳定性。由于羰基还原酶存在底物抑制作用,进一步优化了底物分批补料转化和连续补料工艺,发现在(5R)-CHOHB累积投料量400 g/L条件下,反应6 h底物均能完全转化。与分批转化工艺相比,补料转化工艺提高时空产率33.3%,大幅度提高设备周转,具有重要的工业应用前景。
[1] 董 旭. 他汀类药物抗高血压作用的研究进展 [J]. 临床荟萃, 2008, 23(8):604-605. Dong Xu. The progress of statins antihypertensive effect for research [J].Clinical Focus, 2008, 23(8):604-605.
[2] 刘 英, 刘惠亮. 阿托伐他汀多效性研究进展 [J]. 中国全科医学, 2013, 16(6):601-604. Liu Ying, Liu Huiliang. Research progress of pleiotropic effects of atorvastatin [J]. Chinese General Practice, 2013, 16(6):601-604.
[3] Gupta M, Martineau P, Tran T, et al. Low-density lipoprotein cholesterol and high-sensitivity C-reactive protein lowering with atorvastatin in patients of South Asian compared with European origin: insights from the Achieve Cholesterol Targets Fast with Atorvastatin Stratified Titration (ACTFAST) study [J].Journal of Clinical Pharmacology, 2012, 52(6):850-858.
[4] Wolberg M, Villela M, Bode S, et al. Chemoenzymatic synthesis of the chiral side-chain of statins: application of an alcohol dehydrogenase catalysed ketone reduction on a large scale [J]. Bioprocess and Biosystems Engineering, 2008, 31(3):183-191.
[5] 徐慰倬, 张 莹, 来琳琳, 等. 他汀类药物中间体的生物催化合成研究进展 [J]. 中国药物化学杂志, 2012, 22(1):51-58. Xu Weizhuo, Zhang Ying, Lai Linlin, et al. Advance in biocatalytic synthesis of statin intermediates [J]. Chinese Journal of Medicinal Chemistry, 2012, 22(1):51-58.
[6] 马 琳. 对他汀类药物抗肿瘤作用的研究进展 [J]. 当代医药论丛, 2014, 12(13):181-182. Ma Lin. The research progress of antitumor effect of statins [J]. Contemporary Medicine Forum, 2014, 12(13):181-182.
[7] Wu X, Gou X, Chen Y, et al. Enzymatic preparation oft-butyl-6-cyano-(3R,5R)-dihydroxyhexanoate by a whole-cell biocatalyst coexpressing carbonyl reductase and glucose dehydrogenase [J]. Process Biochemistry, 2015, 50(1):104-110.
[8] Shimizu S, Kataoka M, Kita K. Chiral alcohol synthesis with yeast carbonyl reductases [J]. Journal of Molecular Catalysis B: Enzymatic, 1998, 5(1-4):321-325.
[9] 曹 政, 王亚军, 肖 黎, 等. 羰基还原酶不对称还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯 [J]. 生物加工过程, 2013, 11(1):17-22. Cao Zheng, Wang Yajun, Xiao Li, et al. Asymmetric reduction oft-butyl 6-cyano-(5R)-hydroxyl-3-carbonyhexanoate by carbonyl reductase [J]. Chinese Journal of Bioprocess Engineering, 2013, 11(1):17-22.
[10] 盛骏桢, 王亚军, 罗 希, 等. 具有差向选择性还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯活性的微生物菌株筛选和鉴定 [J]. 生物加工过程, 2013, 11 11(1):54-59. Sheng Junzhen, Wang Yajun, Luo Xi, et al. Screening for microbe displaying diastereoselective ketoreductase activity towardst-butyl-6-cyano-(5R)-hydroxyl-3-oxohexanoate [J]. Chinese Journal of Bioprocess Engineering, 2013, 11(1):54-59.
[11] 肖 黎, 王亚军. 生物催化法合成6-氰基-(3R,5R)-二羟基己酸叔丁酯 [J]. 生物加工过程, 2013, 11(1):29-34. Xiao Li, Wang Yajun. Development of biocatalytic process fort-butyl 6-cyano-(3R,5R)-dihydroxylhexanoate [J].Chinese Journal of Bioprocess Engineering, 2013, 11(1):29-34.
[12] de Smet MJ, Kingma J, Witholt B. The effect of toluene on the structure and permeability of the outer and cytoplasmic membranes ofEscherichia coli[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 1978, 506(1): 64-80.
[13] Rajagopal S, Sudarsan N, Nickerson K W. Sodium dodecyl sulfate hypersensitivity ofclpPandclpBmutants ofEscherichia coli[J]. Applied and Environmental Microbiology, 2002, 68(8): 4117-4121.
[14] Sikkema J, Debont JAM, Poolman B. Mechanisms of membrane toxicity of hydrocarbons [J]. Microbiological Reviews, 1995, 59(2): 201-222.
[15] 周晓燕, 文湘华, 冯 嫣. 葡萄糖补料对白腐真菌P. chrysosporium产木质素降解酶的影响 [J]. 环境科学学报, 2007, 27(3):363-368.Zhou Xiaoyan, Wen Xianghua, Feng Yan. The influence of glucose feeding on the ligninolytic enzymes production of the white rot fungusP. chrysosporium[J]. Acta Scientiae Circumstantiae, 2007, 27(3):363-368.
Fed-Batch Bioconversion Process for Synthesis of t-Butyl-6-Cyano-(3R,5R)-Dihydroxylhexanoate
Liu Xiaoqing, Wang Yajun, Shen Weiliang, Luo Xi, Zheng Yuguo
Institute of Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China
Process for synthesis oft-butyl-6-cyano-(3R,5R)-dihydroxyhexanoate [(3R,5R)-CDHHB] from asymmetric reduction oft-butyl-6-cyano-(5R)-hydroxyl-3-carbonyhexanoate [(5R)-CHOHB] using whole cells of carbonyl producerE.coliBL21/pET28a-crtogether withE.coliBL21/pET28a-gdhwas developed in this work, with 300 g/L concentrations of (5R)-CHOHB and glucose respectively under the batch bioconversion mode. Furthermore, the effect of fed-bioconversion process of (3R,5R)-CDHHB was also investigated to improve the conversion efficiency. It was found that both the fed-batch and continuous feeding operation modes improved the conversion efficiency compared with batch intermittent conversion process, and raised the accumulated concentration of substrate loading up to 400 g/L, increased by 33.3% with respect to the previous report. Thed.e. value of (3R,5R)-CDHHB was 99.5%.
fed-bioconversion; carbonyl reductase;t-butyl-6-cyano-(5R)-hydroxyl-3-carbonyhexanoate;t-butyl-6-cyano-(3R,5R)-dihydroxyhexanoate
1001—7631 ( 2015 ) 05—0443—06
Q555+.6
A
2015-04-07;
: 2015-05-21。
刘小青(1990—),女,硕士研究生;郑裕国(1961—),男,教授,通讯联系人。E-mail:zhengyg@zjut.edu.cn。
国家自然科学基金(21476209);国家重点基础研究发展计划(973计划)(2011CB710800);省重大科技专项(2014C03010)。
