乙型肝炎病毒前S2蛋白激活人酰基蛋白硫酯酶1启动子*
2015-01-07刘健翔李红岩黄海霞史云龙刘永明苏何玲
杨 易,刘健翔,李红岩,黄海霞,史云龙,刘永明,苏何玲
(桂林医学院生物化学与分子生物学教研室,广西桂林 541100)
·论 著·
乙型肝炎病毒前S2蛋白激活人酰基蛋白硫酯酶1启动子*
杨 易,刘健翔,李红岩,黄海霞,史云龙,刘永明△,苏何玲▲
(桂林医学院生物化学与分子生物学教研室,广西桂林 541100)
目的探讨乙型肝炎病毒(HBV)前S2蛋白(preS2)对人酰基蛋白硫酯酶1(APT1)启动子的作用。方法生物信息学方法确定人APT1启动子序列。PCR扩增人APT1启动子和HBV preS2基因,分别插入pGL3和pcDNA3.1(-)质粒构建人APT1启动子荧光素酶报告基因质粒pGL3-APT1和HBV preS2真核表达质粒pcDNA3.1(-)-preS2。将pGL3-APT1和pcDNA3.1(-)-preS2共转染人肝癌细胞系HepG2,然后通过检测细胞荧光素酶活性来评价preS2对人APT1基因启动子的作用。数据用独立样本t检验分析。结果测序结果证实pcDNA3.1(-)-preS2与pGL3-APT1与实验设计相符。pGL3-APT1的荧光素酶活性是阳性对照质粒pGL3-Control的荧光素酶活性的1.2倍(P<0.01)。pcDNA3.1(-)-preS2与pGL3-APT1共转染HepG2细胞的荧光素酶活性为无preS2基因质粒pcDNA3.1(-)与pGL3-APT1共转染HepG2细胞荧光素酶活性的2.6倍(P<0.01)。结论本研究克隆的人APT1启动子序列具有高启动子活性;HBV preS2可激活人APT1启动子。
肝炎病毒,乙型;病毒蛋白类;蛋白质前体;酰基蛋白硫酯酶1;启动子;反式激活
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球性公共卫生问题,慢性HBV感染人群超过2.4亿,每年约有78万人死于因HBV感染所导致的相关疾病[1]。大量的研究表明,HBV编码的多种蛋白具有反式转录激活功能。这些病毒反式调节因子在HBV感染所致的炎性反应乃至肝细胞癌发生的过程中发挥着关键的作用[2-3]。HBV前S2蛋白(preS2)是重要的HBV反式调节因子,可调节原癌基因、端粒酶及一氧化氮合酶等基因的表达,其反式转录激活作用影响宿主细胞生长、信号转导、免疫调节和肿瘤发生等生理、病理过程[4-5]。近年来,酰基蛋白硫酯酶1(acyl protein thioesterase 1,APT1)因其参与蛋白质棕榈酰化修饰的调节而受到重视。棕榈酰化修饰是蛋白质完成翻译后脂质共价修饰的一种重要形式,广泛存在于生物体内,在代谢、凋亡、细胞内信号的传导以及疾病的发生发展等环节中都起着非常重要的作用[6-8]。蛋白质棕榈酰化修饰的主要类型是S 型棕榈酰化修饰,即16 个碳的饱和棕榈酸盐以硫酯键形式共价结合到半胱氨酸残基的巯基上。APT1是棕榈酰化蛋白去S型棕榈酰化修饰的主要水解酶,在蛋白质可逆性棕榈酰化修饰中发挥关键作用[9]。目前尚不清楚preS2对APT1基因表达的影响。本研究构建APT1启动子荧光素酶报告质粒和HBV的preS2真核表达质粒共转染人肝癌细胞系HepG2,以观察preS2对APT1启动子的作用。
1 材料与方法
1.1 实验材料 乙型肝炎患者血清及全血由广西壮族自治区桂林市第三人民医院提供。HepG2细胞由解放军302医院馈赠,高糖DMEM培养基、链霉素及青霉素及胰酶均购自美国Gibco公司,胎牛血清购自浙江天杭生物科技有限公司,LipofectamineTM2000 转染试剂购自美国Invitrogen公司,限制性内切酶EcoRⅠ、BamHⅠ、KpnI及XhoI购自上海生物工程有限公司,荧光素酶报告基因质粒pGL3系列载体和T-easy试剂盒购自美国Promega公司,质粒DNA小量提取试剂盒购自天根生化科技有限公司,双荧光素酶报告基因检测试剂盒购自北京威格拉斯生物技术有限公司。测序均由上海生物工程有限公司完成。
1.2 方法
1.2.1 pcDNA3.1(-)-preS2 重组质粒的构建 根据 HBV 基因组全序列(GenBank accession No.AF384371),设计引物扩增preS2基因,引物两端分别加上EcoRⅠ和BamHⅠ酶切位点序列,上游引物为:5′-GAA TTC CAA TGC AGT GGA ACT CCA CC-3′,下游引物为:5′-GGA TCC GTT CGG TGC AGG GTC-3′。提取乙型肝炎患者血清中的HBV为模板,PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 延伸10 min。将PCR产物克隆入 pGEM®-T Easy 载体,EcoR Ⅰ和BamH Ⅰ双酶切后装入 pcDNA3.1(-) 载体中构建 pcDNA3.1(-)-preS2 重组质粒,并测序鉴定其序列。
1.2.2 APT1启动子双荧光素酶报告基因质粒的构建 在http://dbtss.hgc.jp/ 数据库中查寻人APT1基因(GenBank accession No.NM_006330)转录起始位点,选取转录起始点上游1 500 bp核苷酸及转录起始点下游100 bp核苷酸序列,以Berkeley Drosophila Genome Project(http://www.fruitfly.org/seq_tools/promoter.html)数据库在线预测其启动子,根据软件预测的分值及与转录起始点的相对位置,设计引物扩增-1 164~+67 bp的片段,并在引物的两端加上KpnI 和XhoI 酶切位点,APT1上游引物为:5′-GGG GTA CCC ACC GTG TTA AGG CAG GAT G-3′, APT1下游引物为:5′-CCG CTC GAG CCC CGC GCT ACC TTC CG CGC-3′。以人外周血中的DNA为模板,PCR反应条件为:94 ℃ 3 min;94 ℃ 40 s,58 ℃ 30 s,72 ℃ 1 min 30 s,35个循环;72℃ 延伸 5 min。将扩增的APT1启动子序列克隆入pGL3质粒中构建pGL3-APT1启动子双荧光素酶报告基因质粒。
1.2.3 细胞培养、转染及荧光素酶活性检测 以含10%胎牛血清的高糖DMEM培养基,37 ℃、5% CO2培养HepG2细胞,转染前1 d以细胞2×105个/孔接种于24孔板。以LipofectamineTM2000为转染试剂,将无内毒素质粒转染至细胞中,所有转染均同时转染海肾荧光素酶报告基因质粒 pRL-TK 作为内参照,以较正荧光。转染48 h后,按双荧光素酶报告基因检测试剂盒说明书裂解细胞、检测荧光。
1.2.4 pGL3- APT1 启动子活性检测 设立空白对照(即未转染组),分别将无启动子质粒 pGL3-Basic、阳性启动子质粒pGL3-Control及 APT1启动子质粒 pGL3- APT1转染至HepG2 细胞,转染48 h后,裂解细胞、检测荧光,以测定所构建的 pGL3- APT1 启动子双荧光素酶报告基因质粒中 APT1 基因启动子的活性。
1.2.5 preS2与 APT1 基因启动子的相互作用检测 以pcDNA3.1(-) 与 pGL3-Basic Vector 共转染组,pcDNA3.1(-) 与 pGL3-Control Vector共转染组, pcDNA3.1(-) 与 pGL3 - APT1 共转染组为对照,pcDNA3.1(-)-preS2与pGL3-APT1共转染组为实验组,转染HepG2细胞并检测报告荧光,以检测前S2蛋白对APT1 基因启动子的作用。
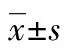
2 结 果
2.1 pcDNA3.1(-)-preS2重组质粒的构建 用PreS2基因引物扩增出的DNA片段大小与预期相符,将其克隆入 pcDNA3.1(-) 载体中构建pcDNA3.1(-)-preS2重组质粒,测序结果证实重组质粒构建与实验设计相符。
2.2 APT1启动子双荧光素酶报告基因质粒的构建 Berkeley Drosophila Genome Project数据库在线预测提示在APT1基因的-1 303~-1 247 bp、-888~-837 bp、-93~-43 bp、-4~+47 bp及+39~+89 bp出现了5个可能的启动子序列,其分值分别为:0.69、0.96、0.68、0.63、0.63.根据软件预测的分值及与转录起始点的相对位置,选取包括-888~-837 bp、-93~-43 bp及-4~+47bp的序列在内的一段APT1基因序列作为其启动子。设计引物扩增-1 164~+67 bp的片段,所设计的APT1启动子引物扩增出的DNA片段大小与预期相符,将其克隆入pGL3启动子双荧光素酶报告基因质粒,将获得的重组质粒pGL3- APT1送上海生物工程公司测序列,其结果证实重组质粒构建与实验设计相符。
2.3 pGL3-APT1启动子活性检测 荧光素酶活性检测提示,阴性对照pGL3-Basic Vector组无荧光素酶表达,细胞裂解液中荧光素酶的活性接近空白对照;阳性对照pGL3-Control组正常表达荧光素酶,其荧光素酶的活性为 pGL3-Basic组的5.1倍;pGL3-APT1组正常表达荧光素酶,其荧光素酶的活性为pGL3-Basic组6.1倍;略高于pGL3-Control组,表明pGL3-APT1中APT1的启动子具较强的启动子活性,见图1。
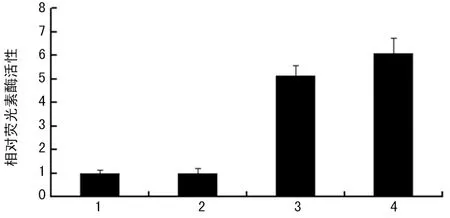
1:空白对照组(即未转染组);2:pGL3-Basic组;3:pGL3-Control组;4:pGL3-APT1组。
图1 pGL3-APT1 启动子活性检测结果
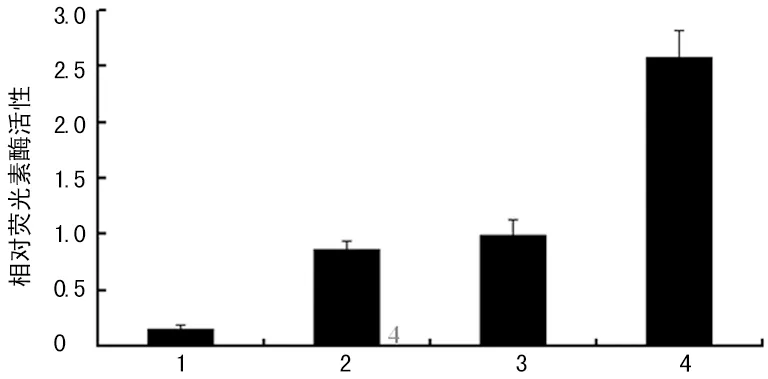
1:pcDNA3.1(-) 与 pGL3-Basic Vector 共转染对照组;2:pcDNA3.1(-) 与 pGL3-Control Vector共转染对照组;3:pcDNA3.1(-) 与 pGL3 - APT1 共转染对照组;4:pcDNA3.1(-)-preS2与pGL3-APT1共转染实验组。
图2 HBV PreS2与APT1基因的启动子的相互作用检测结果
2.4 HBV PreS2与APT1基因的启动子的相互作用检测 荧光素酶活性检测提示,pcDNA3.1(-)-preS2与pGL3-APT1共转染实验组、pcDNA3.1(-) 与pGL3-APT1共转染对照组、pcDNA3.1(-) 与 pGL3-Control Vector共转染对照组均有荧光素酶表达,而pcDNA3.1(-)与pGL3-Basic Vector共转染对照组无荧光素酶表达。其中pcDNA3.1(-)-preS2与pGL3 - APT1共转染实验组荧光素酶活性最高,为pcDNA3.1(-)与pGL3-APT1共转染对照组的2.6倍,显示preS2激活APT1启动子,见图2。
3 讨 论
由于HBV是具有泛嗜性感染的病毒,其感染的受累器官并不限于肝脏。因此,尽管preS2的反式调节作用已有大量的报道,但其对人体多种细胞、许多基因的作用以及由此产生的细胞生理病理变化仍待研究。
有研究指出,preS2激活一种具有磷脂酰基转移酶结构域的蛋白,即preS2反式激活蛋白1的基因[10],提示其可能参与细胞的磷脂代谢,影响细胞的磷脂信号分子水平。本研究的前期工作克隆了人亲磷脂酸磷脂酶A1(phosphatidic acid-preferring phospholipase A1,PA-PLA1)2种亚型基因(GenBank accession no.DQ315474和GU376468)。PA-PLA1在细胞内对磷脂酸进行水解,生成溶血磷脂酸。对小鼠分泌胰岛素细胞株MIN6行不同浓度和不同时间的葡萄糖刺激胰岛素分泌实验,结果显示MIN6细胞PA-PLA1基因的表达与胰岛素分泌呈正相关[11],沉默PA-PLA1基因可致胰岛素分泌降低[12]。此外,preS2可作用于胰岛素受体基因而下调胰岛素受体基因的表达[13]。这些研究结果提示,preS2可能在乙型肝炎并发糖尿病的发病、发展中发挥作用。
本研究观察preS2对人APT1启动子的作用。APT1是具有硫酯酶活性和磷脂酶活性的酶,因而也被称为APT1/溶血磷脂酶A1。APT1主要定位于细胞质,能对多种细胞生物学过程发挥重要的调节作用。一方面,APT1通过其硫酯酶活性参与蛋白质棕榈酰化修饰的调节。蛋白质棕榈酰化修饰是一个可逆的过程,由蛋白质酰基转移酶和硫酯酶双重调控。蛋白质酰基转移酶使蛋白质棕榈酰化,导致蛋白质的疏水性增加,在蛋白质的稳定、转运和定位过程中起到重要作用,同时使蛋白质的生理功能多样化[14]。而硫酯酶中APT1水解棕榈酰基使S型棕榈酰化蛋白去棕榈酰化修饰。另一方面,APT1还通过其磷脂酶活性调节溶血磷脂水平。溶血磷脂是活跃的脂类信号分子,可通过其特异的 G 蛋白耦联受体,在血小板激活、胰岛素分泌、细胞增殖以及肌动蛋白细胞骨架的重构等细胞过程中发挥关键调节作用[15-17]。目前还不清楚preS2对APT1基因的作用以及由此产生的对包括胰岛素分泌在内的细胞生理生化过程的影响。因此,探讨preS2对APT1启动子的作用,明确preS2对APT1基因表达的影响,将有助于阐明HBV感染导致的疾病发生、发展的分子机制。
应用生物信息学方法预测、分子克隆技术获得的人APT1启动子经启动子活性检测显示其活性与阳性对照启动子活性相同,甚至略高。这一结果表明本研究所克隆的人启动子序列具有很强的启动子活性。目前鲜有人APT1启动子功能的研究报道,该APT1启动子的克隆将为深入研究APT1在细胞的诸多生理和病理过程中的作用奠定实验基础。
HBV preS2真核表达质粒和人APT1启动子荧光素酶报告基因质粒共转染HepG2细胞的实验结果表明,preS2可激活人APT1启动子,因而提示preS2可上调APT1基因的表达。鉴于APT1参与机体多种细胞生物学过程,preS2对APT1启动子的激活作用意味着该病毒蛋白通过增加APT1的表达水平而对机体产生复杂的生理和病理影响。
综上所述,本研究克隆的人APT1启动子序列具有较强的启动子活性,preS2可激活APT1启动子。这些研究结果不仅有助于深入研究APT1在细胞的诸多生理和病理过程中的作用,而且有助于阐明HBV感染导致的疾病发生、发展的分子机制。
[1]World Health Organization.Hepatitis B fact sheet[EB/OL].[2014-07-28] http://www.who.int/mediacentre/factsheets/fs204/en/index.html.
[2]Li CH,Xu F,Chow S,et al.Hepatitis B virus X protein promotes hepatocellular carcinoma transformation through interleukin-6 activation of microRNA-21 expression[J].Eur J Cancer,2014,50(15):2560-2569.
[3]Lun YZ,Cheng J,Chi Q,et al.Transactivation of proto-oncogene c-Myc by hepatitis B virus transactivator MHBst167[J].Oncol Lett,2014,8(2):803-808.
[4]Zhang X,Gao L,Liang X,et al.HBV preS2 transactivates FOXP3 expression in malignant hepatocytes[J].Liver Int,2015,35(3):1087-1094.
[5]Ni Y,Sonnabend J,Seitz S,et al.The pre-S2 domain of the hepatitis B virus is dispensable for infectivity but serves a spacer function for L-protein-connected cirus assembly[J].J Virology,2010,84(8):3879-3888.
[6]Kemp LE,Rusch M,Adibekian A,et al.Characterization of a serine hydrolase targeted by acyl-protein thioesterase inhibitors in toxoplasma gondii[J].J Biol Chem,2013,288(38):27002-27018.
[7]Kong E,Peng S,Chandra G,et al.Dynamic Palmitoylation links cytosol-membrane shuttling of acyl-protein thioesterase-1 and acyl-protein thioesterase-2 with that of proto-oncogene h-ras product and growth-associated protein-43[J].J Biol Chem,2013,288(13):9112-9125.
[8]Satou M,Nishi Y,Yoh J,et al.Identification and characterization of acyl-protein thioesterase 1/lysophospholipase Ⅰ as a ghrelin deacylation/lysophospholipid hydrolyzing enzyme in fetal bovine serum and conditioned medium[J].Endocrinology,2010,151(10):4765-4775.
[9]Tian L,McClafferty H,Knaus HG,et al.Distinct acyl protein transferases and thioesterases control surface expression of calcium-activated potassium channels[J].J Biol Chem,2012,287(18):14718-14725.
[10]纪冬,刘妍,韩萍,等.乙型肝炎病毒前-S2蛋白反式激活蛋白1基因的克隆化研究[J].军医进修学院学报,2010,31(1):55-57.
[11]于婕,苏何玲,莫之婧,等.MIN6细胞中亲磷酸酯酶A1基因表达与胰岛素分泌关系的初步研究[J].中国现代医学杂志,2011,21(21):2576-2580.
[12]莫之婧,苏何玲,朱华,等.亲磷脂酸磷脂酶A1基因沉默降低MIN6细胞胰岛素分泌水平[J].实用医学杂志,2014,30(18):2872-2875.
[13]苏何玲,纪冬,韩萍,等.HBV前S2蛋白对胰岛素受体基因下调作用的研究[J].解放军医学杂志,2009,34(6):667-669.
[14]WetzelJ,HerrmannS,SwapnaLS,etal.Theroleofpalmitoylationforproteinrecruitmenttotheinnermembranecomplexofthemalariaparasite[J].J Biol Chem,2015,290(3):1712-1728.
[15]Bolen AL,Naren AP,Yarlagadda S,et al.The phospholipase A1 activity of lysophospholipase A-Ⅰlinks platelet activation to LPA production during blood coagulation[J].J Lipid Res,2011,52(5):958-970.
[16]Soga T,Ohishi T,Matsui T,et al.Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupled receptor[J].Biochem Biophys Res Commun,2005,326(4):744-751.
[17]Rancoule C,Attané C,Grès S,et al.Lysophosphatidic acid impairs glucose homeostasis and inhibits insulin secretion in high-fat diet obese mice[J].Diabetologia,2013,56(6):1394-1402.
Hepatitis B virus preS2 activates human acyl protein thioesterase 1 promoter*
YangYi,LiuJianxiang,LiHongyan,HuangHaixia,ShiYunlong,LiuYongming△,SuHeling▲
(InstitutionofBiochemistryandMolecularBiology,GuilinMedicalUniversity,Guilin,Guangxi541100,China)
ObjectiveTo investigate the trans-regulative effect of hepatitis B virus (HBV) preS2 on the promoter of human acyl protein thioesterase 1 (APT1) gene.MethodsThe promoter sequence of human APT1 gene was identified applying the software of bioinformatics.The APT1 promoter and HBV preS2 gene were amplified with PCR and cloned into pGL3 and pcDNA3.1(-) plasmids to construct the luciferase reporter gene plasmid of human APT1 gene promoter pGL3-APT1 and the preS2 eukaryotic expression plasmid pcDNA3.1(-)-preS2,respectively.The effect of the preS2 on the human APT1 gene promoter was examined by cotransfecting hepatocellular carcinoma cell HepG2 with pGL3-APT1 and pcDNA3.1(-)-preS2 and measuring luciferase activities of the HepG2 cells.The statistical data were analyzed with independent-samplesttest.ResultsBoth plasmids of pGL3-APT1 and pcDNA3.1(-)-preS2 were confirmed by DNA sequencing to be accurately constructed as design.The luciferase activity of the pGL3-APT1 was 1.2 times (P<0.01) that of the positive control plasmid pGL3-Control.And the luciferase activity of the HepG2 cells cotransfected with pcDNA3.1(-)-preS2 and pGL3-APT1 was 2.6 times (P<0.01) that of the HepG2 cells cotransfected with the plasmid without preS2 gene pcDNA3.1(-) and pGL3-APT1.ConclusionThe human APT1 promoter cloned in the study has high promoter activity;HBV preS2 activates human APT1 promoter.
hepatitis B,rivus;viral proteins;protein precursors;acyl protein thioesterase 1;promoter;transactivation
10.3969/j.issn.1671-8348.2015.29.012
国家自然科学基金资助项目(81460320);广西自然科学基金资助项目(2013GXNSFAA019233);广西壮族自治区研究生教育创新计划资助项目(YCSZ2014205);广西高等学校优秀中青年骨干教师培养工程资助成果。
:杨易(1988-),在读硕士,主要从事分子病理学研究。△
,Tel:13737700363;E-mail:liuym@glmc.edu.cn;▲通讯作者,Tel:13978348621;E-mail:helingsu@glmc.edu.cn。
R373.2
A
1671-8348(2015)29-4063-03
2015-04-15
2015-05-16)
