人AQP1-shRNA表达质粒载体的构建与筛选*
2015-01-07李建华
李 卓,康 炜,辛 娜,田 宇,李建华
(西安医学院第一附属医院检验科 710077)
·论 著·
人AQP1-shRNA表达质粒载体的构建与筛选*
李 卓,康 炜△,辛 娜,田 宇,李建华
(西安医学院第一附属医院检验科 710077)
目的构建针对人水通道蛋白1(AQP1)基因的shRNA表达质粒载体,并验证其干扰效果,为进一步探讨AQP1 基因对人乳腺癌细胞的作用及机制建立基础。方法设计合成4对针对人AQP1基因不同位点的shRNA片段,通过DNA重组技术将其插入载体GV115中,构建AQP1-shRNA重组质粒,转染人乳腺癌MCF-7细胞,并通过实时荧光定量PCR(RT-PCR)和Western blot法检测干扰效率。结果RT-PCR法证实AQP1在乳腺癌MCF-7细胞中有表达。测序验证表明4对靶向AQP1-shRNA表达载体均构建成功。4组干扰载体能够从基因和蛋白表达水平不同程度抑制AQP1表达,其中以AQP1-shRNA 4对AQP1的干扰效率最强。结论成功有效地构建了针对人AQP1基因的shRNA重组质粒,能够有效抑制人乳腺癌细胞MCF-7中AQP1的表达。
乳腺肿瘤;人水通道蛋白1;shRNA
RNA干扰技术可以使目的基因表达受抑,现已广泛应用于肿瘤的分子治疗研究[1]。水通道蛋白(aquaporin,AQP)是一族广泛存在于生物细胞膜上的能高效特异转运水的膜通道蛋白,在其众多成员中目前对水通道蛋白1(aquaporin1,AQP1)的研究最为深入[2]。前期研究中笔者已证实乳腺癌组织中广泛表达AQP1蛋白,且发现其表达水平与肿瘤淋巴结转移及微血管生成关系密切,提示AQP1可能参与了乳腺癌的发生、发展[3]。本研究采用RNA干扰特异性沉默乳腺癌MCF-7细胞AQP1基因的表达,通过检测AQP1 mRNA和蛋白的表达情况评价其抑制作用,探讨RNA干扰AQP1在乳腺癌基因治疗中的可行性,以期为乳腺癌的治疗提供新的依据。
1 材料与方法
1.1 材料 人乳腺癌MCF-7细胞株由本院中心实验室提供。LipofectamineTM2000及Trizol均购自Invitrogen公司。限制性内切酶AgeⅠ、EcoRⅠ,T4 DNA连接酶,Prime ScriptTMRT regent Kit及SYBR®Premix Ex TaqTM试剂均购自TAKARA公司。GV115 vector为上海吉凯公司产品。兔抗人AQP1单克隆抗体购自Santa Cruz公司,兔抗人β-actin抗体购自Abcam公司。DH5α感受态细胞购自天根生化科技有限公司。
1.2 方法
1.2.1 细胞培养 乳腺癌MCF-7细胞,采用含10%小牛血清、100 μ/mL青/链霉素的RPMI 1640培养基,37 ℃,5% CO2培养箱中常规传代培养。
1.2.2 实时荧光定量PCR(RT-PCR)检测MCF-7细胞中AQP1基因的表达
1.2.2.1 细胞总RNA提取 对数生长期的细胞用磷酸盐缓冲液(PBS)清洗2次,采用Trizol试剂提取总RNA,用紫外分光光度计进行RNA定量,并采用1%琼脂糖凝胶电泳观察RNA提取质量。
1.2.2.2 RT-PCR RT-PCR扩增按照TaKaRa RNA PCR Kit说明书进行,将总RNA逆转录合成cDNA,再以其为模板,采用AQP1基因特异性引物进行PCR扩增反应。PCR反应体系25 μL,反应条件为:95 ℃预变性30 s,95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30 s,30个循环。PCR产物于2%琼脂糖凝胶上电泳,用凝胶图像分析仪观察结果。AQP1基因引物序列为:上游,5′-GAT CAC ACA CAA CTT CAG CAA CCA-3′;下游,5′-TTC ACG CGG TCT GTG AGG TC-3′,扩增产物126 bp,由TAKARA公司合成。
1.2.3 构建AQP1-shRNA重组质粒载体
1.2.3.1 shRNA的设计 根据GeneBank中人AQP1基因的已知序列,选择其基因编码区的4个19nt的寡核苷酸序列作为靶点(表1),设计并合成与之对应的cDNA模板序列,分别命名为AQP1-1,AQP1-2,AQP1-3,AQP1-4(表2),由上海吉凯公司合成,同时以一条无意序列作为阴性对照。
1.2.3.2 shRNA表达载体的构建和鉴定 将合成的目的基因片段稀释成100 μmol/L,各取5 μL配对混合后于PCR仪中95 ℃,5 min,室温静置20 min,形成双链DNA片段。同时,使用AgeⅠ和EcoRⅠ对GV115载体于37 ℃,4 h进行酶切。将干扰片段分别与线性化的GV115质粒表达载体进行连接,16 ℃反应过夜。取连接产物转化至DH5α感受态细胞中,于含氨苄霉素抗性的LB培养板上过夜培养,挑取阳性菌落,扩增提取质粒,行测序鉴定。分别命名为AQP1-shRNA1、AQP1-shRNA2、AQP1-shRNA3和AQP1-shRNA4,阴性对照命名为Con-shRNA。
1.2.4 重组质粒转染人乳腺癌MCF-7细胞 收集对数生长期细胞,调整浓度为1×105个/孔,按每孔2 mL加入6孔板中,待细胞对数生长期时进行转染。实验分6组,分别为空白对照组、对照shRNA组和转染组(4个AQP1-shRNA组),每组设3复孔。具体操作按照Invitrogen公司LipofectamineTM2000试剂说明书进行。每孔加入4 μg质粒,将其与脂质体按比例组成的复合物逐滴加入6孔板中,轻轻晃动使其分布均匀。正常对照组每孔加入等体积的RPMI 1640培养基(不含血清和抗生素)。37 ℃,5% CO2培养箱中培养6 h,之后更换含有血清的新鲜培养基,置37 ℃,5% CO2培养箱中继续培养。
1.2.5 shRNA 对MCF-7细胞AQP1表达抑制率的检测
1.2.5.1 RT-PCR法检测AQP1 mRNA的表达 转染48 h后,提取细胞总RNA,逆转录合成cDNA,以其为模板,采用SYBR®Premix Ex TaqTM试剂进行RT-PCR,20 μL反应体系,包括10 μL 2×SYBR®Premix Ex TaqTM,正、反向引物(10 μmol/L)各0.4 μL,ROX Reference Dye Ⅱ 0.4 μL,cDNA 2.0 μL,双蒸水6.8 μL。各设3个平行复孔,使用ABI 7500快速RT-PCR仪,反应条件为:95 ℃ 30 s预变性,95 ℃ 3 s、60℃ 30 s,40个循环。反应结束后确认扩增曲线和溶解曲线。AQP1基因所采用的PCR反应引物与1.2.2.2 RT-PCR引物序列相同。此外,同时引入β-actin基因作为内参,引物序列为:上游,5′-TGG CAC CCA GCA CAA TGA A-3′;下游,5′-CTA AGT CAT AGT CCG CCT AGA AGG A-3′,由TAKARA公司合成。AQP1的相对表达量采用2-ΔΔCT法进行计算,并用GraphPad Prism 5软件进行分析和绘图。
1.2.5.2 Western blot法检测AQP1蛋白的表达 细胞转染48 h后,提取细胞总蛋白,采用BCA法定量。配制12%的凝胶进行SDS-PAGE电泳,电转膜,封闭,洗膜后分布加入一抗(兔抗人AQP1抗体1∶1 000稀释,兔抗人β-actin抗体1∶2 000稀释),4 ℃过夜,TBST洗膜,加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000稀释),采用Odyssey红外荧光扫描成像系统进行结果扫描。
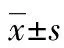
2 结 果
2.1 AQP1在乳腺癌MCF-7细胞中有表达 采用RT-PCR法,所得产物经过琼脂糖凝胶电泳,可以看到126 bp处有明显条带,证实AQP1在乳腺癌细胞MCF-7中有表达,见图1。

M:DL2000 DNA Marker;1:MCF-7细胞。
图1 RT-PCR检测人乳腺癌MCF-7细胞中的AQP1 mRNA
2.2 重组质粒鉴定及转染率检测 构建的重组质粒载体AQP1-shRNA经DNA测序比对,证实插入序列与所设计的DNA序列完全一致,无突变碱基,表明靶向AQP1基因的shRNA质粒表达载体构建成功,见图2。重组质粒在脂质体介导下转染人乳腺癌MCF-7细胞,转染6 h后,倒置相差荧光显微镜下即可观察到MCF-7细胞内逐渐出现绿色荧光,48 h时荧光强度最强,根据转染细胞的荧光判断其转染效率约为50%,见图3。

表1 APQ1靶序列信息

表2 AQP1-shRNA序列信息

A:AQP1-shRNA1组;B:AQP1-shRNA2组;C:AQP1-shRNA3组;D:AQP1-shRNA4组。
图2 AQP1-shRNA重组质粒测序峰图

图3 荧光显微镜观察AQP1-shRNA重组质粒转染48 h后的MCF-7细胞(×200)

1:空白对照组;2:对照shRNA组;3:AQP1-shRNA1组;4:AQP1-shRNA2组;5:AQP1-shRNA3组;6:AQP1-shRNA4组;*:P<0.05,与空白对照组比较。
图4 AQP1-shRNA转染MCF-7细胞后AQP1 mRNA的表达量
2.3 AQP1-shRNA对MCF-7细胞中AQP1 mRNA水平的抑制作用 RT-PCR检测结果表明,各转染组和对照组均有AQP1和内参β-actin的特异性扩增,扩增曲线平滑,溶解曲线特异。经2-ΔΔCT法分析,转染组细胞的AQP1 mRNA表达水平呈不同程度降低,抑制率分别为32.37%、36.63%、53.20%和70.54%,见图4。
2.4 AQP1-shRNA对MCF-7细胞中的AQP1蛋白表达的抑制作用 Western blot法检测结果显示,与空白对照组比较,4组AQP1-shRNA转染后MCF-7细胞中的AQP1蛋白表达量均不同程度减低,分别为0.70±0.06、0.68±0.03、0.45±0.06和0.29±0.04,其中以AQP1-shRNA4的表达量最低,见图5。

A:Western blot;B:蛋白表达量。1:空白对照组;2:对照shRNA组;3:AQP1-shRNA1组;4:AQP1-shRNA2组;5:AQP1-shRNA3组;6:AQP1-shRNA4组;*:P<0.05,与空白对照组比较。
图5 AQP1-shRNA转染MCF-7细胞后AQP1蛋白表达量
3 讨 论
近年来大量研究证实,机体内广泛存在着特异性水通道蛋白家族(aquaporins,AQPs)[4-5],目前已从动物组织中鉴定出13种水通道蛋白亚型(AQP0~12),其中对AQP1的研究最为深入[2,6]。AQP1分布广泛,具有特异转运水的功能。研究发现,AQP1可表达于多种肿瘤组织中,它可能与肿瘤细胞的起源、生长及转移等密切相关[7-9]。AQP1最早发现与多发性骨髓瘤微血管形成有关[10],Saadoun等[11]在微血管内皮细胞中也发现AQP1的高度表达,推测AQP1也可能与肿瘤的血管新生、发展有关 。有研究显示,AQP1还参与细胞周期的调控,在细胞无限制复制过程中发挥着一定作用。正因为AQP1与多种疾病的发生、发展密切相关,目前已成为众多学者研究的热点。但有关AQP1在乳腺癌发生、转移过程中的作用及对乳腺癌细胞生长的影响目前国内外尚少有报道。前期研究中,笔者采用免疫组织化学法,对106例乳腺癌组织及作为对照的20例癌旁正常组织中AQP1表达情况进行了检测,结果表明,乳腺癌组织中广泛表达AQP1蛋白,且发现其表达水平与肿瘤淋巴结转移及微血管生成关系密切,提示AQP1可能参与了乳腺癌的发生、发展[3]。
RNA干扰技术,是通过双链RNA分子介导的序列特异性转录后使相关基因表达减少或不表达的过程,能够使目的基因稳定沉默且对其他正常基因的表达不造成影响,该技术现已被广泛应用于肿瘤基因治疗的研究领域[1,12-13]。采用RNAi技术沉默靶基因,探讨其在肿瘤细胞中的表达情况及其对肿瘤细胞生物学特性的影响,并观察其抗肿瘤作用,对研究肿瘤的基因治疗具有重要意义。
本研究采用RT-PCR法证实AQP1 mRNA在人乳腺癌MCF-7细胞中有表达,再次印证了前期临床组织学实验的结果[3]。在此基础上,笔者针对AQP1 mRNA 的不同靶点设计并合成了4个shRNA,构建了靶向AQP1的shRNA重组质粒,经测序分析证实载体构建成功。将4个shRNA重组质粒分别转染人乳腺癌MCF-7细胞后,通过检测AQP1 mRNA和蛋白表达水平评价该载体对AQP1表达的抑制作用。RT-PCR和Western blot检测结果显示,4个AQP1-shRNA转染后均可不同程度降低AQP1 mRNA和蛋白表达水平,其中以AQP1-shRNA4的沉默效应最为显著。据此,结合前期回顾性临床研究结果,笔者推测抑制AQP1基因的表达有可能会抑制肿瘤的血管新生及其通透性,并抑制肿瘤的侵袭和转移能力,这为乳腺癌的基因治疗开辟了新的思路。
然而,本研究的局限性是,关于AQP1蛋白表达量降低对乳腺癌MCF-7细胞生物学行为的影响,及其在肿瘤发生、发展及转移等生物学特性变化方面的影响,还有待进一步验证。
[1]Gaynor JW,Campbell BJ,Cosstick R.RNA interference:a chemist′s perspective[J].Chem Soc Rev,2010,39(11):4169-4184.
[2]El Hindy N,Bankfalvi A,Herring A,et al.Correlation of aquaporin-1 water channel protein expression with tumor angiogenesis in human astrocytoma[J].Anticancer Res,2013,33(2):609-613.
[3]李卓,康炜,刘凯歌,等.水通道蛋白1与乳腺癌组织微血管生成的关系[J].山西医科大学学报,2011,42(9):732-734.
[4]Hu J,Verkman AS.Increased migration and metastatic potential of tumor cells expressing aquaporin water channels[J].FASEB J,2006(20):1892-1894.
[5]Jeyaseelan K,Sepramaniam S,Armugam A,et al.Aquaporins:a promising target for drug development[J].Expert Opin Ther Targets,2006(10):889-909.
[6]Itoh T,Rai T,Kuwahara M,et al.Identification of a novel aquaporin,AQP12,expressed in pancreatic acinar cells[J].Biochem Biophys Res Commun,2005,330(3):832-838.
[7]Mobasheri A,Airley R,Hewitt SM,et al.Heterogeneous expression of the aquaporin 1(AQP1) water channel in tumors of the prostate,breast,ovary,colon and lung:a study using high density multiple human tumor tissue microarrays[J].Int J Oncol,2005,26(5):1149-1158.
[8]Yang JH,Shi YF,Cheng Q,et al.Expression and localization of aquaporin-5 in the epithelial ovarian tumors[J].Gynecol Oncol,2006,100(2):294-299.
[9]王晨宇,刘连新,姜洪池.肿瘤与水通道蛋白关系的研究进展[J].中华实验外科杂志,2007,24(7):891-892.
[10]Endo M,Jain RK,Witwer B,et al.Water channel (aquaporin 1) expression and distribution in mammary carcinomas and gliblastomas[J].Microvasc Res,1999,58(2):89-98.
[11]Saadoun S,Papadopoulos MC,Davies DC,et al.Increased aquaporin 1 water channel expression in human brain tumours[J].Br J Cancer,2002,87(6):621-623.
[12]Matheis F,Besch R.Bifunctional siRNAs for Tumor Therapy[J].Methods Mol Biol,2014(1169):181-192.
[13]Stigliano C,Aryal S,de Tullio MD,et al.siRNA-chitosan complexes in poly(lactic-co-glycolic acid) nanoparticles for the silencing of aquaporin-1 in cancer cells[J].Mol Pharm,2013,10(8):3186-3194.
Construction and screening of human AQP1 shRNA expression vectors*
LiZhuo,KangWei△,XinNa,TianYu,LiJianhua
(DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalofXi′anMedicalUniversity,Xi′an,Shaanxi710077,China)
Objective To construct and screen effective shRNA expression vectors targeting human AQP1 gene,and evaluate the interference efficiency of the AQP1 shRNA recombinant plasmids,thus provide basis for further exploration on the effect and mechanism of AQP1 gene on human breast cancer cells.MethodsFour pairs of shRNA sequences targeting human AQP1 gene were designed and synthesized,and then inserted into the GV115 vector.AQP1 shRNA and control shRNA plasmids were transfected into human breast cancer MCF-7 cells.The expression of AQP1 mRNA and protein were detected by real time PCR(RT-PCR) and Western blot to evaluate the interfering efficiency.ResultsRT-PCR demonstrated that AQP1 was expressed in human breast cancer MCF-7 cells.Sequencing showed that the shRNA vectors targeting AQP1 were successfully constructed.48 h after the AQP1 shRNA transfection,AQP1 mRNA and protein expression levels in MCF-7 cells were reduced to a significant degree,and the AQP1 shRNA 4 plasmid vector could inhibit the AQP1 most efficiently.ConclusionThe AQP1 shRNA recombinant plasmids vectors were successfully constructed and can significantly inhibit the expression of AQP1 in MCF-7 human breast cancer cells.
breast neoplasms;aquaporin1;shRNA
10.3969/j.issn.1671-8348.2015.30.003
陕西省教育厅专项科研计划项目(12JK0768)。
:李卓(1982-),在职博士,主治医师,讲师,主要从事肿瘤生物治疗研究工作。△
,Tel:(029)84277601;E-mail:kang_wei2008@163.com。
R73-36+2
A
1671-8348(2015)30-4183-04
2015-03-01
2015-05-23)
