辛硫磷对家蚕细胞周期蛋白家族基因转录活性的影响
2015-01-07刘丽华沈卫德
刘丽华,沈卫德,李 兵
(1 通化师范学院 生物系,吉林 通化 134000;2 苏州大学 基础医学与生物科学学院,江苏 苏州 215123)
辛硫磷对家蚕细胞周期蛋白家族基因转录活性的影响
刘丽华1,沈卫德2,李 兵2
(1 通化师范学院 生物系,吉林 通化 134000;2 苏州大学 基础医学与生物科学学院,江苏 苏州 215123)
【目的】 探讨经辛硫磷诱导后,家蚕细胞周期蛋白家族基因(CyclinA、CyclinB、CyclinB3、CyclinE)在5龄幼虫各种组织中的转录活性,为进一步研究有机磷农药对家蚕的损伤机制提供参考。【方法】 采用实时荧光定量PCR方法,以饲喂清水浸泡过的桑叶为对照,分析家蚕5龄3 d幼虫喂食辛硫磷(4 μg/mL)浸泡桑叶24 h后,脑、脂肪体、中肠、丝腺、马氏管、精巢及卵巢等7种组织中4种细胞周期蛋白家族基因的转录水平。【结果】 与对照组相比,辛硫磷诱导24 h后,CyclinA、CyclinB、CyclinB3在各组织中均表达上调,CyclinE在中肠及脂肪体中表达显著下调,在精巢与马氏管中无明显变化,在其他组织中则表达上调。【结论】 辛硫磷诱导24 h后,家蚕组织中CyclinA、CyclinB及CyclinB3基因表达上调,这可能是家蚕对磷胁迫的响应;CyclinE在中肠及脂肪体中表达显著下调,这与这2种器官是家蚕重要的解毒代谢器官有关。
家蚕;辛硫磷 ;细胞周期蛋白;基因转录
细胞周期蛋白(Cyclin)是一类随着细胞周期变化而周期性出现和消失的蛋白,具有种属和组织特异性,其在从酵母到人类等真核生物中都具有广泛的作用。细胞周期蛋白的共同特点是具有100~150个氨基酸组成的周期蛋白盒保守序列,细胞靠此结构域与细胞周期蛋白依赖性激酶(Cyclindependent kinase,CDK)结合形成活性复合物,对细胞周期的启动及各时相的转换起关键性调控作用[1]。细胞周期蛋白的表达具有典型的周期性和时相特异性,其可作为调节亚基与相应的CDK形成复合物,并正调节CDK的活性。不同的细胞周期蛋白在不同时相可通过相应的CDK起促进细胞完成周期的作用[2]。
目前,在哺乳动物中已发现了20多种细胞周期蛋白家族成员,其中家蚕体内报道了6种,即CyclinA、CyclinB、CyclinB3、CyclinE、CyclinL1和CyclinH,这6种都是家蚕细胞完成细胞周期必不可少的。通过RNA干涉技术下调家蚕CyclinA基因能有效地抑制细胞增殖,使细胞周期阻滞于G1期[3];CyclinB及 CyclinB3同属于B型周期蛋白,是家蚕细胞周期M期的限速因素[4];CyclinE基因在家蚕细胞G1/S期起重要作用[5];CyclinL1基因与家蚕胚胎期滞育及非滞育性卵的发育调控相关[6];CyclinH在家蚕发育分化过程中可能对其他周期蛋白的表达有调控作用[7]。
家蚕是我国重要的经济昆虫,由于其长期在室内饲养,对外界不良环境的抗性较弱,尤其对农药的抵抗能力更弱[8],在生产过程中,常由于农药中毒而造成家蚕大量减产。有机磷农药是目前我国农业生产上使用较广泛的农药之一,它主要通过抑制其靶标物乙酰胆碱酯酶的活性而使昆虫中毒死亡[9]。有机磷对家蚕的危害,还表现在对食物消化、生长、繁殖、氧化应激及生理状态的影响等方面[10-12]。目前此方面已有研究主要集中在有机磷农药与家蚕抗性的关系方面,而关于有机磷农药对家蚕细胞周期调控因子的影响尚未见报道。为此,本试验采用实时定量PCR方法检测辛硫磷农药诱导24 h后,家蚕5龄3 d幼虫各种组织中细胞周期蛋白家族基因CyclinA、CyclinB、CyclinB3、CyclinE表达水平的变化,以期为进一步研究有机磷农药对家蚕的损伤机制提供参考。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫 供试家蚕品种为大造,由苏州大学蚕桑实验室提供,于(25±1) ℃、湿度60%~75%条件下用桑叶饲养。
1.1.2 主要试剂 辛硫磷购自Sigma公司;总RNA抽提试剂盒Trizol-A、 M-MLV反转录试剂盒、SYBR PrimeScriptTMRT-PCR试剂盒及其他化学试剂,均购自宝生物工程(大连)有限公司。引物由上海生工生物工程技术服务有限公司合成。
1.2 方 法
1.2.1 试验处理 供试家蚕饲养至5龄3 d时,将桑叶分别浸泡于用丙酮稀释至4 μg/mL的辛硫磷药液(其LC50=7.86 μg/mL)[13](即试验组)和清水(即对照组)中,3 s后取出晾干,分别饲喂家蚕。24 h后分别采集试验组与对照组家蚕的脑、脂肪体、中肠、丝腺、马氏管、精巢及卵巢等组织,冻存于液氮中,备用。
1.2.2 家蚕组织总RNA的提取及cDNA的制备 按照Trizol-A 试剂盒说明书的方法,分别提取试验组与对照组5龄3 d家蚕幼虫各组织的总RNA,用紫外分光光度计测定其纯度和浓度。用M-MLV反转录试剂盒将提取的各组织RNA分别反转录成cDNA,备用。
1.2.3 实时荧光定量PCR分析 采用Primer 5.0软件,按照Real-time PCR要求设计Actin3内参基因和CyclinA、CyclinB、CyclinB3、CyclinE基因的引物(表1)。以合成的cDNA为模板,采用SYBR PrimeScriptTMRT-PCR试剂盒对各基因进行实时荧光定量PCR,具体步骤按照试剂盒说明书进行,反应体系为20 μL。反应程序为:95 ℃变性1 min,95 ℃ 15 s,60 ℃ 31 s,40个循环。反应过程由ABI 7300测定仪软件自动设定,每种组织样品重复3次。
1.2.4 数据处理 用ABI 7300仪器自带的Sequence detection software version 1.3.1软件处理RT-PCR数据,并参照文献[14]的方法进行效率校正。图表采用SPSS 16.0软件制作。
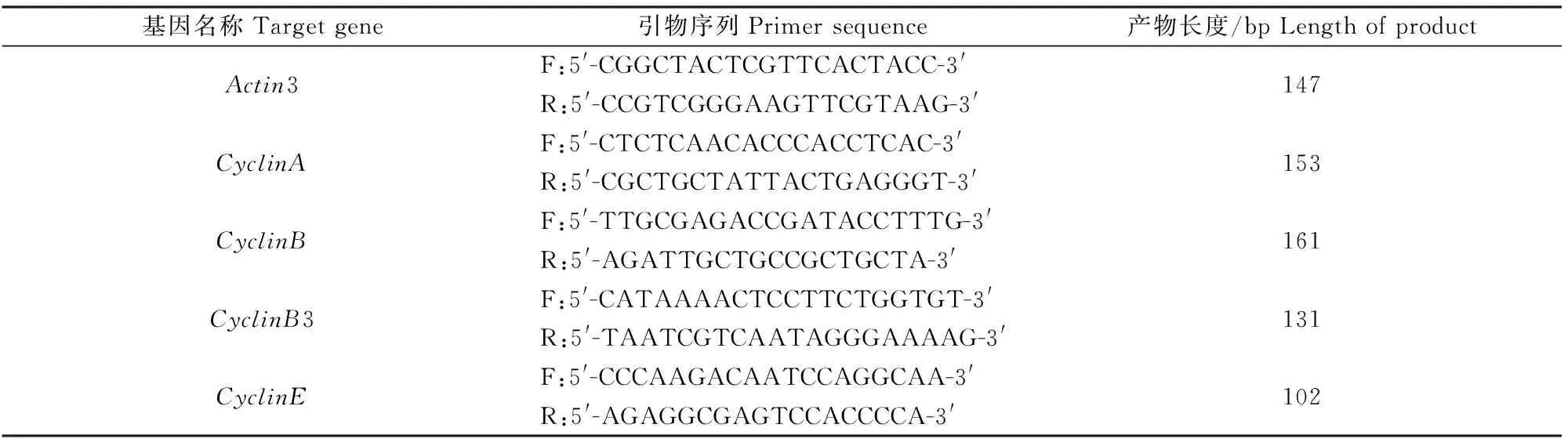
表1 实时荧光定量PCR检测基因和内参基因的引物Table 1 Primers for real-time fluorescent quantitative PCR to detect transcriptions of target and internal reference genes
2 结果与分析
2.1 辛硫磷诱导对家蚕CyclinA基因转录活性的影响
图1表明,与对照组比,辛硫磷诱导组家蚕各个组织中CyclinA基因表达量均显著上调,尤以丝腺、脑、精巢和卵巢上升明显;对照组家蚕中肠、脂肪体、丝腺及马氏管中几乎检测不到CyclinA基因的表达,但经辛硫磷诱导后,CyclinA基因表达显著提高,这可能是由于CyclinA存在不同的剪接变体[15],在辛硫磷的刺激下,某些CyclinA剪接变体由原来的沉默状态被激活,导致表达提高。
2.2 辛硫磷诱导对家蚕CyclinB及CyclinB3基因转录活性的影响
图2和图3显示,无论是对照组还是处理组家蚕,其CyclinB和CyclinB3基因在不同组织中的转录水平表现均基本一致:在中肠、丝腺、马氏管中未表达,而在其他几种组织中,除脂肪体外,试验组家蚕CyclinB及CyclinB3基因表达量均显著提高,尤以精巢及卵巢为甚,表明辛硫磷对家蚕生殖细胞CyclinB及CyclinB3基因表达的影响较大。

图1 辛硫磷诱导对家蚕CyclinA基因在各组织中转录的影响1.中肠;2.脂肪体;3.丝腺;4.脑;5.马氏管;6.精巢; 7.卵巢; 同一组织不同处理相比,标不同小写字母表示差异显著(P<0.05)。图2~4同

图2 辛硫磷诱导对家蚕CyclinB基因在各组织中转录的影响Fig.2 Transcription levels of CyclinB gene in various tissues of Bombyx mori larvae before and after induction with phoxim

图3 辛硫磷诱导对家蚕CyclinB3基因在各组织中转录的影响Fig.3 Transcription levels of CyclinB3 gene in various tissues of Bombyx mori larvae before and after induction with phoxim
2.3 辛硫磷诱导对家蚕CyclinE基因转录活性的影响
如图4所示,与对照组相比,辛硫磷诱导组家蚕丝腺、脑及卵巢中CyclinE基因表达量均显著上调,而中肠、脂肪体显著下调,精巢和马氏管中无明显变化。
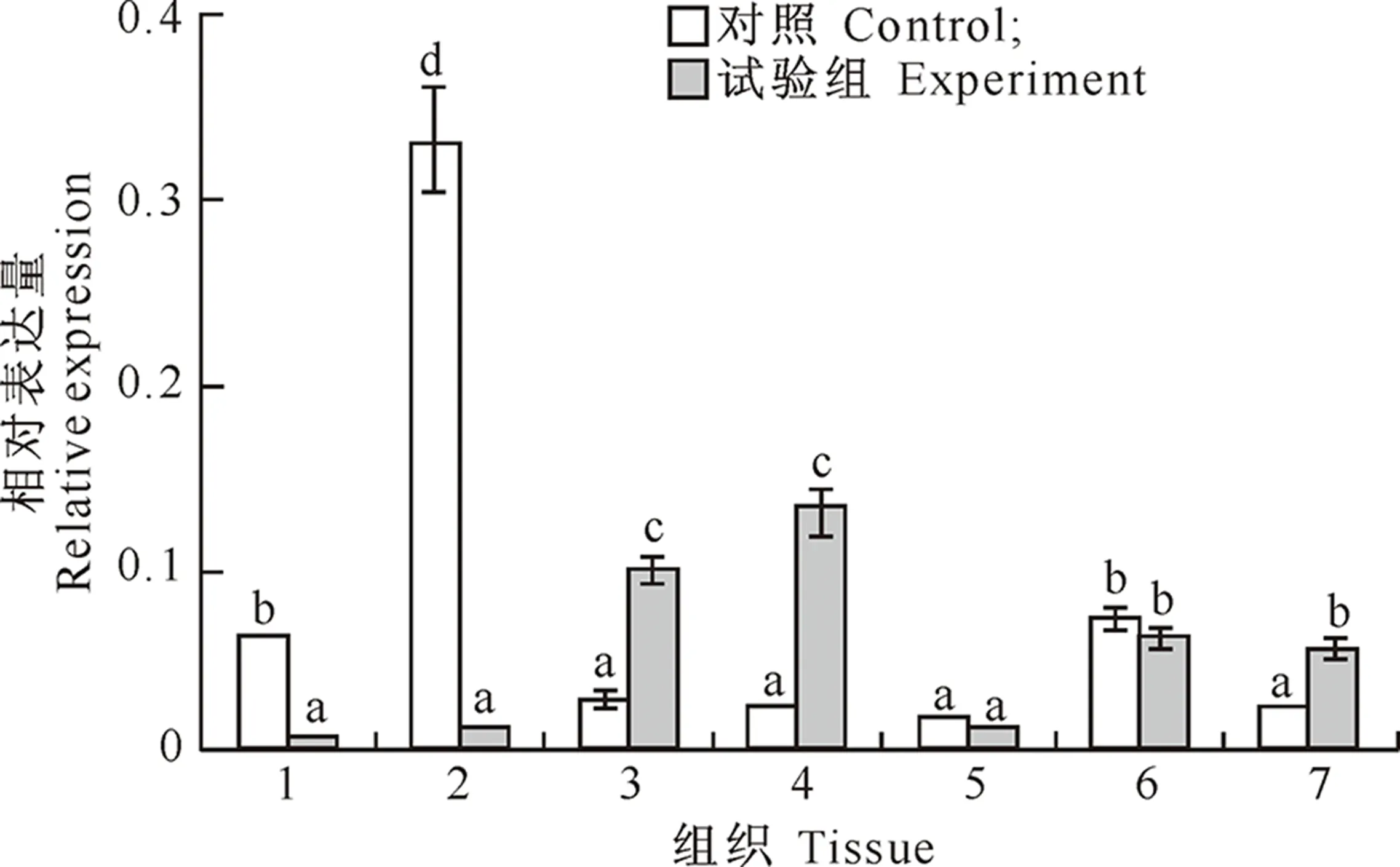
图4 辛硫磷诱导对家蚕CyclinE基因在各组织中转录的影响
3 讨 论
本研究结果显示,无论是对照组还是处理组,5龄3 d家蚕细胞周期蛋白家族基因在各组织中的转录水平均存在差异。对照组家蚕除CyclinE在脂肪体中高表达外,CyclinA、CyclinB、CyclinB3都是在精巢中表达量最高,而在其他组织中表达量相对较低,表明这3个基因在家蚕精母细胞形成精子的过程中发挥重要作用。这与笔者前期的研究结果[16]相同。
CyclinA能分别与CDK2和CDC2作用,推动细胞进入并通过细胞周期的S期和M期[17]。CyclinB及 CyclinB3是细胞周期M期的限速因素[4]。经辛硫磷诱导后,CyclinA、CyclinB、CyclinB3在家蚕各组织中的表达量均显著提高,推测其原因是家蚕受到辛硫磷刺激后,机体发生了一系列代谢变化,并动员机体的代偿适应功能来抵抗和适应各种应激反应,而应激反应分为应激适应和应激损伤2个不同的阶段,因此推测辛硫磷诱导24 h后,家蚕各种组织细胞处于应激适应阶段,通过上调CyclinA、CyclinB及CyclinB3基因表达,加速各种组织细胞的分裂进程。这可能是家蚕抵抗组织损伤,提高自身防御能力的一种措施。随着诱导时间的延长,一旦机体不能适应,应激损伤便随之发生,已有研究表明,有机磷能导致大鼠卵巢与精巢呈现衰退性变化[18-19]。本试验中家蚕的应激损伤发生在诱导后多长时间还有待于进一步研究。
CyclinE属于G1期细胞周期蛋白,其通过与CDK2结合,促进G1/S期进程,使细胞进入S期后就不再依赖于细胞外促生长因子而顺利完成整个细胞周期[20]。在本试验中,对照组家蚕CyclinE基因在脂肪体中转录水平最高,这是由于家蚕脂肪体在5龄幼虫期以增加细胞数的方式迅速生长,而在添加辛硫磷后,CyclinE基因表达水平显著下调,推测这与脂肪体是家蚕解毒代谢的重要器官有关。
本试验采用荧光定量PCR方法,研究了5龄家蚕经辛硫磷诱导后,细胞周期蛋白家族基因CyclinA、CyclinB、CyclinB3、CyclinE的转录情况,明确了其在5龄家蚕不同组织中的转录水平,对于研究有机磷对家蚕的损伤机制具有重要的参考价值。
[1] Sanchez I,Dynlacht B D.Newinsights into cyclins,CDKs,and cell cyclecontrol [J].Semin Cell Dev Biol,2005,16(3):311-321.
[2] Kirsch T,Nickel J,Sebald W.BMP-2 antagonists e-merge from alterations in the low-affinity binding epitope forreceptor [J].EMBO,2000,19(12):3314-3324.
[3] 刘丽华,沈卫德,李 兵,等.家蚕细胞CyclinA基因的干涉对家蚕细胞增殖的影响 [J].南京农业大学学报,2015,38(1):168-171.
Liu L H,Shen W D,Li B,et al.RNA interference impact on silkwormCyclinAgene and cell proliferation [J].Journal of Nanjing Agricultural University,2015,38(1):168-171.(in Chinese)
[4] 潘敏慧,洪开丽,陈向云,等.BmCyclinB和BmCyclinB3是家蚕细胞周期进程所必需的 [J].中国科学:生命科学,2013,43(3):240-246.
Pan M H,Hong K L,Chen X Y,et al.BmCyclinBandBmCyclinB3 are required for cell cycle progression in the silkworm,Bombyxmori[J].Sci China Life Sci,2013,43(3):240-246.(in Chinese)
[5] 刘丽华,沈卫德,李 兵,等.siRNA-CyclinE对家蚕细胞增殖的影响 [J].西北农林科技大学学报:自然科学版,2013,41(4):22-25.
Liu L H,Shen W D,Li B,et al.Influence of siRNA-CyclinE to the distribution of the BmN cell proliferation [J].Journal of Northwest A&F University:Nat Sci Ed,2013,41(4):22-25.(in Chinese)
[6] 范兰芬,钟杨生,林健荣.家蚕细胞周期蛋白基因BmCcnL1的克隆及表达分析 [J].昆虫学报,2010,53(12):1325-1332.
Fan L F,Zhong Y S,Lin J R.Cloning and expression analysis of the cyclin geneBmCcnL1 in the silkwormBombyxmori[J].Journal of Insect Science,2010,53(12):1325-1332.(in Chinese)
[7] 江 艳.BmCycH基因及其在家蚕中表达特性的研究 [D].杭州:浙江理工大学,2010.
Jiang Y.Study on expression characteristics ofBmCycHgene in silkworm,Bombyxmori[D].Hangzhou:Zhejiang Sci-Tech University,2010.(in Chinese)
[8] 沈卫德,李 兵,季 平,等.野桑蚕和家蚕的环境适应性比较研究 [J].蚕业科学,2003,29(4):375-379.
Shen W D,Li B,Ji P,et al.Adaptability comparison of theBombyxmandarinaMoore andBombyxmoriL. to the environment [J].Science of Sericulture,2003,29(4):375-379.(in Chinese)
[9] Shang J Y,Shao Y M,Lang G J,et al.Expression of two types of acetylcholinesterase gene from the silkworm,Bombyxmori,in insect cells [J].Insect Science,2007,14(6):443-449.
[10] Yu Q Y,Fang S M,Zuo W D,et al.Effect of organophosphate phoxim exposure on certain oxidative stress biomarkers in the silkworm [J].Journal of Economic Entomology,2011,104(1):101-106.
[11] Li B,Wang D,Zhao H Q,et al.Comparative analysis of two acetylcholinesterase genes ofBombyxmandarinaandBombyxmori[J].African Journal of Biotechnology,2010,49(9):8477-8485.
[12] Li B,Wang Y H,Wang J M,et al.Cloning and expression analysis of acetylcholinesterase gene (Bm-AchE-1,Bm-AchE-2) from domesticated silkworm,Bombyxmori[J].Adv Mater Res,2011,175(6):13-18.
[13] Peng G D,Wang J M,Ma L,et al.Transcriptional characteristics of acetylcholinesterase genes in domestic silkworms (Bombyxmori) exposed to phoxim [J].Pesticide Biochemistry and Physiology,2011,101(3):154-158.
[14] Schefe J H,Lehmann K E,Buschmann I R,et al.Quantitative real-time RT-PCR data analysis:Current concepts and the novel “gene expression’s CT difference” formula [J].J Mol Med,2006,84:901-910.
[15] 刘丽华,李 兵,沈卫德.家蚕细胞周期素家族基因的克隆及结构特征与表达分析 [J].蚕业科学,2010,36(5):754-758.
Liu L H,Li B,Shen W D.Cloning,structural characterization and expression analysis of cyclin family genes in silkwormBombyxmori[J].Science of Sericulture,2010,36(5):754-758.(in Chinese)
[16] 刘丽华,沈卫德,李 兵,等.家蚕细胞周期蛋白家族基因在5龄幼虫组织中的表达谱分析 [J].西北农林科技大学学报:自然科学版,2012,40(11):13-17.
Liu L H,Shen W D,Li B,et al.Expression profile analysis of the cyclin gene in the silk gland cell from silkworm,Bombyxmori[J].Journal of Northwest A&F University:Nat Sci Ed,2012,40(11):13-17.(in Chinese)
[17] Bandaral.Cyclin A and the retinoblastoma gene product complex with a common transcrition factor [J].Nature,1991,352:249-251.
[18] Narayana K.Methyl parathion induces the formation of symplasts by round spermatid fusion and alters the biochemical parameters in the testis original [J].Morphologie,2007,91(4):173-179.
[19] Kaur S,Dhanju C K.Biochemical effects of some organophosphorus pesticides on the ovaries of albino rats [J].Indian J Physiol Pharmacol,2005,49(2):148-152.
[20] Berger C,Pallavi S K,Prasad M,et al.CyclinE acts under the control of Hox-genes as a cell fate determinant in the developing central nervous system [J].Cell Cycle,2005,4:422-425.
Effect of phoxim on transcriptional activities of cyclin family genes in silkworm (Bombyxmori)
LIU Li-hua1,SHEN Wei-de2,LI Bing2
(1DepartmentofBiology,TonghuaNormalUniversity,Tonghua,Jilin134000,China;2SchoolofBasicMedicineandBiologicalSciences,SoochowUniversity,Suzhou,Jiangsu215123,China)
【Objective】 This study investigated the effect of phoxim on transcriptional activities of cyclin genes (CyclinA,CyclinB,CyclinB3,andCyclinE) in various tissues of 5thBombyxmoriinstar larvae to provide reference for the damage mechanism of phoxim pesticides to silkworm.【Method】 The transcription levels of cyclin genes in seven organs including brain,fat body,midgut,silk gland,Malpighian tube,testis and ovary after feeding folium mori treated by phoxim (4 μg/mL) to 5thBombyxmoriwere analyzed by real-time fluorescence quantitative PCR with clear water as control.【Result】 Compared with the control group,transcriptional levels ofCyclinA,CyclinB,andCyclinB3 in various tissues were up-regulated 24 h after phoxim induction.CyclinEtranscriptional levels were significantly down-regulated in midgut and fat body,while it did not change significantly in testis and Malpighian tubules.Transcriptional levels ofCyclinEin other organs were unregulated.【Conclusion】 Increase of transcriptional levels ofCyclinA,CyclinBandCyclinB3 may be due to the response ofBombyxmorito phosphorus stress.The significant reduction ofCyclinEin midgut and fat body may be because midgut and fat body are detoxification metabolism organs.
Bombyxmori.;phoxim;cyclin;gene transcription
时间:2015-08-05 08:56
10.13207/j.cnki.jnwafu.2015.09.005
2014-02-28
国家自然科学基金项目(31072086);吉林省科技厅项目(20130101100JC);吉林省教育厅项目(2013493)
刘丽华(1972-),女,吉林通化人,副教授,博士,主要从事动物资源与功能基因组研究。E-mail:liulihua209@163.com
沈卫德(1951-),男,江苏苏州人,教授,博士,博士生导师,主要从事动物资源与功能基因组研究。 E-mail:shenwd@suda.edu.cn
S884.9+6
A
1671-9387(2015)09-0031-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150805.0856.010.html
