航天诱变对夏枯草SP1代生物学特性和迷迭香酸含量的影响
2015-01-07齐志鸿毛仁俊刘峰华韩蕊莲
马 楠,齐志鸿,毛仁俊,刘峰华,刘 岩,韩蕊莲
(1 西北农林科技大学 生命科学学院,陕西 杨凌 712100;2 天津天士力现代中药资源有限公司,天津 300402)
航天诱变对夏枯草SP1代生物学特性和迷迭香酸含量的影响
马 楠1,齐志鸿2,毛仁俊1,刘峰华2,刘 岩2,韩蕊莲1
(1 西北农林科技大学 生命科学学院,陕西 杨凌 712100;2 天津天士力现代中药资源有限公司,天津 300402)
【目的】 研究航天诱变处理对SP1代夏枯草生物学特性和迷迭香酸含量的影响,为夏枯草种质改良和品种选育提供参考。【方法】 以神舟八号飞船搭载的夏枯草种子和地面种子(对照)为材料,在夏枯草发育过程中观测记录表型生长指标;在夏枯草收获后,用高效液相色谱法检测其干燥果穗中的迷迭香酸含量,分析航天诱变对夏枯草的影响。【结果】 搭载组(SP)夏枯草的株高、主茎粗、分枝粗、果穗粗度、果穗长度、果穗数、地上部分干质量、地上部分鲜质量、果穗干质量、茎叶干质量等表型指标与对照组(CK)相比均有不同程度降低,其中分枝粗、果穗数、果穗粗度、果穗长度、地上部分干鲜质量、果穗干质量、茎叶干质量等指标差异达到极显著水平;搭载组(SP)夏枯草的抽薹期、开花期、盛花期、成熟期均较对照推后;搭载组(SP)干燥果穗中迷迭香酸含量总体较对照组(CK)有所升高,在SP1代中检测到6株含量极高的植株,但总体差异不显著;搭载组SP1代夏枯草生长过程中出现了多种表型变异。【结论】 航天诱变增大了夏枯草植株表型的突变率,总体而言对夏枯草表型生长具有抑制作用。
夏枯草;航天诱变;生物学特性;SP1代;迷迭香酸
夏枯草(PrunellavulgarisL.)为唇形科夏枯草属多年生草本植物,以干燥果穗入药,中医认为其具有清肝明目、消肿散结之功效[1]。现代药理学研究表明,夏枯草具有增强免疫力、降压降血糖和抗菌抗病毒作用[2-3],其主要药理活性物质为迷迭香酸。夏枯草是一种药食同源的经济作物,在我国的河南、安徽、江西等地广泛种植[4-5]。目前,国内外对夏枯草主要开展了栽培技术[6-8]、质量标准[9-12]、活性成分提取与含量分析[13-18]、药理作用[19]等多方面的研究。随着国内外药材和食品市场对夏枯草需求量的逐年增大,传统农家种植夏枯草的产量和品质已不能满足市场要求,而对夏枯草优良品种培育的研究却鲜有报道。
夏枯草传统家种品种单一,通过常规育种途径进行改良的难度很大。而利用太空特殊环境进行诱变的航天育种技术能促使植物细胞发生突变,产生新品种[20-22]。因此,本研究对夏枯草种子进行了航天搭载,对诱变种子SP1代植株的表型生长和迷迭香酸含量进行了初步研究,以期为夏枯草的种质改良和品种选育提供参考。
1 材料与方法
1.1 材 料
精选当年优质夏枯草种子(天津天士力现代中药资源有限公司提供),经西北农林科技大学梁宗锁教授鉴定为夏枯草(PrunellavulgarisL.)。将夏枯草种子分成2份,一份进行太空搭载试验,命名为搭载组(SP),另一份留作地面对照,命名为对照组(CK)。
1.2 仪器和试剂
Waters 1525二元高效液相色谱仪、Waters 2996 二极管阵列检测器、Waters SunFire C18色谱柱(250 mm×4.6 mm,5 μm)和Empower 2 色谱分析软件,均购自美国Waters公司;超纯水机,购自上海优普科技有限公司。
色谱级甲醇,购自Fisher scientific(Fairlawn,NJ,USA);色谱级磷酸、无水乙醇,购自西安试剂厂;迷迭香酸标准品(Rosmarinic acid,批号20120809),购自上海源叶生物科技有限公司。
1.3 种子的航天诱变方法
利用神州八号飞船搭载夏枯草种子进行航天诱变处理。于2011-11-01 05:58:10,神州八号飞船由改进型“长征二号”F遥八火箭顺利发射升空,火箭飞行583 s后,将神州八号飞船成功送入近地点200 km、远地点330 km的预定轨道,经过397 h的轨道运行,神州八号返回舱于2011-11-17 19:00时许返回地面。
1.4 植物生长指标的测定
2012-08-20,将搭载组和对照组夏枯草种子播种于河南省确山县石滚河镇天津天士力现代中药资源有限公司夏枯草繁育基地。60 d后,将搭载组和对照组的成活幼苗分别移栽,行株距25 cm×25 cm。
在植株生长过程中,统计搭载组108株夏枯草的表型(包括株型、叶色、花色、果穗大小等)变异状况。记录搭载组和对照组夏枯草单株和群体进入抽薹期、始花期、盛花期、成熟期的时间(群体进入时间以组内50%植株表现出相应表型的日期记)。
在2013-06-15夏枯草采收期,利用直尺和游标卡尺观测记录搭载组108株及对照组30株夏枯草的株高、主茎粗、分枝粗、果穗数、果穗长度、果穗粗度等表型生长指标;将采自试验田内的新鲜植株迅速用自来水和蒸馏水冲洗干净,滤纸吸干表面水分,称量地上部分鲜质量;将称完鲜质量的植株放入105 ℃烘箱内,恒温保持30 min 杀青,然后将温度降到55 ℃,烘干至恒质量,取出后于室温下称量地上部分干质量;将干燥果穗分离称量,得果穗干质量。
1.5 干燥果穗中迷迭香酸含量的测定
参照中国药典2010年版[1]中的方法测定夏枯草迷迭香酸含量,色谱柱为Waters SunFire C18(250 mm×4.6 mm,5 μm),流动相为甲醇-体积分数0.1%磷酸溶液(体积比47∶53),流速1.0 mL/min;检测波长330 nm,柱温30 ℃。分别精密吸取0.45 g/L迷迭香酸标准品贮备液10.0,24.9,49.5,122.0,238.1,348.8,454.5 μL于5 mL量瓶中,加乙醇至刻度,制备梯度浓度标准品溶液,进行高效液相色谱分析,梯度浓度标准品溶液分别进样20 μL(各梯度浓度标准液进样量分别为0.180,0.448,0.891,2.195,4.286,6.279和8.182 μg)。以标准品进样量为横坐标(X),以对照品峰面积为纵坐标(Y),绘制标准曲线。然后精密吸取搭载组和对照组夏枯草供试溶液20 μL进样,参照曲线计算迷迭香酸含量。
1.6 数据处理与分析
统计航天搭载夏枯草SP1代出现的表型变异情况和突变率;利用IBM SPSS Statistics 19.0数据分析软件对测得的搭载组和对照组所有表型生长指标进行比较,分析其差异显著性。
2 结果与分析
2.1 航天搭载对夏枯草形态特征的影响
表1表明,航天搭载处理后的夏枯草在株高、主茎粗和分枝粗上呈现出表型生长减弱的趋势,比对照组株高减小5.36%、主茎粗减小4.34%,但是差异均未达到显著性水平(P>0.05);搭载组分枝粗与对照组相比极显著降低(P<0.01),比对照组下降0.14 mm。结果说明,航天诱变对夏枯草的表型形态起到了抑制作用。

表1 航天搭载对夏枯草形态特征的影响Table 1 Effects of space mutation on the morphological traits of Prunella vulgaris L.
注:**和**分别表示SP与CK存在显著(P<0.05)和极显著(P<0.01)差异(t检验)。下表同。
Note:* and ** represent significances between space mutation treatment and control atP=0.05 andP=0.01 level byt-test,respectively.The same below.
2.2 航天搭载对夏枯草果实表型的影响
航天搭载对夏枯草果实表型的影响结果见表2。由表2可知,经过航天搭载后的夏枯草果穗发育状况欠佳,相比于地面对照结穗数目少、穗头短且细小,果穗数减少15.52%,果穗长度降低6.09%,果穗粗度降低2.90%,且这3项指标的变化均达到极显著水平(P<0.01),说明航天诱变从总体上削弱了夏枯草的结实能力。航天搭载后的夏枯草果穗数变化幅度很大,这可能是由于果穗是夏枯草最主要的器官,航天搭载对其影响较大,既出现了果穗数很少的诱变株,也有果穗数很多的诱变株。

表2 航天搭载对夏枯草果实表型的影响Table 2 Effects of space mutation on the fruit characters of Prunella vulgaris L.
2.3 航天搭载对夏枯草生物量的影响
果穗是夏枯草最主要的器官,果穗的数目和大小直接影响果穗质量。由于搭载组的果穗变少、变小,因而其果穗干质量较对照组减小。一般情况下,夏枯草每个分枝上着生5~7个果穗,果穗发育情况可以反映茎秆的分蘖情况,茎秆的分蘖又影响着茎叶干质量。由表3可知,搭载组茎叶干质量较对照组减少21.29%,果穗干质量较对照组下降20.12%,2组的果穗和茎叶干质量差异均达极显著水平(P<0.01),表明航天搭载对夏枯草果穗和茎叶的发育均起到抑制作用。
果穗和茎叶的变化,最终导致地上部分发生变化。由表3可知,搭载组夏枯草的地上部分鲜质量和干质量比对照组分别极显著减少了23.62%和20.81%(P<0.01)。表明航天诱变处理对夏枯草表型生长有减弱作用,最终体现为植株生物量显著减少。
2.4 航天搭载对夏枯草生长发育期的影响
航天搭载对夏枯草的影响既体现在量化指标上,又体现在其生长发育过程的每个阶段。由表4 可知,对照组夏枯草比搭载组更早进入抽薹期、开花期、盛花期、成熟期,其组内植株最早进入的抽薹、开花、盛花、成熟期分别在04-14、04-28、05-13和06-01,搭载组相应的日期分别为04-14、05-02、05-16和06-02;随着夏枯草的生长发育,搭载组平均物候期变化迟于对照组4~5 d。说明航天搭载处理对夏枯草生长、发育、成熟过程具有一定的延缓作用,且搭载组夏枯草单株抽薹、开花、盛花、成熟的时间跨度较大,发育过程不整齐,这可能是由于搭载组(SP)植株数目较多,也可能是由于航天诱变扩大了夏枯草物候期的变异幅度。
表3 航天搭载对夏枯草生物量的影响
Table 3 Effects of space mutation on the biomass of Prunella vulgaris L.

组别Group地上鲜质量/(g·株-1)Freshweightoftheaerialparts地上干质量/(g·株-1)Dryweightoftheaerialparts果穗干质量/(g·穗-1)Dryweightofclusters茎叶干质量/(g·株-1)DryweightofstemsandleavesSP75.55±28.93**30.10±9.58**12.47±4.55**17.63±5.31**CK98.92±23.1438.01±9.8815.61±4.3822.40±5.98

表4 航天搭载对夏枯草生长发育期的影响Table 4 Effects of space mutation on the phenological phase of Prunella vulgaris L.
2.5 航天搭载对夏枯草干燥果穗中迷迭香酸含量的影响
经测算,在进样量为0.18~8.18 μg时,迷迭香酸的峰面积(Y)与进样量(X)之间线性关系良好,标准曲线方程为:Y=3×109X-321 678(r2=0.999 5)。由此计算出部分搭载组和对照组夏枯草干燥果穗中迷迭香酸含量,结果见表5(每组列10株数据)。部分材料的高效液相色谱检测结果见图1。
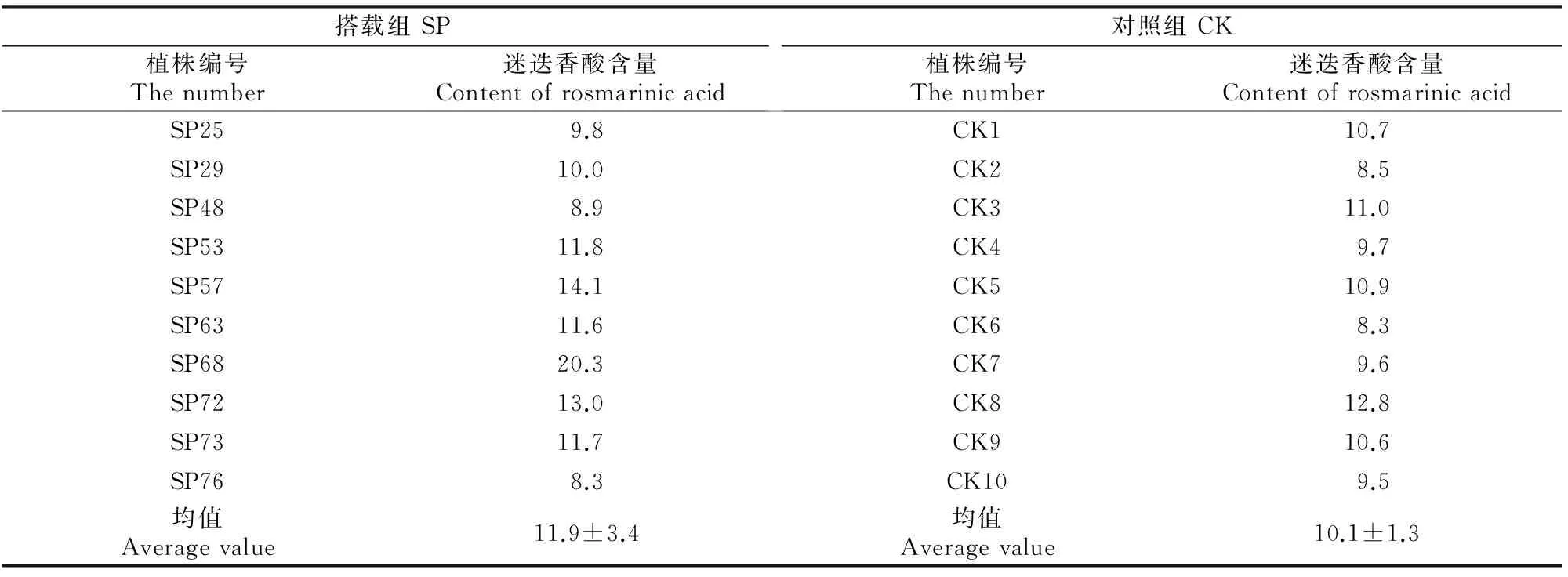
表5 航天搭载对夏枯草干燥果穗中迷迭香酸含量的影响Table 5 Effects of space mutation on the rosmarinic acid in Prunella vulgaris L. mg/g
从表5可以看出,对照组(CK)夏枯草植株由于没有受到太空强辐射和微重力等因素的影响,因而组内各植株迷迭香酸含量的差异不大,在10 mg/g左右;搭载组(SP)植株由于对宇宙环境的适应能力不同,迷迭香酸含量出现较为明显的变异,如部分植株的迷迭香酸含量极低,只有1.1 mg/g;也有6株植株的迷迭香酸含量异常增高,如SP68植株,其迷迭香酸含量达到20.3 mg/g,约为平均水平的2倍,可以视为迷迭香酸含量增高的有利突变植株。航天诱变处理后,夏枯草干燥果穗中迷迭香酸含量变异幅度增大,但差异均未达到显著水平,其平均水平由对照的10.1 mg/g增加到11.9 mg/g,增加了16.41%。

图1 部分夏枯草干燥果穗中迷迭香酸含量的高效液相色谱图A.迷迭香酸标准品;B.对照组;C.搭载组;1.迷迭香酸
2.6 航天搭载夏枯草SP1代的表型变异情况
在对照组中未发现表型变异植株。从表6可以看出,SP1代108株夏枯草中,有7株茎秆颜色变浅,变异率为6.48%;另有11株茎秆光滑无毛,变异率为10.19%;有5株花色变为粉白色或近乎白色,变异率为4.63%;2株叶片颜色变浅,变异率为1.85%。但在果穗苞片被毛、种子大小等表型上没有明显的变异。由此可知,航天诱变增大了夏枯草植株表型突变的几率。

表6 航天搭载夏枯草SP1代的变异情况Table 6 Variation of SP1 generation of Prunella vulgaris L.
3 讨 论
整体而言,航天诱变处理对夏枯草表型生长起到了抑制作用,削弱了夏枯草的结实能力,最终体现为植株生物量大幅度缩减;航天诱变处理的SP1代夏枯草普遍生长发育进程延迟。这与在番茄[23]、须苞石竹[24]、黄芩[25]、桔梗[26]等上的研究结果一致。其原因可能是辐射诱变对染色体或DNA结构产生伤害而导致突变,致使植株生长发育受到明显抑制[27],也可能是航天环境的微重力和强辐射影响了细胞分裂和信号传递等生理生化过程所致[23-29]。
就个体而言,航天诱变增大了夏枯草植株表型的突变率,但航天诱变对每一株夏枯草的诱变效果不同,在SP1代夏枯草中出现了不同形态表型变异的植株,如出现了个体大、果穗多的株型增大植株,也出现了迷迭香酸含量极高的高表达植株。
夏枯草以其干燥果穗入药,增加果穗产量是育种的最终目的。植株的光合作用和有效成分的合成直接影响了果穗的生长发育。本试验发现,航天诱变使夏枯草的结实能力下降,这可能是因为在搭载过程中,夏枯草种子受到了空间环境胁迫,进而产生了生理损伤。
迷迭香酸作为夏枯草主要的药理活性物质,是否能产生更多迷迭香酸是夏枯草育种的一项重要考察指标。本试验通过高效液相色谱检测发现,搭载组有6株夏枯草干燥果穗迷迭香酸含量极高,这可能是由太空失重环境造成基因表达发生变异而引起的。本试验获得的优良植株为后续的育种工作提供了优质材料。
本试验发现,航天诱变扩大了夏枯草各株型表型的变异谱。但表型受生物基因型和环境两方面的影响,是基因决定的性状在环境作用下的具体表现,因此表型变异不一定是由于基因型变异引起的,不同的表型并非都有不同的基因型。因此SP1代夏枯草中出现的表型变异不一定能够在子代稳定遗传。多篇报道表明,航天诱变材料SP2代更适用于育种材料的选择[30],对其进行自交繁殖、品系鉴定、区域化试验等后,在SP3、SP4代中才有可能获得遗传性状稳定的优良突变系。因此,在未来几年的夏枯草育种研究过程中,需将基因型选择与表型选择相结合,提高选择效率。此外,利用分子标记技术分析材料的遗传物质多样性,也可以加快育种进程。
[1] 国家药典委员会.中华人民共和国药典(2010年版一部) [M].北京:中国医药科技出版社,2010:263.
The State Pharmacopoeia Committee.Chinese pharmacopoeia (2010 first version ) [M].Beijing:Chinese Medical Science Press,2010:263.(in Chinese)
[2] Kajima H,Ogura H.Triterpenoids fromPrunllavulgarisL. [J].Phytochemistry,1986,25(3):729-733.
[3] Kajima H,Tominga H,Sato N,et al.Pentacyclic triterpenoids fromPrunellavulgarisL. [J].Phytochemistry,1987,26(4):1107-1111.
[4] 王海波,张芝玉,苏中武,等.夏枯草的本草考证 [J].中草药,1994,25(4):213.
Wang H B,Zhang Z Y,Su Z W,et al.Herbalogical study on common selfheal (Prunellavulgaris) [J].Chinese Traditional and Herbal Drugs,1994,25(4):213.(in Chinese)
[5] 中国药科大学.中药辞海:第2卷 [M].北京:中国医药科技出社,1995:2022-2025.
China Pharmaceutical University.Chinese medicine dictionary:Volume 2 [M].Beijing:Chinese Medical Science Press,1995:2022-2025.(in Chinese)
[6] 江先忠,吴永忠,张大荣.夏枯草规范化栽培技术研究 [J].江西中医学院学报,2009,21(2):79-82.
Jiang X Z,Wu Y Z,Zhang D R.Cultivated techniques ofPrunellavulgarisunder good agriculture practice [J].Journal of Jiangxi University of Traditional Chinese Medicine,2009,21(2):79-82.(in Chinese)
[7] 钟清莲,林家义.夏枯草的临症应用及其栽培 [J].中兽医学杂志,1993(2):36-37.
Zhong Q L,Lin J Y.Clinical application and cultivation ofPrunellavulgaris[J].Journal of Animal Science and Veterinary Medicine,1993(2):36-37.(in Chinese)
[8] 张彦妮,陈立新,付艳丽.夏枯草Prunella vulgaris组织培养和快速繁殖 [J].分子植物育种,2007,5(3):384-388.
Zhang Y N,Chen L X,Fu Y L.Tissue culture and rapid propagation ofPrunellavulgaris[J].Molecular Plant Breeding,2007,5(3):384-388.(in Chinese)
[9] 郭巧生,张贤秀,王艳茹,等.夏枯草种子品质检验及质量标准初步研究 [J].中国中药杂志,2009,34(7):812-816.
Guo Q S,Zhang X X,Wang Y R,et al.Study on seed quality test and quality standard ofPrunellavulgaris[J].Journal of Chinese Materia Medica,2009,34(7):812-816.(in Chinese)
[10] 李跃辉,张水寒,唐 莉,等.夏枯草药材质量标准研究 [J].中华中医药杂志,2006,21(6):374-375.
Li Y H,Zhang S H,Tang L,et al.Study on the quality standard ofPrunellavulgarismedicinal materials [J].China Journal of Traditional Chinese Medicine and Pharmacy,2006,21(6):374-375.(in Chinese)
[11] 王海波,张芝玉,翟振兴,等.中药夏枯草的质量评价 [J].中国中药杂志,1993,18(11):655-657.
Wang H B,Zhang Z Y,Zhai Z X,et al.Qualitative analysis of Chinese drug Xiakucao (Prunella) [J].Journal of Chinese Materia Medica,1993,18(11):655-657.(in Chinese)
[12] 周日宝,罗目和,赵四清,等.中药材夏枯草质量标准的初步研究 [J].湖南中医学院学报,2005,25(2):21-22.
Zhou R B,Luo M H,Zhao S Q,et al.The studies on the quality standands of spicaPrunellae(Xiakucao) [J].Journal of Hunan College of Traditional Chinese Medicine,2005,25(2):21-22.(in Chinese)
[13] 王祝举,赵玉英,涂光忠,等.夏枯草化学成分的研究 [J].药学学报,1999,34(9):679-681.
Wang Z J,Zhao Y Y,Tu G Z,et al.Study on the chemical constituents ofPrunellavulgaris[J].Acta Pharmaceutica Sinica,1999,34(9):679-681.(in Chinese)
[14] 张兰珍,郭亚健,涂光忠,等.夏枯草中的一个新三萜皂苷 [J].药学学报,2008,43(2):169-172.
Zhang L Z,Guo Y J,Tu G Z,et al.A novel triterpenoid saponin fromPrunellavulgaris[J].Acta Pharmaceutica Sinica,2008,43(2):169-172.(in Chinese)
[15] 田 晶,肖志艳,陈雅研,等.夏枯草皂苷A的结构鉴定 [J].药学学报,2000,35(1):29-31.
Tian J,Xiao Z Y,Chen Y Y,et al.Structure identification of vulgarisponin A [J].Acta Pharmaceutica Sinica,2000,35(1):29-31.(in Chinese)
[16] 黄丽霞,陈 彦,贾晓斌,等.不同产地夏枯草中熊果酸和齐墩果酸的含量比较 [J].中成药,2008,30(9):1319-1321.
Huang L X,Chen Y,Jia X B,et al.Content analysis of oleanolic acid and ursolic acid inPrunellavulgarisbased on its appearances [J].Chinese Traditional Patent Medicine,2008,30(9):1319-1321.(in Chinese)
[17] 廖 丽,郭巧生,刘 丽,等.夏枯草总黄酮提取方法及其在居群间分布特征研究 [J].中国中药杂志,2008,33(6):651-653.
Liao L,Guo Q S,Liu L,et al.Study on flavonoids distribution of in various populations ofPrunellavulgaris[J].China Journal of Chinese Materia Medica,2008,33(6):651-653.(in Chinese)
[18] Zheng J,He J,Ji B,et al.Antihyperglycemic activity ofPrunellavulgarisL.in streptozotocin-induced diabetic mice [J].Asia Pacific Journal of Clinical Nutrition,2007,16:427.
[19] 刘保林,朱丹妮,王 刚.夏枯草醇提物对小鼠血糖的影响 [J].中国药科大学学报,1995,26(1):44-46.
Liu B L,Zhu D N,Wang G.Effects of the alcohol extract of spicaPrunellaeon blood glucose in mice [J].Journal of China Pharmaceutical University,1995,26(1):44-46.(in Chinese)
[20] 孔四新,崔旭盛,李海奎.药用植物太空育种研究进展 [J].中国农学通报,2014,30(6):273-278.
Kong S X,Cui X S,Li H K.Research progress of space seeding of medicinal plants [J].Chinese Agricultural Science Bulletin,2014,30(6):273-278.(in Chinese)
[21] 刘录祥,郭会君,赵林姝,等.我国作物航育种20年的基本成就与展望 [J].核农学报,2007,21(6):589-592.
Liu L X,Guo H J,Zhao L S,et al.Achievements in the past twenty years and perspective outlook of crop space breeding in China [J].Journal of Nuclear Agricultural Science,2007,21(6):589-592.(in Chinese)
[22] 刘录祥,郑企成.空间诱变与作物改良 [M].北京:原子能出版社,1997.
Liu L X,Zheng Q C.Space mutation and crop improvement [M].Beijing:Atomic Energy Press,1997.(in Chinese)
[23] 郑积荣,汪炳良,赵杭萍,等.飞船搭载番茄种子SP1的生物学效应 [J].核农学报,2004,18(4):311-313.
Zheng J R,Wang B L,Zhao H P,et al.The biological effect of SP1tomatoes after boarding on airship [J].Acta Agriculturae Nucleatae Sinica,2004,18(4):311-313.(in Chinese)
[24] 杨学军,滕文军,袁小环,等.航天诱变对须苞石竹种子和SP1代植株生长的影响 [J].核农学报,2011,25(4):708-712.
Yang X J,Teng W J,Yuan X H,et al.Effect of space flight on seeds and plant growth ofDianthusbarbatusin SP1[J].Journal of Nuclear Agricultural Science,2011,25(4):708-712.(in Chinese)
[25] 单成钢,王志芬,苏学合.航天诱变黄芩种子对其SP1代的影响 [J].核农学报,2008,22(2):188-191.
Shan C G,Wang Z F,Su X H.SP1biological effects of space inducement onScutellariabaicalensis[J].Journal of Nuclear Agricultural Science,2008,22(2):188-191.(in Chinese)
[26] 王志芬,苏学合,闫树林,等.太空搭载桔梗种子SP1代的生物学效应研究 [J].核农学报,2004,18(4):323-324.
Wang Z F,Su X H,Yan S L,et al.Biological effects on SP1generation by spaceship-carried dry seed ofPlatycodongrandiflorum[J].Acta Agriculturae Nucleatae Sinica,2004,18(4):323-324.(in Chinese)
[27] 朱昌兰,胡岳峰,陈 莹,等.作物空间诱变育种研究进展 [J].江西农业大学学报,1999,21(3):435-437.
Zhu C L,Hu Y F,Chen Y,et al.The progress on crop breeding by space mutagenesis [J].Acta Agriculturae Universitatis Jiangxiensis,1999,21(3):435-437.(in Chinese)
[28] 汪炳良,郑积荣,王慧俐,等.飞船搭载处理对辣椒SP1发芽和生物学特性的影响 [J].核农学报,2004,18(4):317-320.
Wang B L,Zheng J R,Wang H L,et al.The effect of space mutation treatment on seed germinating ability and the biologcial characters of SP1hot peppers [J].Acta Agriculturae Nucleatae Sinica,2004,18(4):317-320.(in Chinese)
[29] 张天真.作物育种学总论 [M].北京:中国农业出版社,2003.
Zhang T Z.The crop breeding [M].Beijing:China Agriculture Press China,2003.(in Chinese)
[30] 王维婷,单成钢,倪大鹏,等.卫星搭载处理丹参种子SP2代的SPAP分析 [J].核农学报,2009,23(5):758-761.
Wang W T,Shan C G,Ni D P,et al.Space flight effects analysis of SP2SalviamiltiorrhizaBge.using SRAP marker [J].Acta Agriculturae Nucleatae Sinica,2009,23(5):758-761.(in Chinese)
Effects of space mutation on biological characteristics and rosmarinic acid content of SP1PrunellavulgarisL.
MA Nan1,QI Zhi-hong2,MAO Ren-jun1,LIU Feng-hua2, LIU Yan2,HAN Rui-lian1
(1CollegeofLifeSciences,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2TianjinTaslyModernTCMResourcesCO.LTD,Tianjin300402,China)
【Objective】 This study investigated the effects of space mutation on biological traits and rosmarinic acid content ofPrunellavulgarisL.to provide references for germplasm improvement and variety breeding.【Method】 Using the seeds carried by Shenzhou Ⅷ spacecraft and the seeds stayed on earth ofPrunellavulgarisL.as materials,growth indexes of phenotype were observed and rosmarinic acid contents in dry ears were measured by high performance liquid after harvesting.Then the differences between these two groups were compared to identify the effects of space mutation onPrunellavulgarisL.【Result】 General reductions in plant height,branch width,cluster length,cluster width,cluster number,dry weight of the aerial parts,fresh weight of the aerial parts,dry weight of clusters,and dry weight of stems and leaves were found when comparing the mutagenic treatment group (SP) with the control (CK).The differences in branch width,cluster number,fresh weight of the aerial parts,dry weight of the aerial parts and clusters were extremely significant.The bolting stage,initial blooming stage,full blooming stage,and maturing stage of SP were later than those of CK.The rosmarinic acid content of SP was larger than CK.Six plants with high rosmarinic acid contents were detected in SP1generation,but the differences were insignificant. Besides,a variety of phenotypic variations were observed in SP1generation.【Conclusion】 Space mutation treatment increased the phenotype mutation rate and inhibited the growth ofPrunellavulgarisL.
PrunellavulgarisL.;space mutation treatment;biological characteristics;SP1generation;rosmarinic acid
时间:2015-08-05 08:57
10.13207/j.cnki.jnwafu.2015.09.025
2014-02-24
陕西省科技统筹项目(2012KTCL02-07)
马 楠(1989-),女,河北保定人,在读硕士,主要从事药用植物学研究。E-mail:mnmemory@126.com
韩蕊莲(1962-),女,陕西扶风人,教授,硕士生导师,主要从事中草药规范化栽培理论与技术研究。 E-mail:hanrl@nwsuaf.edu.cn
S567.23
A
1671-9387(2015)09-0178-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150805.0857.050.html
