PD0325901和CHIR99021促进牛体细胞克隆胚胎体外发育的研究
2015-01-07吴新颖桑元坤王勇胜
吴新颖,桑元坤,王勇胜,张 涌,华 松
(1 西北农林科技大学 动物医学院,陕西 杨凌 712100;2 南开大学 医学院,天津 300071;3 农业部动物生物技术重点实验室,陕西 杨凌 712100)
PD0325901和CHIR99021促进牛体细胞克隆胚胎体外发育的研究
吴新颖1,2,桑元坤1,3,王勇胜1,3,张 涌1,3,华 松1,3
(1 西北农林科技大学 动物医学院,陕西 杨凌 712100;2 南开大学 医学院,天津 300071;3 农业部动物生物技术重点实验室,陕西 杨凌 712100)
【目的】 选取MAP2K和GSK3的抑制剂PD0325901、CHIR99021(简称2i)对牛体细胞核移植(SCNT)胚胎进行处理,研究这2种小分子物质对胚胎发育及其多能性基因(OCT4、SOX2、KLF4、DPPA3、CDX2、GATA4、NANOG)表达的影响。【方法】 以牛皮肤成纤维细胞为供体,牛MⅡ期卵母细胞为受体,构建牛SCNT胚胎,采用添加2i(PD0325901 0.4 μmol/L,CHIR99021 3 μmol/L)的胚胎培养液体外培养SCNT胚胎72 h,以mSOF+DMSO培养液处理的SCNT胚胎及体外受精(IVF)胚胎为对照,统计核移植胚胎体外发育率,并对胚胎多能性相关基因的表达进行实时定量PCR检测。【结果】 与对照相比,2i处理能使SCNT胚胎囊胚率和囊胚细胞总数显著增加,凋亡细胞率显著下降,多能性相关基因NANOG和SOX2表达量上调,而细胞分化相关基因GATA4的表达量下调,其他基因表达量变化不显著,从而使SCNT胚胎的发育状态更接近于IVF胚胎。【结论】 2i共处理72 h可优化SCNT胚胎发育状态。
小分子信号通路抑制剂;体细胞克隆;胚胎发育;牛
体细胞克隆(Somatic cell clone)技术,又称体细胞核移植(Somatic cell nuclear transfer,SCNT)技术,近年来被广泛应用于动物生产、医学研究和濒危动物保护等领域,越来越多的哺乳动物被成功克隆,如猪[1]、骡[2]、牛[3]、羊[4]、狼[5]、兔[6]、猫[7]、骆驼[8]等,这充分印证了体细胞克隆技术在理论和实践方面都具有巨大的潜力。但克隆胚胎发育率以及克隆动物出生率都普遍较低,克隆胎儿也极易出现各种表型异常,这严重制约着体细胞克隆技术的进一步发展和应用。研究表明,体细胞核移植胚胎在早期系统分化过程中,由于供核细胞重编程不完全或者重编程错误[9],使得不能正确启动供核细胞基因组而导致发育阻滞,导致克隆胚胎在体外无法形成完全意义上的囊胚,严重制约着克隆技术的推广和应用。
克隆胚胎的体外培养体系是影响胚胎发育力的重要因素。目前牛体细胞核移植胚胎通用的培养液是改良的输卵管合成培养液(Meliorate synthetic oviductal fluid,mSOF)[10]。mSOF最早用于牛胚胎的体外培养,胚胎在其中发育效率可以与体内发育相媲美,故而被广泛用于牛SCNT胚胎的体外培养[11-13]。Rieger等[14]尝试将表皮细胞生长因子(EGF)添加入胚胎体外培养液后,发现优化培养液可促进胚胎体外发育,掀起了培养液优化的热潮。
MAPK激酶(MAPKK,亦称MAP2K、MEK),是促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAP激酶, MAPK)链级联过程中至关重要的因子,在基因表达调控和细胞周期调控中具有重要的作用[15],并且在果蝇的胚胎发生中起着重要的调控作用[16-18]。糖原合成酶激酶3(Glycogen synthase kinase 3,GSK3)参与细胞结构和细胞内信号传导、细胞分裂增殖、凋亡,尤其参与决定胚胎发育过程中细胞的命运[19]。PD0325901是选择性的、ATP非竞争性的MAP2K抑制剂,选择性结合和抑制MAP2K,对于抑制干细胞分化和维持其多能性具有重要的作用,可显著提高ES/iPS细胞传代效率[20-22];CHIR99021是高选择性的GSK3抑制剂,与PD0325901联合使用可抑制小鼠ES细胞的分化[23]。资料表明,2i即MAP2K抑制剂PD0325901和GSK3抑制剂CHIR99021共同作用,该方法被应用于干细胞培养和诱导传代中[24]。Daina Harris等联合利用这2种抑制剂处理体外受精(invitrofertilization,IVF)胚胎,显著改善了内细胞团的基因表达模式,并且得到高质量的多能干细胞[25]。
本研究从胚胎培养的技术与手段出发,通过检测体外培养SCNT胚胎发育力和质量,评价PD0325901、CHIR99021对牛SCNT胚胎体外发育的影响,探究胚胎发育中信号通路抑制剂的作用,以期为优化体细胞核移植技术和提高体细胞克隆效率提供参考。
1 材料与方法
1.1 材 料
TCM199、DMEM和胎牛血清(FBS)购自Gibco公司(USA);其余试剂除特别说明外,均购自Sigma公司(USA)。离心管、细胞冻存管、细胞培养皿,购自Corning公司(USA)。
1.2 核移植供体细胞及牛卵母细胞的准备
核移植胚胎中供体细胞为牛皮肤成纤维细胞,来源于1月龄荷斯坦奶牛胎儿。用剪刀剪1块荷斯坦奶牛胎儿耳部皮肤组织,放入含青霉素(300 IU/mL)、链霉素(300 μg/mL)的无菌PBS中运回实验室,用灭菌剪刀剪成碎块(1~2 mm3),PBS洗涤3次,均匀放置在培养皿中,然后将培养皿倒置于38.5 ℃、体积分数5% CO2、饱和湿度培养箱中培养,待组织块贴附于培养皿表面之后,加入微量DMEM+体积分数10% FBS培养液浸没组织块,24 h后添加约3 mL培养液继续培养,以后每3 d全量换液1次。有细胞单层形成时去掉组织块,当细胞长至80%~90%汇合时传代并部分冻存,以3~5代细胞作为供体细胞。供体细胞在接触抑制后用质量分数0.25%胰蛋白酶消化,离心弃上清液,沉淀用5 μg/mL的细胞松弛素B(Cytochalasin B,CB)重悬混匀,备用。
牛卵巢采集于西安市某屠宰场,置于20~30 ℃ 生理盐水中8 h内送回实验室。剔除卵巢表面附着的结缔组织后,生理盐水洗涤3遍,采用带12号针头的一次性注射器(10 mL)抽吸卵巢表面直径为2~8 mm卵泡的卵泡液备用。将抽取的卵泡液在体视显微镜下收集有卵丘细胞包裹的、胞质均匀的卵丘-卵母细胞复合体(Cumulus-oocyte complexes,COCs),放入卵母细胞成熟(Oocyte maturation,OM)培养液中,于38.5 ℃、体积分数5% CO2、饱和湿度条件下进行成熟培养。
1.3 牛体细胞核移植胚胎的构建
将牛卵母细胞体外成熟培养24 h后移入含质量分数0.2%透明质酸酶且无Ca2+、Mg2+的PBS液中处理4 min,同时用移液器反复吹吸脱去卵丘细胞。于实体显微镜下挑选形态规则、胞质均一的MⅡ期卵母细胞,将其放入含有7.5 μg/mL CB和体积分数10% FBS的PBS中孵育15 min,再放入100 μL微滴中进行显微操作。用去核管吸除卵母细胞的第一极体及其附近的部分卵胞质,用Hoechst3334染色确保去核完全后,吸取单个供体细胞注入透明带下。核质复合体在电融合液中平衡3 min后用微电极法进行融合[26]。电融合参数为:电压28 V,脉冲时长20 μs,2次脉冲,间隔10 μs。将融合后的细胞置于含5 mol/L离子霉素(Ionomycin)的mSOF中激活4 min,然后用含有2 mmol/L 6-DMAP的mSOF激活4 h。激活后的核移植胚胎用mSOF洗3遍,转移到预热的被石蜡油覆盖的培养液中,于38.5 ℃、体积分数5% CO2、饱和湿度条件下培养。
1.4 牛IVF胚胎的制备及体外培养
将荷斯坦牛细管冻精(购自上海光明荷斯坦牧业公司)置于38 ℃ 水浴中快速解冻,用吸管将0.5 mL精液置于装有5 mL精子获能液(BO)的试管底部,倾斜45°置于CO2培养箱中上浮精子45 min,收集试管中上清液体,1 000 r/min离心10 min后弃上清液,保留离心管底部约200 μL精液。将成熟培养24 h的卵母细胞用移液器反复吹吸,收集留有2~3层卵丘细胞的卵母细胞,在BO液中洗涤3次,移入预先于CO2培养箱中孵育2 h的BO液微滴中。将适量获能后的精子也加入微滴内,置于培养箱中完成受精过程。将受精24 h的胚胎用质量分数0.2%的透明质酸酶处理,去除颗粒细胞后移至mSOF中进行后续培养。体外受精胚胎用mSOF洗3遍,转移到预热的被石蜡油覆盖的mSOF中,于 38.5 ℃、体积分数5% CO2、饱和湿度条件下培养。
1.5 2i对牛SCNT胚胎的影响
1.5.1 对牛SCNT胚胎体外发育率的影响 将SCNT胚胎分成2组,分别为mSOF+DMSO组(对照组)和mSOF+2i组。mSOF+2i组:将SCNT胚胎置于400 μL覆盖石蜡油的mSOF+2i培养液(2i用DMSO配成10 mmol/L的浓缩液,PD0325901工作浓度为0.4 μmol/L,CHIR99021工作浓度为3 μmol/L)的凹皿中,38.5 ℃、体积分数5% CO2、饱和湿度条件下培养72 h后,转移到无抑制剂的mSOF培养液中继续培养。mSOF+DMSO组:SCNT胚胎用mSOF+DMSO培养。每个凹皿中放入30~50枚胚胎,随后观察并记录卵裂率、8-细胞及囊胚率,试验重复11次。
1.5.2 对牛SCNT囊胚细胞数的影响 取IVF囊胚及mSOF+2i和mSOF+DMSO培养液中培养第7天的囊胚,用免疫染色固定液(Beyotime,China)进行固定,以滋养层特异性蛋白Cdx2为靶蛋白,对胚胎进行免疫荧光染色:囊胚室温固定30 min,用体积分数0.1% Triton X-100透化处理20 min,用含有质量分数0.2% PVA的PBS缓冲液洗涤3遍;将胚胎放入含有鼠抗牛Cdx2(1∶200稀释)的一抗稀释液中处理4 h,用PBS缓冲液洗涤3遍;黑暗环境中放入Alexa Fluor 555标记驴抗鼠IgG(H+L)的二抗稀释液中孵育2 h,PBS缓冲液中洗涤3遍后放入DAPI染色液中孵育5 min,PBS缓冲液中洗涤3遍;压片,镜检。与Cdx2的单克隆抗体特异性结合的二抗显红色,指示滋养层细胞;DAPI在细胞核显蓝色,指示胚胎全部细胞。计数滋养层细胞数和胚胎细胞总数,内细胞团细胞数即胚胎细胞总数减滋养层细胞数,计算内细胞团和滋养层细胞数所占比率。试验重复5次。
1.5.3 对牛SCNT囊胚凋亡的影响 用TUNEL法(DeadEndTMFluorometric TUNEL System,Promega)检测两组囊胚细胞凋亡情况:取IVF囊胚及mSOF+2i和mSOF+DMSO培养液中培养第7天的囊胚,用免疫染色固定液(Beyotime,China)固定;用体积分数0.1% Triton X-100透化处理30 min,用含有质量分数0.2% PVA的PBS缓冲液洗涤3遍;放入平衡缓冲液(E Buffer)中平衡10 min;放入荧光标记的末端转移酶dUTP孵育缓冲液中,37 ℃ 避光孵育1 h;PBS缓冲液中洗涤3遍后放入2×SSC中15 min以终止反应;PBS缓冲液中洗涤3遍,放入DAPI中染核10 min;封片,镜检。与dUTP结合的细胞显绿色,指示凋亡细胞;DAPI在细胞核显蓝色,指示胚胎全部细胞。计数凋亡细胞和胚胎细胞总数,统计凋亡细胞比率。试验重复3次。
1.5.4 对牛SCNT胚胎基因表达的影响 选取多能性相关基因CDX2、DPPA3、GATA4、KLF4、NANOG、OCT4、SOX2作为研究对象,以看家基因GAPDH作为内参,采用 RT-PCR进行基因表达检测。定量PCR引物由Takara公司设计并合成,引物序列见表1。
取IVF囊胚及mSOF+2i和mSOF+DMSO中培养第7天囊胚各3个,每组随机取囊胚3个,用SuperScript Ⅲ CellsDirect cDNA Synthesis System (Invitrogen,USA) 获得胚胎cDNA,以此作为模板用SYBR® Premix Ex TaqTMⅡ (Tli RNaseH Plus)(Takara,Japan)进行荧光定量RT-PCR分析。反应结束后,运用2-ΔΔcT方法计算目的基因的相对表达量[27]。试验重复3次。

表1 RT-PCR引物序列Table 1 Sequence of RT-PCR primers
1.6 统计与分析
卵裂率、囊胚率及凋亡率等均使用SPSS 19.0(SPSS,Inc.,IL,USA)进行单因素ANOVA检验分析,当P<0.05时即认为差异显著。
2 结果与分析
2.1 2i对牛SCNT胚胎体外发育率的影响
由表2可知,与mSOF+DMSO组(对照组)相比,mSOF+2i组胚胎卵裂率和8-细胞胚率略有上升但差异不显著,而累加效果囊胚率显著上升;从8-细胞胚胎发育至囊胚的比率看,mSOF+2i组(52.27%(115/220))相对于mSOF+DMSO组(40.45%(89/220))显著上升(P<0.05)。说明在胚胎发育前72 h,2i处理可提高体细胞克隆胚胎体外发育的囊胚率,促进和优化克隆胚胎的体外发育能力。

表2 2i对牛SCNT胚胎体外发育的影响(n=11)Table 2 Effect of 2i on bovine in vitro SCNT embryos (n=11)
注:*同列数据后标不同小写字母表示差异显著(P<0.05)。下表同。
Note:Different small letters in each column indicate significant difference (P<0.05).The same below.
2.2 2i对牛SCNT囊胚细胞数的影响
从图1可以明显地看出,mSOF+2i组囊胚细胞总数较mSOF+DMSO组增加,而滋养层细胞减少。由表3可知,mSOF+2i组囊胚细胞总数较mSOF+DMSO组显著增加,内细胞团(ICM)比率显著增大,滋养层细胞比率显著减小,更加接近IVF胚胎。说明在胚胎发育前72 h,2i处理可提升早期囊胚中内细胞团比率,优化胚胎发育状态。
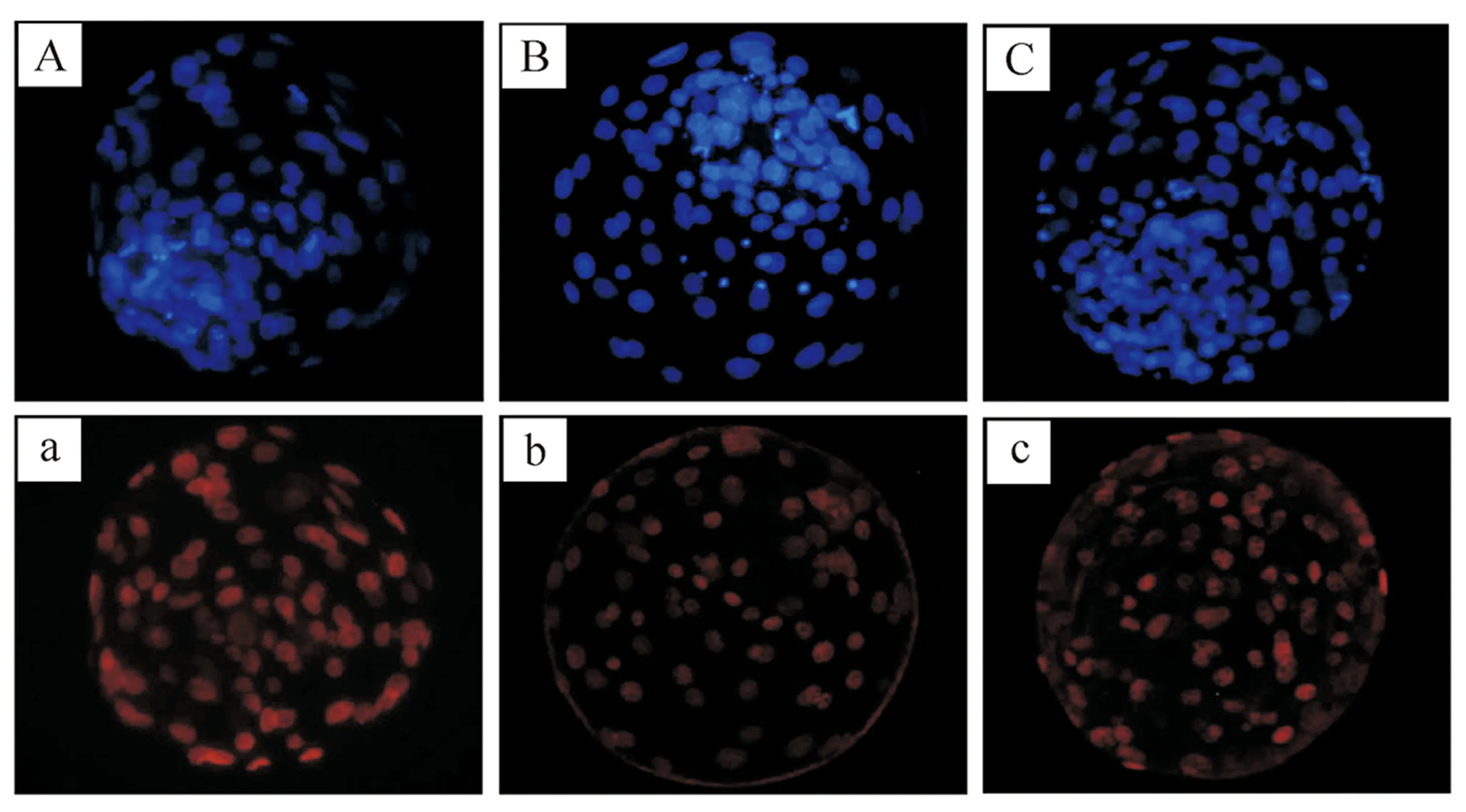
图1 牛SCNT囊胚和IVF囊胚的免疫荧光染色结果(×400)A.mSOF+DMSO组(对照组)牛SCNT囊胚全部细胞DAPI染色;a.mSOF+DMSO组(对照组)牛SCNT囊胚滋养层细胞特异性染色;B.mSOF+2i组牛SCNT囊胚全部细胞DAPI染色;b.mSOF+2i组牛SCNT囊胚滋养层细胞特异性染色;C.牛IVF囊胚全部细胞DAPI染色;c.牛IVF囊胚滋养层细胞特异性染色Fig.1 Immunofluorescence staining results of bovine SCNT blastocysts and IVF blastocysts(×400)A.DAPI-stained bovine SCNT blastocysts cultured in mSOF+DMSO (control);a.TE of bovine SCNT blastocysts cultured in mSOF+DMSO (control);B.DAPI-stained bovine SCNT blastocysts cultured in mSOF+2i;b.TE of bovine SCNT blastocysts cultured in mSOF+2i;C.DAPI-stained bovine IVF blastocysts;c.TE of bovine IVF blastocysts

表3 2i对牛SCNT囊胚细胞数的影响Table 3 Effect of 2i on cell number of bovine SCNT blastocysts
2.3 2i对牛SCNT囊胚细胞凋亡的影响
从图2可以看出,mSOF+2i组囊胚细胞凋亡数量较mSOF+DMSO组降低。
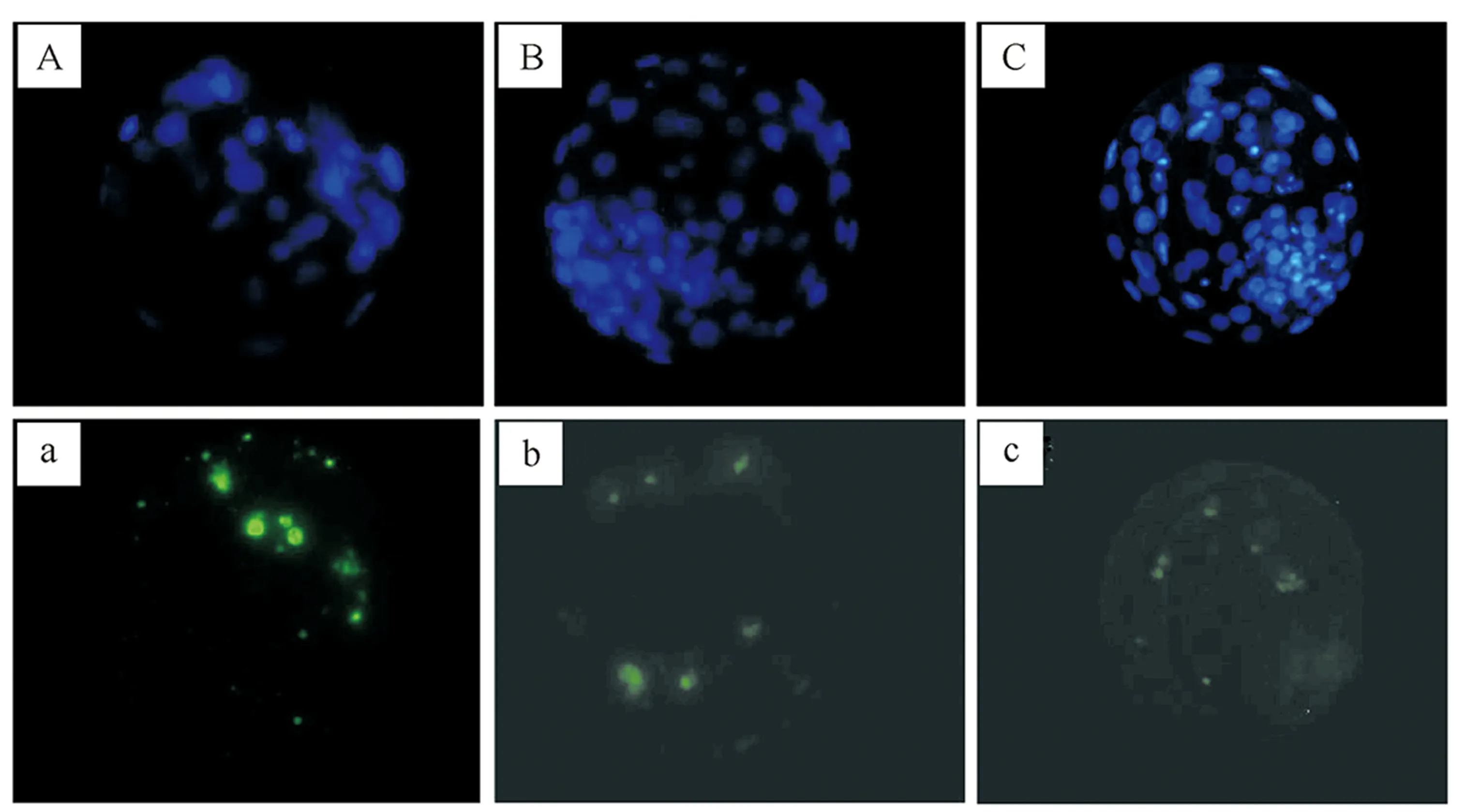
图2 牛SCNT囊胚和IVF囊胚的凋亡染色结果(×400)
囊胚细胞凋亡比率统计结果见表4。由表4可知,mSOF+2i组囊胚细胞凋亡比率较mSOF+DMSO组显著降低。说明在胚胎发育前72 h,2i处理可降低囊胚凋亡率,而且凋亡细胞比率更加接近IVF胚胎,可见2i处理可优化胚胎发育状态,提升克隆胚胎后续发育力。

表4 2i对牛SCNT囊胚细胞凋亡的影响Table 4 Effects of 2i on apoptosis rate of bovine SCNT blastocyst
2.4 2i对牛SCNT胚胎基因表达的影响
图3为囊胚细胞中多能性相关基因OCT4、SOX2、KLF4、DPPA3、CDX2、GATA4、NANOG的相对表达水平。由图3可以看出,与mSOF+DMSO组相比,mSOF+2i组囊胚NANOG和SOX2的表达量显著上升,GATA4表达量显著下降,而OCT4、KLF4、DPPA3和CDX2表达量变化不显著。
由图3还可以看出,除NANOG外,mSOF+2i组囊胚其他多能性基因的表达量多介于IVF胚胎与mSOF+DMSO组囊胚之间,说明2i处理能在某种程度上使囊胚细胞内基因表达量更趋向于IVF胚胎。可见在胚胎发育前72 h,2i处理影响了体细胞克隆胚胎的基因表达,优化了胚胎发育状态,进而提升了胚胎后续发育能力。

图3 2i对牛SCNT囊胚多能性相关基因相对表达水平的影响图柱上标不同小写字母表示差异显著(P<0.05)
3 讨 论
近年来克隆技术的应用和发展都取得了不小的进步,但克隆胚胎的发育以及克隆动物的生产情况仍旧不理想。主要表现在克隆胚胎囊胚率低、孵化胚胎着床率低、胎儿流产率高以及新生儿成活率低,而且存在巨胎症(LOS)、内脏和胎盘发育过度或畸形等表型异常[28]。目前普遍认为,在体细胞克隆胚胎早期系统分化过程中,由于供核细胞重编程不完全或者重编程错误,使之不能正确启动重构胚胎合子基因组,因而导致发育阻滞。克隆胚胎的体外培养体系是影响胚胎发育力的重要因素之一。为提高哺乳动物体外培养获得的囊胚率,必须克服胚胎发育阻滞的问题。牛体细胞克隆胚胎体外培养主要阻滞于8-细胞时期,因其在8-细胞时期开始启动合子基因组,胚胎发育从母源单一调控向合子调控过渡[29],对体外培养体系也相应地要求有所变化。
本试验向胚胎基础培养液中添加MAP2K和GSK3双通路小分子抑制剂PD0325901、CHIR99021处理72 h,结果发现,与对照组相比,体外培养的克隆胚胎卵裂率和8-细胞胚率都没有显著变化,囊胚率却显著上升,尤其从8-细胞胚胎发育至囊胚的比率显著上升。2i处理组囊胚细胞总数显著增加,内细胞团(ICM)所占比率增加,囊胚细胞凋亡比率降低。说明在胚胎发育的前72 h, 2i处理可有效提高核移植重构胚胎后续发育启动合子基因组的效率。此外,2i处理可提升早期囊胚中内细胞团比率,而且降低囊胚细胞凋亡率,有利于胚胎进一步发育,优化胚胎后续发育能力,为附植后发育奠定了良好的基础。
哺乳动物囊胚分化为滋养层、内胚层和外胚层,本试验RT-PCR检测发现,与对照组相比,2i处理后NANOG、SOX2作为外胚层特异性标记基因[30-31],其表达量上升,其中NANOG基因的表达量变化最显著。由于NANOG基因在桑椹胚时期开始表达,于早期囊胚中表达量达到巅峰,NANOG与外胚层早期建立有着紧密的联系。NANOG的表达大幅升高,更加有利于胚胎的后续发育。2i处理后OCT4、KLF4、DPPA3等非外胚层特异性标记基因[23,32]表达量变化不明显;内胚层特异性标记基因GATA4表达量显著下降;滋养层特异性标记基因CDX2[32]表达量变化也不显著。结果充分说明,2i对牛体细胞克隆胚胎的基因表达和发育有一定影响。
由成纤维生长因子(Fgf)活化的MAPK通路是起始囊胚内细胞团系统分化的关键因素[22],2i阻断MAPK通路的结果是外胚层扩张。由于哺乳动物只有外胚层能够分离ES细胞,使得从体外培养胚胎中获得胚胎干细胞(ES cell)更加容易。本试验结果表明,2i处理既能提高囊胚发育率,又能提高获得ES细胞的效率,这为再生医学提供了新思路。对于克隆动物的生产而言,2i处理胚胎的后续着床和发育能力还有待进一步研究。
4 结 论
在体细胞克隆胚胎基础培养液(mSOF)中添加PD0325901、CHIR99021对SCNT胚胎进行2i处理,可有效提高克隆胚胎的体外发育囊胚率,同时内细胞团比率增加,囊胚细胞凋亡率降低,多能性相关基因NANOG、SOX2、GATA4表达水平更加接近IVF胚胎,可见2i处理有利于提高牛克隆胚胎的体外发育能力和品质。
[1] Polejaeva I A,Chen S H,Vaught T D,et al.Cloned pigs produced by nuclear transfer from adult somatic cells [J].Nature,2000,407(6800):86-90.
[2] Woods G L,White K L,Vanderwall D K,et al.A mule cloned from fetal cells by nuclear transfer [J].Science,2003,301(5636):1063.
[3] Cibelli J B,Stice S L,Golueke P J,et al.Trasgenic bovine chimeric offspring produced from somatic cell-derived stem-like cells [J].Nature Biotechnology,1998,16(7):642-646.
[4] Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells [J].Nature,1997,385(6619):810-813.
[5] Kim M K,Jang G,Oh H J,et al.Endangered wolves cloned from adult somatic cells [J].Cloning and Stem Cells,2007,9(1):130-137.
[6] Chesné P,Adenot P G,Viglietta C,et al.Cloned rabbits produced by nuclear transfer from adult somatic cells [J].Nature Biotechnology,2002,20(4):366-369.
[7] Shin T,Kraemer D,Pryor D,et al.Cell biology:A cat cloned by nuclear transplantation [J].Nature,2002,415(6874):859.
[8] Wani N A,Wernery U,Hassan F A H,et al.Production of the first cloned camel by somatic cell nuclear transfer [J].Biology of Reproduction,2010,82(2):373-379.
[9] Daniels R,Hall V,Trounson A O.Analysis of gene transcription in bovine nuclear transfer embryos reconstructed with granulosa cell nuclei [J].Biology of Reproduction,2000,63(4):1034-1040.
[10] Tervit H,Whittingham D,Rowson L.Successful cultureinvitroof sheep and cattle ova [J].Journal of Reproduction and Fertility,1972,30(3):493-497.
[11] Gómez E,Rodríguez A,Muoz M,et al.Serum free embryo culture medium improvesinvitrosurvival of bovine blastocysts to vitrification [J].Theriogenology,2008,69(8):1013-1021.
[12] Feugang J M,Camargo-Rodríguez O,Memili E.Culture systems for bovine embryos [J].Livestock Science,2009,121(2):141-149.
[13] Block J,Hansen P.Interaction between season and culture with insulin-like growth factor-1 on survival ofinvitroproduced embryos following transfer to lactating dairy cows [J].Theriogenology,2007,67(9):1518-1529.
[14] Rieger D,Luciano A M,Modina S,et al.The effects of epidermal growth factor and insulin-like growth factor I on the metabolic activity,nuclear maturation and subsequent development of cattle oocytesinvitro[J].Journal of Reproduction and Fertility,1998,112(1):123-130.
[15] Seger R,Krebs E G.The MAPK signaling cascade [J].The FASEB Journal,1995,9(9):726-735.
[16] Haccard O,Sarcevic B,Lewellyn A,et al.Induction of metaphase arrest in cleaving Xenopus embryos by MAP kinase [J].Science,1993,262(5137):1262-1265.
[17] Tsai M,Chen R H,Tam S Y,et al.Activation of MAP kinases,pp90rsk and pp70-S6 kinases in mouse mast cells by signaling through the c-kit receptor tyrosine kinase or Fc epsilon RI:rapamycin inhibits activation of pp70-S6 kinase and proliferation in mouse mast cells [J].European Journal of Immunology,1993,23(12):3286-3291.
[18] Tsuda L,Inoue Y H,Yoo M A,et al.A protein kinase similar to MAP kinase activator acts downstream of the raf kinase in Drosophila [J].Cell,1993,72(3):407-414.
[19] Cohen P,Frame S.The renaissance of GSK3 [J].Nature Reviews Molecular Cell Biology,2001,2(10):769-776.
[20] Ye S,Tan L,Yang R,et al.Pleiotropy of glycogen synthase kinase-3 inhibition by CHIR99021 promotes self-renewal of embryonic stem cells from refractory mouse strains [J].PlOS ONE,2012,7(4):e35892.
[21] Li W,Zhou H Y,Abujarour R,et al.Generation of human-induced pluripotent stem cells in the absence of exogenous Sox2 [J].Stem Cells,2009,27(12):2992-3000.
[22] Lanner F,Rossant J.The role of FGF/Erk signaling in pluripotent cells [J].Development,2010,137(20):3351-3360.
[23] Van der Jeught M,O’Leary T,Ghimire S,et al.The combination of inhibitors of FGF/MEK/Erk and GSK3β signaling increases the number of OCT3/4-and NANOG-positive cells in the human inner cell mass,but does not improve stem cell derivation [J].Stem Cells and Development,2012,22(2):296-306.
[24] Telugu B P V,Ezashi T,Michael Roberts R.Porcine induced pluripotent stem cells analogous to naive and primed embryonic stem cells of the mouse [J].International Journal of Developmental Biology,2010,54(11):1703.
[25] Harris D,Huang B,Oback B.Inhibition of MAP2K and GSK3 signaling promotes bovine blastocyst development and epiblast-associated expression of pluripotency factors [J].Biology of Reproduction,2013,88(3):74.
[26] 张 东,杨 鹭,王勇胜,等.TSA处理供体细胞对组蛋白乙酰化和核重编程效果的影响 [J].畜牧兽医学报,2009,40(7):1007-1012.
Zhang D,Yang L,Wang Y S,et al.Effect of rrichostatin A on reprogramming of bovine fetal fibroblast cells [J].Chinese Journal of Animal and Veterinary Sciences,2009,40(7):1007-1012.(in Chinese)
[27] Schmittgen T D,Livak K J.Analyzing real-time PCR data by the comparative CT method [J].Nature Protocols,2008,3(6):1101-1108.
[28] 胡广卫,苏建民,曹泽磊,等,5-Aza-CdR联合TSA对牛核移植胚胎体外发育及表观遗传状态的影响 [J].西北农林科技大学报:自然科学版,2009,37(12):1-5.
Hu G W,Su J M,Cao Z L,et al.Effect of 5-Aza-CdR and TSA on theinvitrodevelopment of bovine cloned enbryos and epigenetic status [J].Journal of Northwest A&F University:Natural Science Edition,2009,37(12):1-5.(in Chinese)
[29] Xu J S,Chan S T H,Lee W W M,et al.Differential growth,cell proliferation,and apoptosis of mouse embryo in various culture media and in coculture [J].Molecular Reproduction and Development,2004,68(1):72-80.
[30] Sharov A A,Masui S,Sharova L V,et al.Identification of Pou5f1,Sox2,and Nanog downstream target genes with statistical confidence by applying a novel algorithm to time course microarray and genome-wide chromatin immunoprecipitation data [J].BMC Genomics,2008,9(1):269.
[31] Keramari M,Razavi J,Ingman K A,et al.Sox2 is essential for formation of trophectoderm in the preimplantation embryo [J].PlOS ONE,2010,5(11):e13952.
[32] Niwa H,Toyooka Y,Shimosato D,et al.Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation [J].Cell,2005,123(5):917-929.
Promotion ofinvitrodevelopment of bovine somatic nuclear transfer embryos by PD0325901 and CHIR99021
WU Xin-ying1,2,SANG Yuan-kun1,3,WANG Yong-sheng1,3,ZHANG Yong1,3,HUA Song1,3
(1CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2SchoolofMedicine,NankaiUniversity,Tianjin300071,China;3KeyLaboratoryofAnimalBiotechnologyoftheMinistryofAgriculture,Yangling,Shaanxi712100,China)
【Objective】 The objective was to investigate the effect of MAP2K and GSK3 pathway inhibitors PD0325901 and CHIR99021 on development capacity and expression of pluripotency genes (OCT4,SOX2,KLF4,DPPA3,CDX2,GATA4,andNANOG)invitroof bovine somatic cell nuclear transfer embryos.【Method】 Using bovine skin fibroblasts as donors and MII oocytes as receptors,SCNT embryos were constructed and treated with PD0325901+CHIR99021 (PD0325901 0.4 μmol/L,CHIR99021 3 μmol/L) as tests and mSOF+DMSO as control for 72 hinvitro.In addition,embryos were counted and development rates and embryonic development related genes were analyzed by real-time PCR.【Result】 Compared to untreated control,the 2i treatment increased the blastocyst rate and total blastocyst cell number while decreased apoptosis rate markedly.The expression of pluripotency related genes was upgraded.Expression ofNANOGandSOX2 was significantly increased and that ofGATA4 decreased while the rest genes were not significantly changed.SCNT embryo pluripotent expression related genes were closer to IVF embryo.【Conclusion】 Treatment with 2i can optimize SCNT embryonic development state.
Micromolecular inhibitors;somatic cell clone;embryo development;bovine
时间:2015-08-05 08:56
10.13207/j.cnki.jnwafu.2015.09.004
2014-02-25
国家自然科学基金项目(31001008)
吴新颖(1989-),女,山东昌邑人,硕士,主要从事动物胚胎工程研究。E-mail:wuxinyingwxy@163.com
华 松(1976-),男,江西九江人,副教授,硕士生导师,主要从事动物胚胎工程与发育生物学研究。 E-mail:hs863@nwsuaf.edu.cn
Q813.7
A
1671-9387(2015)09-0023-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150805.0856.008.html
