泡菜发酵专用短乳杆菌的高密度培养
2015-01-06朱孔亮
朱孔亮, 吴 丹, 吴 敬*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
泡菜发酵专用短乳杆菌的高密度培养
朱孔亮1,2, 吴 丹1,2, 吴 敬*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
为了实现泡菜发酵专用短乳杆菌H3的高密度细胞培养,考察了培养基成分、培养条件、中和剂以及补料策略对菌体活菌数的影响。结果表明:菌体适宜培养基配方为葡萄糖25 g/L,酵母粉15 g/L,柠檬酸1.53 g/L,柠檬酸钠18.58 g/L,VB620 mg/L,MgSO4·7H2O 0.58 g/L,MnSO4· 5H2O 0.25 g/L,Tween-80 1 g/L,在培养过程中使用20%柠檬酸钠调节培养液pH值6.8~6.3、培养温度30℃、装液量40 mL/250 mL三角瓶,适宜补料培养方式为培养10 h和20 h时各补加4%的碳氮源(碳氮比为5∶3)。培养结束时培养液中短乳杆菌活菌数可达1.27×1010CFU/mL,为未优化前的7.5倍,是目前已报道的最高活菌数水平,为实现泡菜发酵专用的短乳杆菌发酵剂的工业化生产奠定基础。
短乳杆菌;泡菜发酵;高密度培养
短乳杆菌是乳酸菌中乳杆菌属的重要菌种,为革兰氏阳性菌,广泛分布于自然界中,具有高产酸、解毒、抑菌和提高机体免疫力等多种生理功效[1-4]。近年来,随着人们对短乳杆菌及其代谢产物研究的深入,短乳杆菌已逐渐被广泛地应用在食品生产[5-6]、饲料加工以及畜禽疾病防治[7]等方面。尤其在食品行业,作为泡菜发酵过程中的优势微生物之一,短乳杆菌能够赋予泡菜独特的风味、质地和口感,对泡菜发酵过程中产生的风味物质发挥着不可替代的作用[8]。
传统发酵泡菜因为其生产周期长、风味不稳定、安全性不高而逐渐被人工接种发酵泡菜所取代,而人工接种泡菜的关键在于直投式发酵剂的开发[9]。目前作为泡菜发酵专用直投式发酵剂的短乳杆菌较少[5],其瓶颈在于难以实现其高密度培养。建立短乳杆菌的高活性、高密度的培养方法,可以减少培养体积、减少设备投资、缩短生产周期,从而降低生产成本[10]。目前对于短乳杆菌高密度培养以制备直投式发酵剂的研究很少。贺稚非[11]等2006年将植物乳杆菌和短乳杆菌1∶1混合作为泡菜直投式发酵剂进行了高密度发酵优化,使乳酸菌活菌数达到7.24×109CFU/mL。任亚妮[12]等2011年通过响应面分析对影响短乳杆菌生长的发酵培养基进行优化,使短乳杆菌菌体浓度达到5.21×109CFU/mL。
作者所在实验室从自然发酵泡菜中分离得到一株产风味能力较好的短乳杆菌H3,并成功将其运用于人工接种发酵泡菜中。作者在此基础上对H3的高密度培养的培养基和培养条件进行优化,综合运用碱性中和法与补料培养法,以期提高短乳杆菌的培养密度,实现低成本、高效率的培养以适合工业化生产。
1 材料与方法
1.1 菌株
菌株:短乳杆菌(Lactobacillus brevis H3),由江南大学食品科学与技术国家重点实验室分离。
1.2 培养基
MRS培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母粉5 g,K2HPO42 g,醋酸钠5 g,柠檬酸铵2 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,吐温80 1 g,蒸馏水1 L,pH 6.8,115℃灭菌20 min。
MRS固体培养基:在MRS液体培养基中加入1.5~2 g/dL琼脂,用于短乳杆菌的活化、平板活菌计数。
1.3 试剂
蛋白胨、酵母粉:购自Oxoid公司;其他试剂:均为国产分析纯,购自国药化学试剂有限公司。
1.4 培养方法
1.4.1 菌种活化 从-80℃保藏的甘油管中接种于MRS固体培养基,30℃培养至出现菌落,然后挑取单菌落接入另一个固体培养基,出现菌落后,重复以上操作3次,即得活化菌种。
1.4.2 摇瓶发酵培养 将活化后的菌种接入MRS液体培养基(50 mL培养基/250 mL三角瓶),30℃、200 r/min回转式摇床培养32 h。
1.4.3 短乳杆菌活菌计数 将待测样品按10倍梯度稀释,取0.1 mL各稀释度的菌液,滴加到MRS平板计数培养基的表面,均匀涂布后置于30℃培养48 h,每一稀释度重复3皿,计数发酵液活菌数(CFU/mL)。
2 结果与讨论
2.1 培养基成分的确定
培养基是微生物生存的营养来源,不同微生物所需要的营养成分及浓度配比并不完全相同,需要按照实际情况加以选择。因此,作者对初始发酵培养基(MRS)实施进一步优化,以促进菌体的生长。
2.1.1 碳源及其浓度对H3菌体浓度的影响 碳源是微生物生长过程中重要的能量物质,作为培养基的主要成分之一,它参与了菌体的生长和产物的合成,对微生物的发酵生产影响重大。
按照含碳质量分数相等的原则,分别以麦芽糖、乳糖、蔗糖、甘油、可溶性淀粉代替MRS培养基中的葡萄糖(20 g/L)为碳源进行单因素实验。如图1所示,H3对6种碳源的利用情况有所不同,最容易利用的是麦芽糖,其次是葡萄糖,而对其他碳源利用程度较差。但是,从原料的价格方面考虑,实验采用比较价廉的葡萄糖作为H3增殖的碳源。
在葡萄糖作为惟一碳源的基础上,选择合适的葡萄糖质量浓度至关重要。由图2可知,随着葡萄糖质量浓度的增加,活菌浓度呈先增加后降低的趋势。当葡萄糖质量浓度为40 g/L时,活菌浓度达到最高,为3.86×109CFU/mL。由图2可知,适当提高葡萄糖质量浓度有利于菌体的生长,但是当葡萄糖质量浓度达到40 g/L以上时,菌体的生长受限。
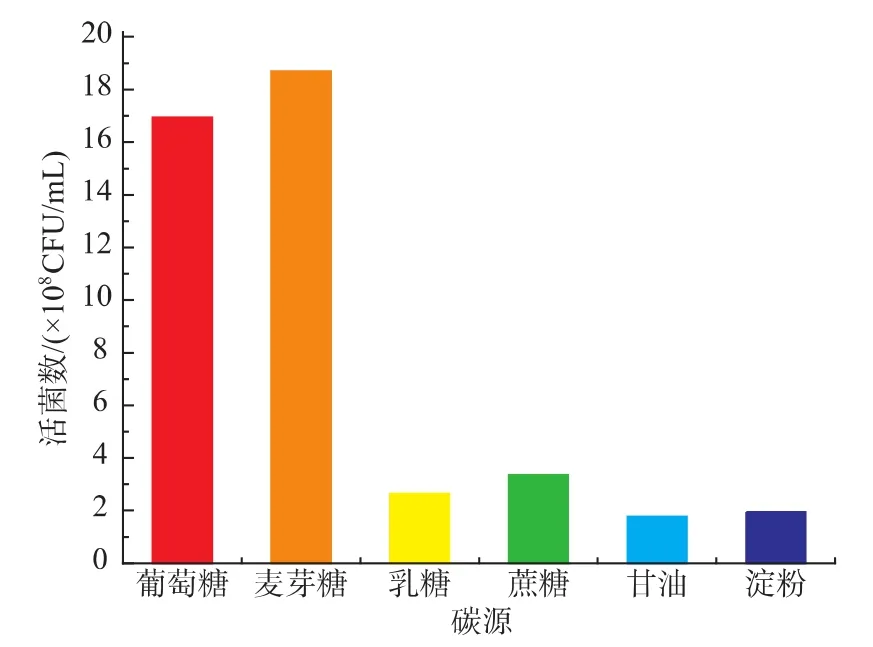
图1 碳源对H3菌体浓度的影响Fig.1 Effects of different carbon sources on the viable cell counts of H3
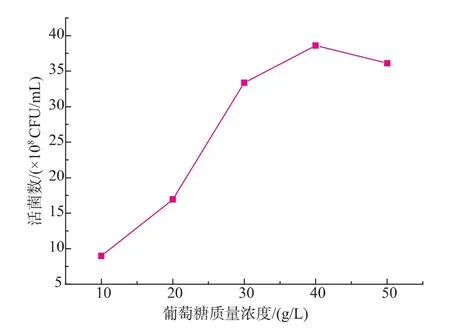
图2 葡萄糖质量浓度对H3菌体浓度的影响Fig.2 Effects of different concentrations of glucose on the viable cell counts of H3
2.1.2 氮源及其质量浓度对H3菌体浓度的影响氮源是构成菌体细胞物质的主要成分,如氨基酸、蛋白质、核酸等和含氮代谢物等。按照上述碳源的研究方法,通过改变发酵培养基中的氮源来研究不同氮源对H3生长的影响。按照含氮质量分数相等的原则(MRS培养基中含氮量为25 g/L),分别以蛋白胨、酵母粉、牛肉膏、NH4Cl、(NH4)2SO4、NaNO3、尿素为氮源进行单因素实验。
如图3所示,短乳杆菌对不同氮源的利用情况不同,对酵母粉利用较好,活菌数相应较高,达到4.72×109 CFU/mL。在此基础上对氮源浓度进行考察,结果见图4。当酵母粉质量浓度为30 g/L时,短乳杆菌活菌数最高,为4.84×109CFU/mL。
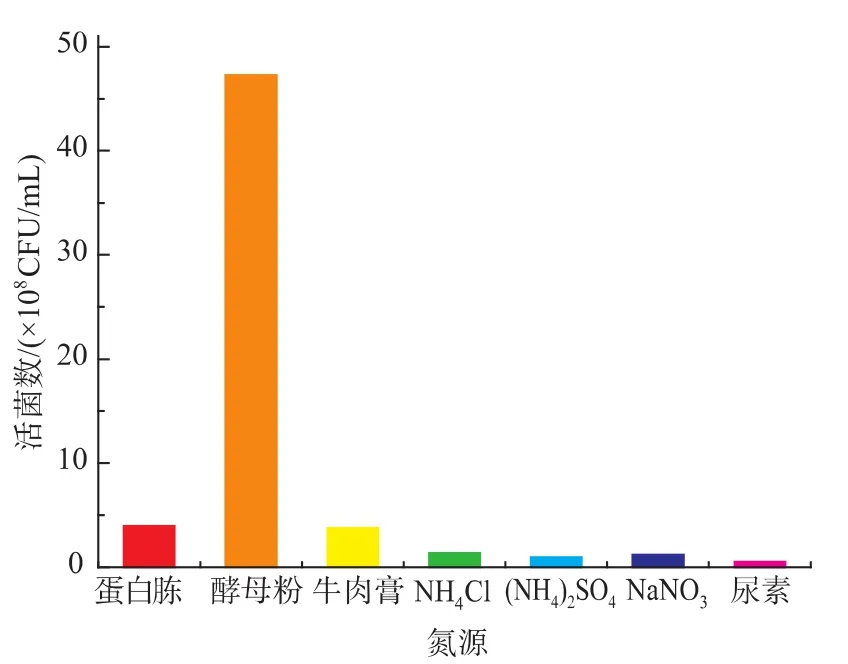
图3 氮源对H3菌体浓度的影响Fig.3 Effects of different nitrogen sources on the viable cell counts of H3
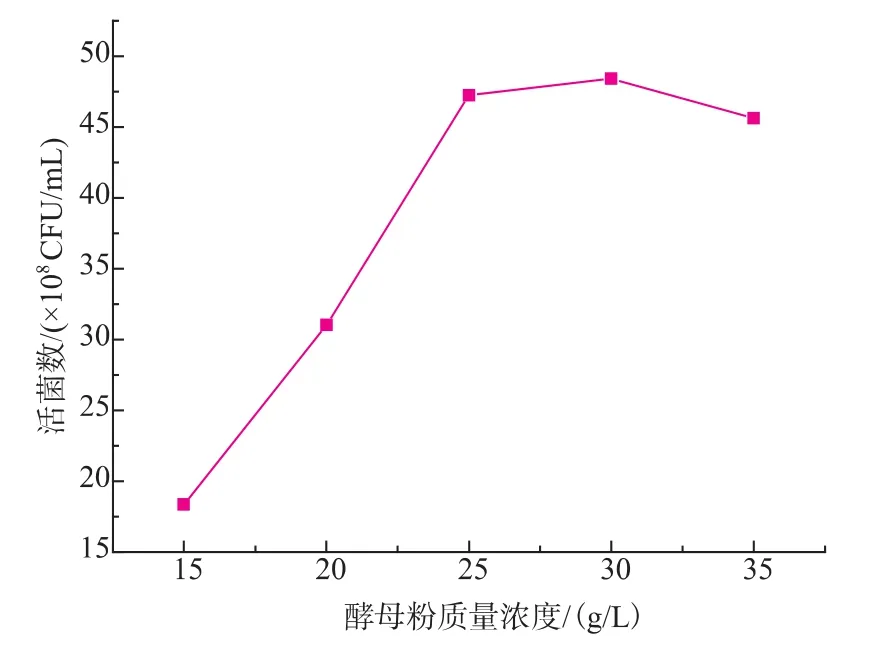
图4 酵母粉质量浓度对H3菌体浓度的影响Fig.4 Effects of different concentrations of yeast on the viable cell counts of H3
2.1.3 缓冲盐及其质量浓度对H3菌体浓度的影响在确定碳源、氮源及其质量浓度后,研究了不同的缓冲体系和同一缓冲体系不同质量浓度对H3生长的影响情况。由表1可见,在培养基中加入缓冲盐比不加缓冲盐的乳酸菌活菌数要明显增多,其中,以柠檬酸/柠檬酸钠缓冲体系对菌体促生长效果最好,最高活菌浓度达到5.36×109CFU/mL。
2.1.4 生长因子及其质量浓度对H3菌体浓度的影响
生长因子是微生物正常代谢必不可少且不能用简单的碳源或氮源自行合成的有机物。维生素是第一类生长因子,大多数维生素是辅酶的组成成分。有些氨基酸也是多种微生物的生长因子,因此作者对补充维生素和氨基酸的效果进行了研究。
在上述确定的培养基各组分基础上分别补充了10 mg/L的B族维生素(包括VB1、VB2、VB5、VB6、VB9)与维生素C,补充了100 mg/L的精氨酸、L-半胱氨酸盐酸盐,接种发酵测定菌体生长情况,结果见图5。
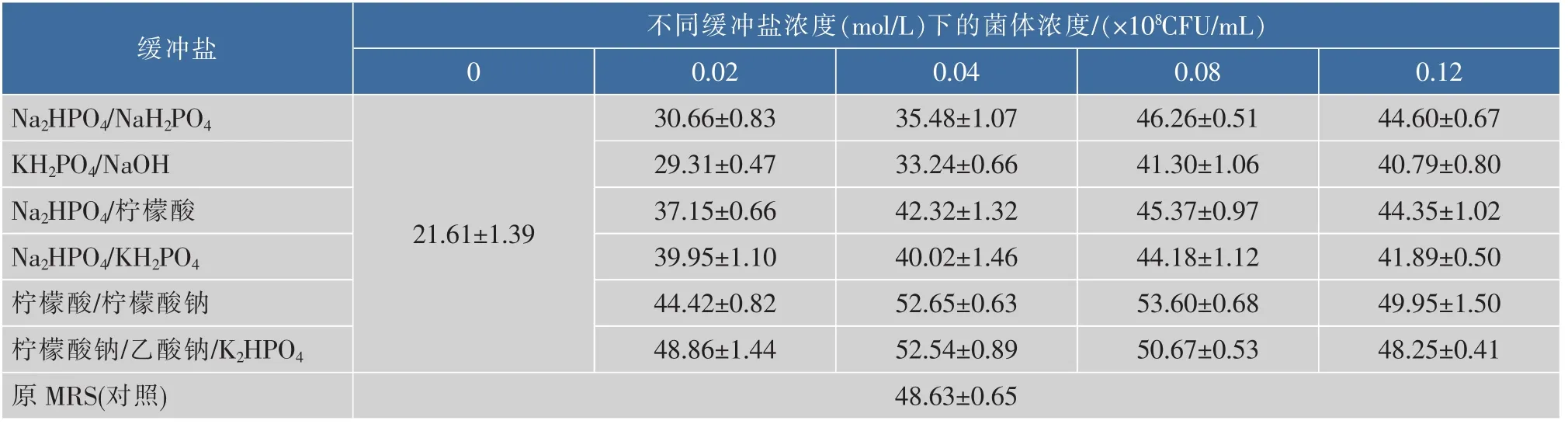
表1 不同缓冲盐体系培养基中的H3菌体浓度(x±SD,N=3)Table 1 Cell density of H3 in medium with different buffer salts(x±SD,N=3)
由图5可知,添加不同种类的生长因子对H3活菌数具有一定影响。实验选取对H3菌体增殖效果较好的VB6,进一步其作为生长因子的最佳质量浓度进行了优化,结果见图6。由图6可知,VB6的添加量为20 mg/L时活菌浓度最大,达到5.62×109CFU/mL。
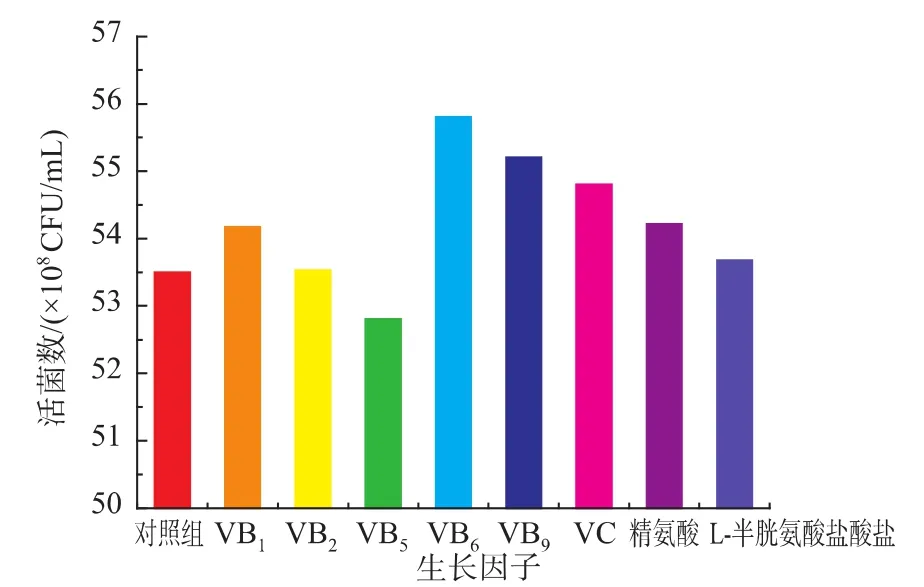
图5 生长因子对H3菌体浓度的影响Fig.5 Effects of different growth factors on the viable cell counts of H3
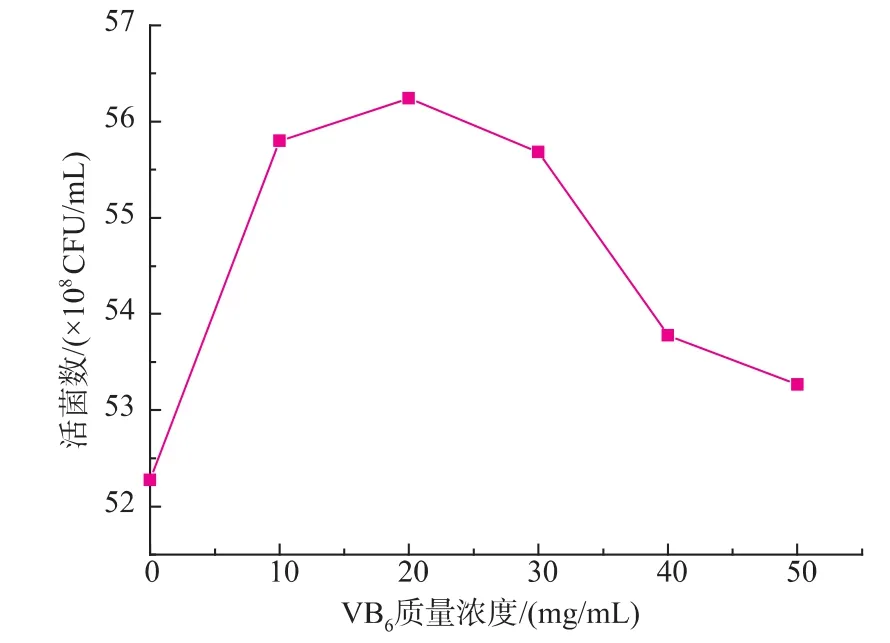
图6 VB6质量浓度对H3菌体浓度的影响Fig.6 Effects of different concentrations of VB6on the viable cell counts of H3
2.1.5 发酵培养基的正交试验 为综合考察各因素对菌体生长的效果,选取在单因素试验中增菌效果较明显的3个因素(葡萄糖、酵母粉、柠檬酸缓冲盐浓度)进行正交实验,每个因素选取两个水平,优化H3的最佳增菌培养基,实验设计见表2。
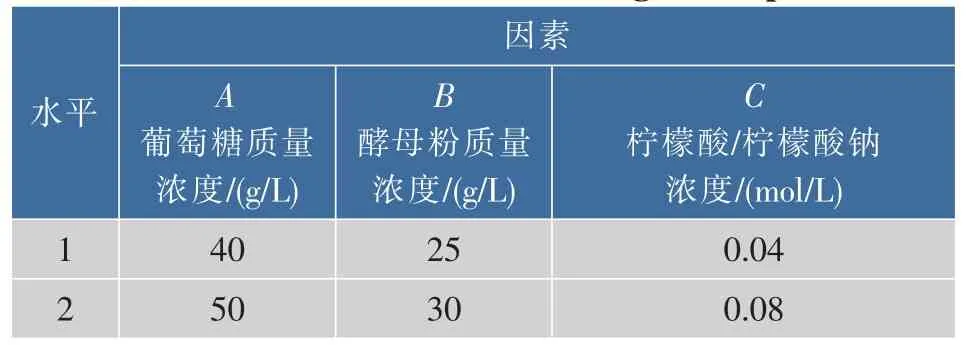
表2 正交实验方案设计Table 2 Factors and levels of orthogonal experiment
对正交试验结果进行极差分析,见表3。在本实验范围内各指标对活菌数的影响大小依次为:缓冲盐质量浓度>葡萄糖质量浓度>酵母粉质量浓度;较好的实验方案应该是:A2B2C2。采用此较优组合的发酵培养基进行发酵验证,活菌数为6.10×109CFU/mL。即培养基最佳配方为:葡萄糖50 g/L,酵母粉 30 g/L,柠檬酸/柠檬酸钠缓冲盐 0.08 mol/L,VB620 mg/L,MgSO4·7H2O 0.58 g/L,MnSO4·5H2O 0.25 g/L,吐温80 1 g/L。

表3 正交试验极差分析结果Table 3 Orthogonal experiment result analysis
2.2 培养条件的确定
2.2.1 培养温度对H3菌体浓度的影响 温度是影响菌体生物量积累的重要因素,不同微生物的最适生长温度范围也不同,在发酵过程中应严格地控制培养温度。作者比较了不同温度条件下H3的生长情况,结果见图7。由图7可知,温度对H3活菌数的影响较大,温度过高过低都不利于其生长。在20、25、30、35、37℃下培养,菌体浓度达到最大,分别为4.57×109、5.24×109、6.10×109、5.12×109、4.79×109CFU/mL。因此,确定30℃为H3生长的最适温度。
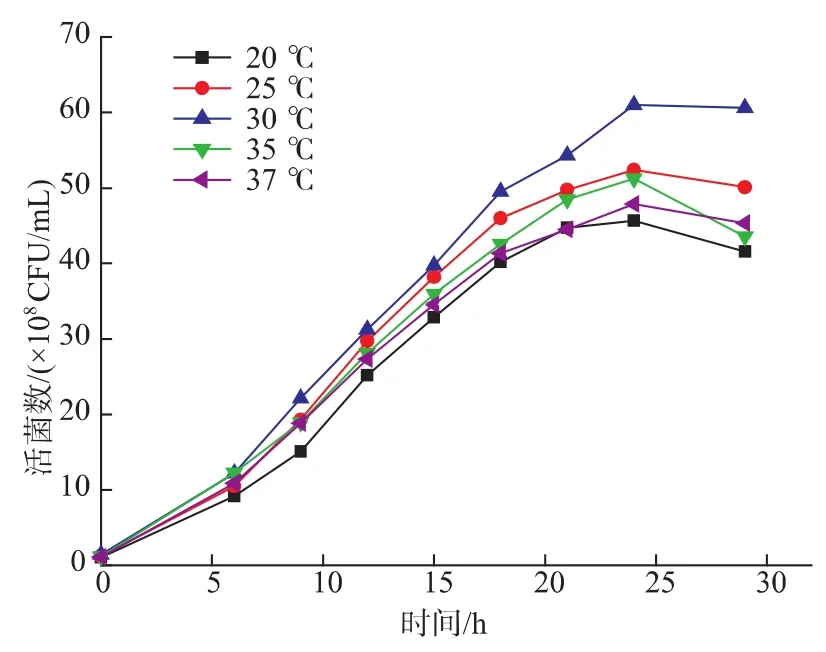
图7 温度对H3菌体浓度的影响Fig.7 Effects of different temperatures on the viable cell counts of H3
2.2.2 装液量对H3菌体浓度的影响 溶氧是微生物进行能量代谢最重要参数,通常是好氧发酵的限制性因素,不同微生物的生长对溶氧量有不同范围的要求,而在其他培养条件都相同的情况下,不同的装液量直接影响了液体培养基中氧溶解量。作者比较了不同装液量对H3的生长情况的影响,结果见图8。由图8可知,以250 mL三角瓶进行乳酸菌培养,不同的装液量对乳酸菌体的生长有一定的影响,回转速度200 r/min时,其中装液量为40 mL/ 250 mL时菌体细胞数最多,装液量超过40 mL时和低于40 mL时,菌体细胞数都有所降低。这可能是因为短乳杆菌为微好氧菌,培养基中维持一定的溶氧量会导致菌体的快速生长。因此,过多或过少的溶氧量都不利于菌体的生长繁殖,通过实验可以得出40 mL/250 mL(回转速度200 r/min)为培养H3最佳的摇瓶装液量。
2.3 pH调节和补料培养
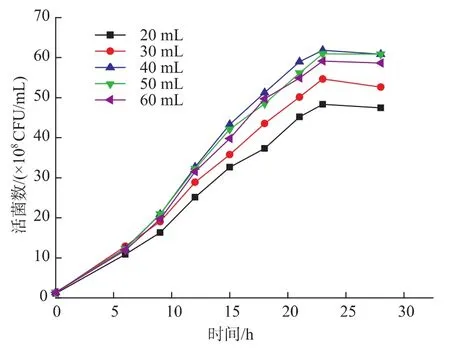
图8 装液量对H3菌体浓度的影响Fig.8 Effects of different quantity of medium on the viable cell counts of H3
2.3.1 加碱调节pH对H3菌体浓度的影响 乳酸菌在培养的过程中,其代谢产物中的乳酸等有机酸会引起培养液pH较大的变化,培养液pH过低会使乳酸菌自身的生长受到抑制。因此为了得到高密度的乳酸菌培养物,采用向培养液中添加适当的中和剂,将pH值调节在一定范围内,部分消除了抑制乳酸菌生长的酸胁迫作用。试验中,控制培养过程中pH值为5.3~4.8、5.8~5.3、6.3~5.8、6.8~6.3、7.3~6.8,分别选用 6 mol/L NaOH、20%NH3·H2O、20% Na2CO3、20% 柠檬酸钠作为中和剂,30℃培养测定其活菌数,结果见图9-10。
由图9-10可知,添加中和剂使短乳杆菌最大活菌数有所提高,但活菌数达到最大值时的培养时间略有延长。由图9可知,pH值对乳酸菌生长情况影响非常大,培养过程中pH值控制在6.8~6.3之间,获得的活菌数最高。不在这个pH值范围内的乳酸菌生长的活菌数较低,特别是pH值控制在5.3~4.8内的最低。由图10可知,添加不同的中和剂对短乳杆菌的生长影响程度有所不同,以20%柠檬酸钠作为中和剂影响效果最显著,最大活菌数为8.93×108CFU/mL,比对照组提高8.5×107CFU/mL。综合实验结果,添加柠檬酸钠最好,其次为Na2CO3和NH3·H2O,NaOH效果最差,这可能是因为NaOH作为强碱对乳酸菌生长有一定的抑制作用,因此,最后确定添加20%柠檬酸钠溶液作为中和剂。
2.3.2 补料一定比例的碳源和氮源对L.brevis H3菌体浓度的影响
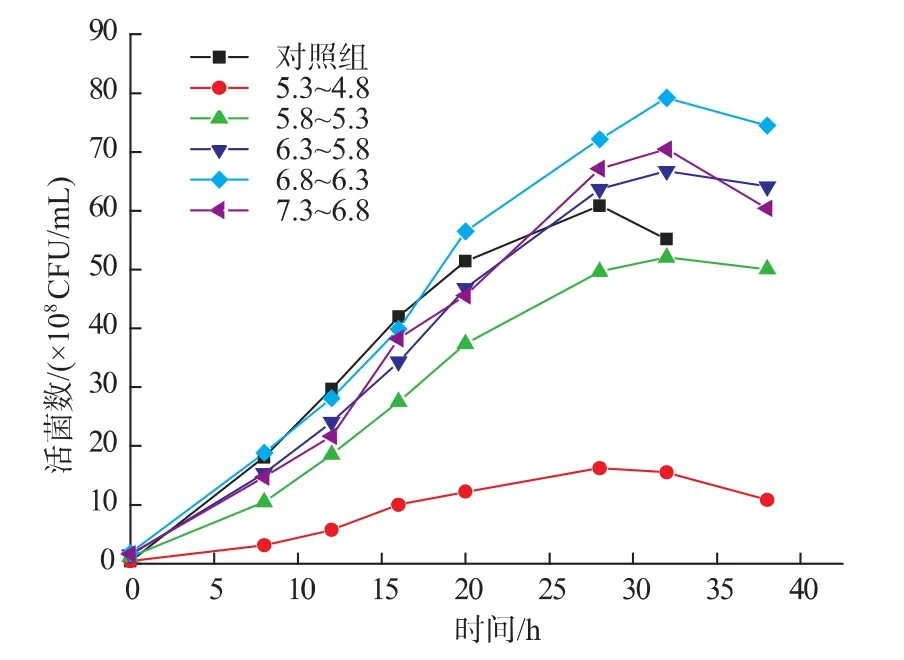
图9 pH对发酵过程H3菌体浓度的影响Fig.9 Effects of pH on the viable cell counts of H3 during fermentation process
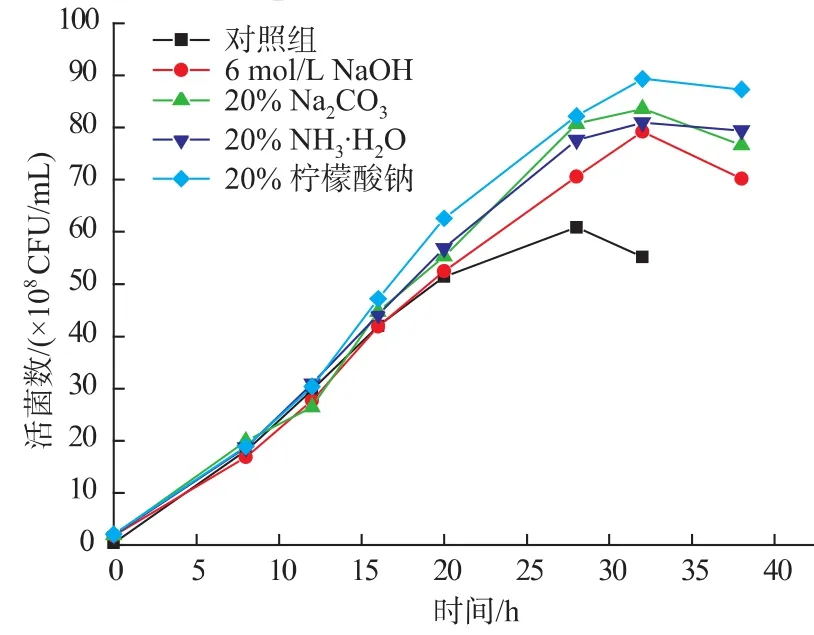
图10 中和剂对发酵过程H3活菌数的影响Fig.10 Effects of different neutralizers on the viable cell counts of H3 during fermentation process
在高密度发酵过程中,菌体迅速繁殖需要大量的碳源和氮源作为其能量物质,而作为分批发酵,过高质量浓度的碳氮源会导致底物抑制效应,不利于乳酸菌生物量的积累,所以在前面确定了最佳培养条件的基础上,分别进行以下5种碳氮源补料方案(A、B、C、D、E)进行培养:将碳氮源以5∶3比例混合均匀,培养基初始加入4%、8%、12%的一次性投料;初始4%,10 h后补料4%;初始4%,10 h和20 h后各补料4%。测定各培养液的活菌浓度,测得活菌数变化的结果见图11。由图11可知,一次性投料的A、B、C三个方案中,其中方案B的活菌数最高。另外D、E二种补料培养方案都比一次性投料方案要好,而且方案E测得活菌数比方案D要高8.3× 107CFU/mL。因此,培养基初始4%,10 h和20 h后各补料4%的碳氮源混合补料培养菌体,活菌数达到1.27×1010CFU/mL。
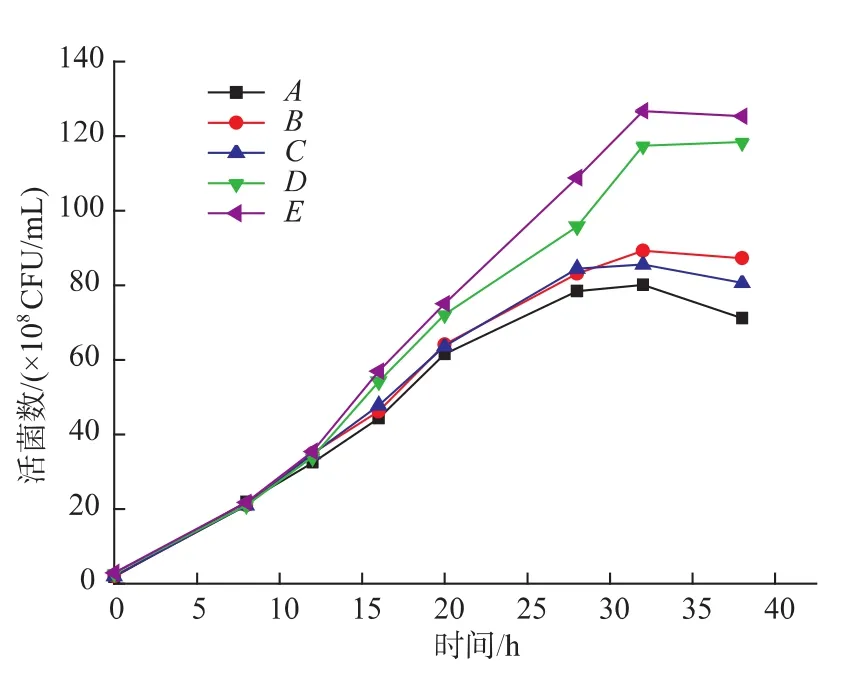
图11 补料一定比例的碳氮源对发酵过程H3活菌数的影响Fig.11 Effects of feeding batch in specific C/N ratio on the viable cell counts of H3 during fermentation process
3 结语
以一株泡菜发酵专用的短乳杆菌H3为出发菌株进行菌体高密度培养,适宜培养基配方为:葡萄糖25 g/L,酵母粉15 g/L,柠檬酸1.53 g/L,柠檬酸钠18.58 g/L,VB620 mg/L,MgSO4·7H2O 0.58 g/L,MnSO4·5H2O 0.25 g/L,Tween-80 1 g/L,在培养过程中使用20%柠檬酸钠调节培养液pH值在6.8~6.3、培养温度30℃、装液量40 mL/250 mL,200 r/min回转式摇床培养,适宜补料培养方式为培养10 h和20 h时各补加4%的碳氮源(碳氮比为5∶3)。培养结束后,培养液中乳酸菌菌体活菌数可达1.27×1010CFU/mL,为目前报道的最高水平。本研究为短乳杆菌的泡菜工业化应用奠定了基础。
[1]Ronka E,Malinen E,Saarela M,et al.Probiotic and milk technological properties of Lactobacillus brevis[J].International Journal of Food Microbiology,2003,83(1):63-74.
[2]Nobuta Y,Inoue T,Suzuki S,et al.The efficacy and the safety of Lactobacillus brevis KB290 as a human probiotics[J]. International Journal of Probiotics and Prebiotics,2009,4(4):263-70.
[3]Segawa S,Nakakita Y,Takata Y,et al.Effect of oral administration of heat-killed Lactobacillus brevis SBC8803 on total and ovalbumin-specific immunoglobulin E production through the improvement of Th1/Th2 balance[J].International Journal ofFood Microbiology,2008,121(1):1-10.
[4]Della Riccia D,Bizzini F,Perilli M,et al.Anti-inflammatory effects of Lactobacillus brevis(CD2)on periodontal disease[J].Oral Diseases,2007,13(4):376-385.
[5]Wiander B,Ryhanen E-L.Laboratory and large-scale fermentation of white cabbage into sauerkraut and sauerkraut juice by using starters in combination with mineral salt with a low NaCl content[J].European Food Research and Technology,2005,220(2):191-195.
[6]Meignen B,Onno B,Gélinas P,et al.Optimization of sourdough fermentation with Lactobacillus brevis and baker's yeast[J]. Food microbiology,2001,18(3):239-45.
[7]刘辉,季海峰,张董燕,等.饲粮添加短乳杆菌对生长猪生长性能和血清生化指标的影响[J].动物营养学报,2013,25(1):182-189. LIU Hui,JI Haifeng,ZHANG Dongyan,et al.Effects of Lactobacillus brevis supplementation on growth performance,serum biochemical indices of growing pigs[J].Chinese Journal of Animal Nutrition,2013,25(1):182-189.(in Chinese)
[8]Di Cagno R,Coda R,De Angelis M,et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology,2013,33(1):1-10.
[9]余文华,张其圣,陈功,等.直投式菌剂发酵泡菜的动态研究[J].食品与发酵科技,2010,46(6):12-15. YU Wenhua,ZHANG Qisheng,CHEN Gong,et al.Study on dynamic changes during the fermentation of direct vat set pickles[J]. Food and Fermentation Technology,2010,46(6):12-15.(in Chinese)
[10]刘振民.乳酸菌高密度培养及浓缩型发酵剂研究[D].哈尔滨:东北农业大学,2002.
[11]贺稚非,向瑞玺,李洪军,等.泡菜活性直投式乳酸菌发酵剂的研究[J].食品科学,2006,27(8):191-197. HE Zhifei,XIANG Ruixi,LI Hongjun,et al.Study on high effective lyophilized lactic acid direct vat starter culture concentrates in fermented vegetables[J].Food Science,2006,27(8):191-197.(in Chinese)
[12]任亚妮,车振明,金建,等.短乳杆菌的培养条件及高密度培养研究[J].中国调味品,2011,36(6):48-53. REN Yani,CHE Zhenming,JIN Jian,et al.Study on the cultivating conditions and proliferation od medium components of Lactobacillus brevis[J].China Condiment,2011,36(6):48-53.(in Chinese)
Investigation on High Cell Density Cultivation of Lactobacillus brevis Specific for Vegetable Fermentation
ZHU Kongliang1,2, WU Dan1,2, WU Jing*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
In order to achieve the high cell density culture of Lactobacillus brevis H3,the effects of medium formula,culture conditions,neutralizers and feed batch methods on viable cell counts have been investigated.Suitable medium formulation are:25 g/L glucose,15 g/L yeast,1.53 g/L citric acid,18.58 g/L sodium citrate,20 mg/L VB6,0.58 g/L MgSO4·7H2O,0.25 g/L MnSO4·5H2O,1 g/L Tween-80.Optimal culture conditions are temperature 30℃,cultural fluid amount 40mL,pH 6.3~5.8,using 20%sodium citrate as neutralizer.Appropriate feeding culture method is 4%carbon and nitrogen sources(C/N ratio 5:3),which was added after 10 and 20 h,respectively.When fermented at the optimal culture conditions,the number of the bacteria cells was up to 1.27×1010CFU/mL,which was 7.5 times as high as that when it was not optimized.
Lactobacillus brevis,vegetable fermentation,high cell density cultivation
TS 201.3
A
1673—1689(2015)08—0828—07
2014-03-03
国家863计划项目(2011AA100904)。
*通信作者:吴 敬(1969—),女,江苏镇江人,工学博士,教授,博士研究生导师,主要从事食品与发酵工程方面的研究。E-mail:jingwu@jiangnan.edu.cn
