蛹虫草Cordyceps militaris JN168菌株的诱变育种及液态发酵产虫草素
2015-01-06刘金彬沈建增蔡宇杰廖祥儒罗军侠张大兵
刘金彬, 沈建增, 蔡宇杰*, 廖祥儒, 罗军侠, 张大兵
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3江苏汉邦科技有限公司,江苏 淮安223001)
蛹虫草Cordyceps militaris JN168菌株的诱变育种及液态发酵产虫草素
刘金彬1,2, 沈建增3, 蔡宇杰*1,2, 廖祥儒1,2, 罗军侠3, 张大兵3
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3江苏汉邦科技有限公司,江苏 淮安223001)
利用离子束、亚硝基胍及离子束-亚硝基胍诱变法处理蛹虫草Cordyceps militaris JN168,初步获得了几株较高产虫草素的菌株。通过进一步筛选得到复合诱变菌2,并对该菌的液态发酵培养基组分进行了优化。实验结果表明:蛹虫草液态发酵产虫草素的最佳培养基组分为(g/L),葡萄糖40,酵母浸粉25,MgSO4·7H2O 0.6,K2HPO4·3H2O 0.6,KH2PO40.6。优化后虫草素产量提高了5倍,最高达1 045.65 mg/L。
蛹虫草;虫草素;诱变;液态发酵;优化
蛹虫草是中国名贵的中药,是一类极具保健功能的大型药用真菌,属于真菌界、真菌门、子囊菌亚门、粪壳菌纲、肉座菌目、麦角菌科、虫草属[1],是虫草属的模式种,学名为Cordyceps militaris,又名北冬虫夏草、北虫草[2]。近来大量文献报道,蛹虫草可产多种活性物质,像虫草素、甘露醇、虫草多糖等[3-4]。虫草素作为主要有效成分引起了人们的高度重视。
虫草素又名虫草菌素、3′-脱氧腺苷等,是第一个从真菌中分离出来的核苷类抗生素[3]。1951年,Cunningham等观察到被蛹虫草寄生的昆虫组织不易腐烂,随后从中分离到虫草素。虫草素分子式为C10H13N5O3,相对分子质量为251,熔点为230~231℃,溶于水、热乙醇和甲醇,不溶于苯、乙醚和氯仿,紫外光的最大吸收波长为259 nm[5-6]。很长时间以来,国内外学者对虫草素的药理作用和产品开发研究具有极高的兴趣。大量实验研究表明,虫草素对DNA和RNA合成、hnRNA和mRNA转录后修饰以及腺苷酸环化酶等均具有抑制作用,具有抗炎、抗真菌、抗癌及抗病毒等多种生理活性[9]。1997年,FDA批准美国波士顿大学医学中心进行虫草素治疗急性淋巴性白血病和慢性粒细胞白血病的一期临床试验[4];2008年,FDA批准美国OncoVista公司进行虫草素与腺苷脱氨酶抑制剂喷司他丁联合用药,治疗末端脱氧核苷酸阳性白血病细胞(TDT+)的一期、二期临床试验。目前,由虫草素制成的抗白血病的新药已经进入三期临床。
目前虫草素的生产主要有化学合成和生物合成两种方法[7]。与生物合成法相比,化学合成虫草素得率低,合成过程中使用了大量有机溶剂(如氯仿等),对环境会造成污染等缺陷。蛹虫草发酵合成虫草素有寄主培养、固态培养、代料栽培和液体培养等多种方式。固态培养过程,蛹虫草产生的虫草素有98%从菌丝体分泌到周围的发酵培养基中[8],因而液态发酵对于生产虫草素具有明显优势。作者对蛹虫草进行了亚硝基胍-离子束的复合诱变育种,并对发酵条件进行了优化,以期提高虫草素产量,促进虫草素的产业化生产。
1 材料与方法
1.1 材料
1.1.1 菌种 蛹虫草Cordyceps militaris JN168:保藏于中国典型培养物保藏中心,保藏号为CCTCC NO:M2011333。
1.1.2 培养基
1)斜面培养基(g/L):葡萄糖20,酵母浸膏10,MgSO4·7H2O 1.0,K2HPO4·3H2O 0.5,KH2PO40.5,琼脂20;pH自然,121℃灭菌20 min。
2)种子培养基(g/L):葡萄糖30,酵母浸膏10,MgSO4·7H2O 1.0,K2HPO4·3H2O 1.0,KH2PO41.0;pH自然,121℃灭菌20 min。
3)发酵培养基(g/L):葡萄糖40,酵母浸粉10,MgSO4·7H2O 1.0,K2HPO4·3H2O 1.0,KH2PO41.0;pH自然,121℃灭菌20 min。
1.2 方法
1.2.1 诱变剂的配制 准确称取500 mg 1-甲基-3-硝基-1-亚硝基胍(NTG),放入干净烧杯中,先加入5 mL丙酮或甲酰胺进行溶解,然后加入95 mL、pH 6.0的0.1 mol/L磷酸缓冲液,配制成5 mg/mL的溶液。
1.2.2 孢子悬液的制备 将菌株 Cordyceps militaris JN168接种在种子斜面培养基,在25℃培养6~7 d,加入13 mL、pH 6.0的磷酸缓冲液,用接种环刮下孢子或用移液枪吹打下孢子(尽量不要弄下菌丝体)[12],将孢子悬液倒入无菌试管,用无菌磷酸缓冲液适量稀释制成OD600值在0.6~0.8之间的孢子悬液。
1.2.3 NTG诱变 取一定量5.0 mg/mL的NTG溶液,分别稀释成1.0、2.0、3.0、4.0 mg/mL各1.5 mL。从不同质量浓度的NTG溶液中,各取0.5 mL加入到4个无菌离心管,并标记为1号。重复2次以上实验,分别标记为2号、3号。然后取3个灭菌离心管各加0.5 mL磷酸缓冲液作为对照。在15个离心管中各加0.5 mL孢子悬液。将1号及一个对照在30℃下振荡10 min,将2号及一个对照在30℃下振荡20 min,剩下的3号及对照处理30 min。时间到达后,立即稀释一定倍数停止药品作用,然后涂平板,并在25℃下培养4 d并计数。
1.2.4 离子束诱变 在超净工作台中,分别取9片金属载片置于酒精灯外焰灼烧30 s,待冷却后放到灭菌的玻璃平板中,取20 μL孢子悬液涂在金属载片上。将装有样品载片的平板移至ARTP诱变系统操作仓,用无菌镊子将载片放在相应孔位,调节载片台下方旋钮,使载片处于气流端口3 mm处,并关闭操作仓门。在其他参数一定的条件下,分别把处理时间设定为0、6、8、10、12、14、16、18、20 s。待样品处理完毕后,用无菌镊子将载片放至装有1 mL磷酸缓冲液的灭菌离心管中。将离心管放在振荡器上振荡3 min,形成新的孢子悬液。对新的孢子悬液进行适当稀释,取100 μL稀释液涂布平板,并在25℃培养箱中培养4 d后计数。
1.2.5 复合诱变 挑选出经亚硝基胍诱变后的高产菌株,用1.2.4的方法进行再次诱变。
1.2.6 致死率的计算 平板培养4 d后,小的菌落已经长成,拿出平板在光亮处数平板菌落数,并记下菌落数目,按照下列公式算出致死率。

1.2.7 诱变菌株稳定性检测 选择菌落边缘整齐,表面光滑,菌丝紧密,色泽光亮,颜色呈现橘红色、金黄色的菌株[10-11],洗下孢子经行培养皿培养,再从中挑选,然后反复传代实验,直到选出形态、颜色稳定的菌株,之后进行摇瓶检测。检测结果稳定的菌株可以作为种子菌株进行摇瓶实验。
1.2.8 液态发酵 按1.2.2制好的孢子悬液,以体积分数10%接种于种子培养基中,25℃、200 r/min摇瓶培养4 d,获得种子培养液。然后,按体积分数10%接种,将种子培养液接种于发酵培养基中,250 mL三角瓶装液50 mL,培养温度25℃,转速150 r/min,培养周期8 d。
1.2.9 生物量的测定 通过真空泵将得到的发酵液进行抽滤处理,收集湿菌体,置于60℃下恒温干燥至恒重,用分析天平称质量。
1.2.10 虫草素浓度的测定 将1.2.8抽滤下来的发酵液以10 000 r/min离心10 min,取上清液2 mL,经0.45 μm纤维滤膜过滤,除掉一些杂质,然后用高效液相色谱法测定虫草素质量浓度。检测条件:紫外检测波长为260 nm,流动相为 15%的甲醇,进样量20 μL,柱温30℃,流速1 mL/min[13]。
2 结果与分析
2.1 诱变菌株生长特性研究
从多次诱变实验中,选择几株长势良好,具有代表性的菌株,对其生长情况进行进一步研究。原始菌株生长缓慢,且不稳定,容易退化,最主要的是虫草素的产量并不是很理想。经过几天的光照培养,原始菌株及诱变菌的平板长势见图1。
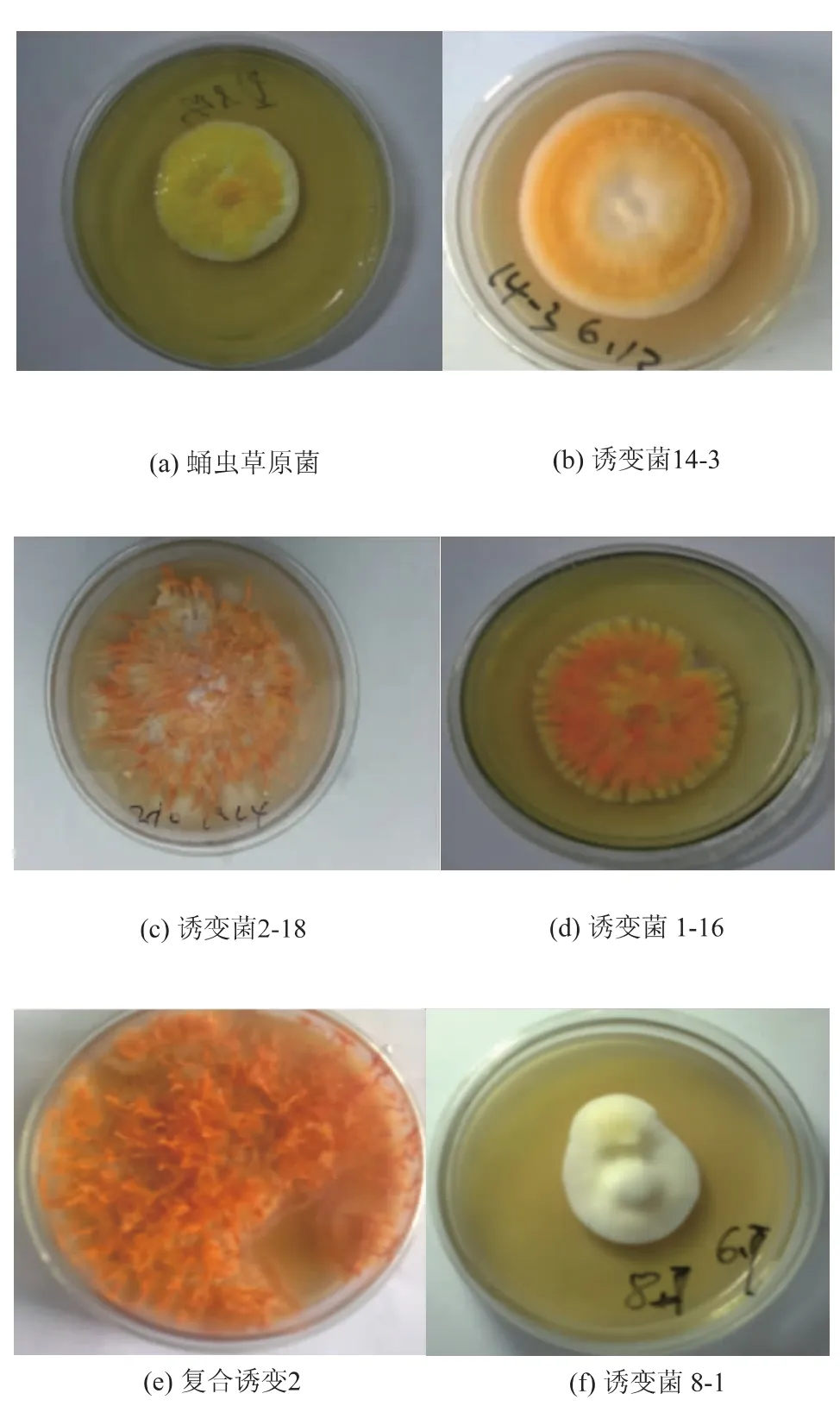
图1 蛹虫草Cordyceps militaris JN168原菌及诱变菌14-3、1-16、2-18、复合诱变2的平板形态特性Fig.1 Morphological character of Cordyceps militaris JN168 on plate(a)and mutant strains(b、c、d、e、f)
图1中各图片显示了不同菌在转色后的颜色及形态特征(各图片皆是转色稳定时拍摄)。可以看出,诱变后菌株的形态及生长状况发生很大的差异。诱变菌14-3和诱变菌1-16的形态发生略微差异,但是颜色变化有很大差异。然而,诱变菌2-18和复合诱变菌2菌株的形态和颜色变化都很大,尤其是形态变化,两株菌在平板中都长出很高的子实体,颜色由原菌的橘黄色变为橘红色。诱变菌8-1是典型的负突变菌株,颜色变为白色,虫草素产量也会很低。所以转色后为白色或形态畸变的初筛时舍弃。
2.2 诱变菌株液态发酵产虫草素的质量浓度验证
2.2.1 NTG诱变菌株产虫草素质量浓度测定 经过多次传代后,选出长势良好的菌株,接种于斜面培养基培养,待其长满斜面后,制成孢子悬液,进行摇瓶实验验证,结果见图2。从图2可以看出,诱变菌虫草素的产量基本上比原菌低,原菌产量为203.57 mg/L,但诱变菌株1-16的产量为289.29 mg/L,比原菌提高85.72 mg/L。诱变菌1-16转色比原菌深,所以选择诱变菌1-16进一步进行传代培养。
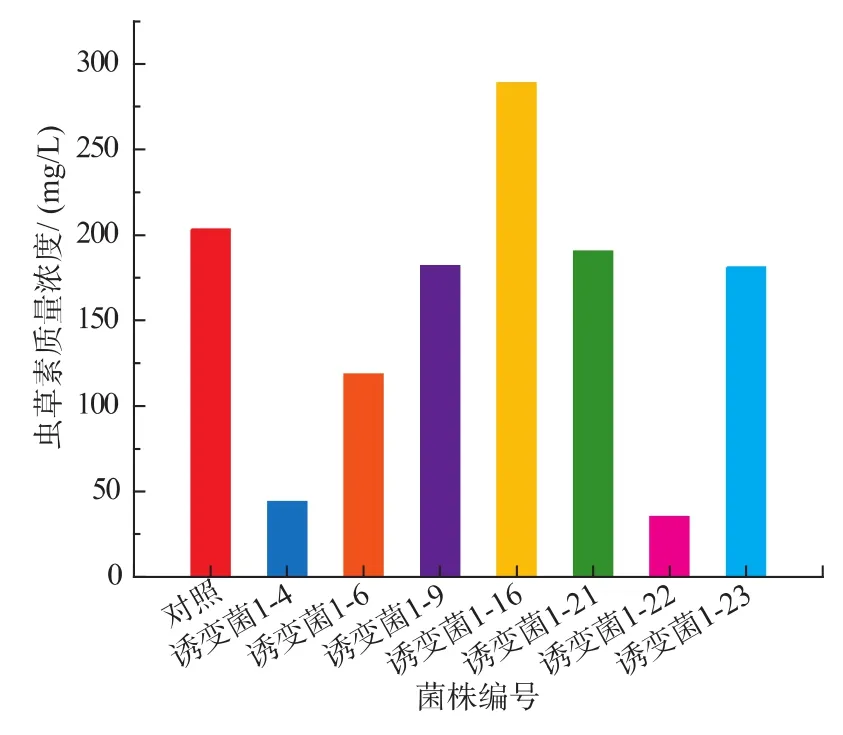
图2 NTG诱变菌液态发酵产虫草素的质量浓度Fig.2 Production of cordycepin by NTG mutant strain in liquid fermentation
2.2.2 第二次NTG诱变菌株产虫草素质量浓度测定 在第一次实验的基础之上,选择更佳的诱变浓度及诱变时间进行处理。涂平板并进行培养。待菌落转色后,挑出转色好的菌株继续培养,经过数代、数十代的传代培养,挑出稳定的菌株进行摇瓶验证实验,结果见图3。从图3可以看出,诱变菌2-18虫草素的产量远高于原菌产量。诱变菌2-18的产量达553.51 mg/L,而原菌产量只有300.72 mg/L,所以选择诱变菌2-18进一步试验。
2.2.3 离子束诱变菌株产虫草素浓度测定 ARTP(常压室温等离子体)技术是使用氦气作为工作气体,通过射频辉光放电产生富含各种高能活性粒子的等离子体。ARTP所产生的活性粒子能够对菌株、植株、细胞等的遗传物质造成损伤,并诱发生物细胞启动SOS修复机制。SOS修复过程为一种高容错率修复,因此修复过程中会产生种类丰富的错配位点,并最终稳定遗传进而形成突变株。ARTP对生物的遗传物质损伤效果明显、损伤机制丰富、尤其是对于真核生物的遗传物质均有很强的损伤效果。离子束处理时间和孢子死亡率关系见图4。
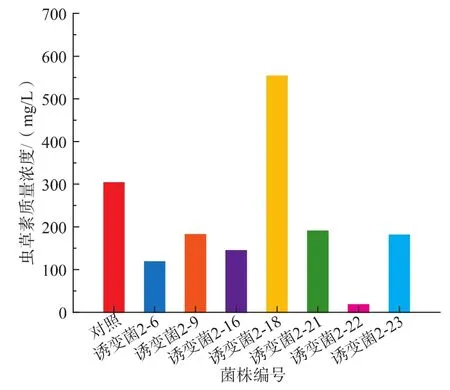
图3 NTG诱变菌液态发酵产虫草素的质量浓度Fig.3 Production of cordycepin by NTG mutant strain in liquid fermentation
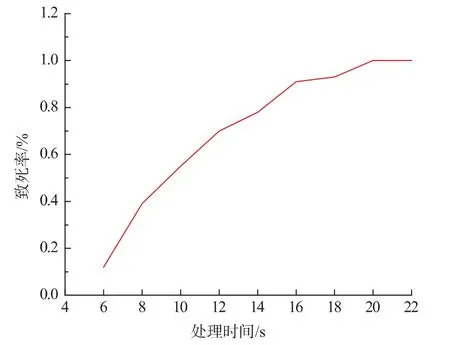
图4 蛹虫草Cordyceps militaris JN168离子束处理时间与死亡率的关系Fig.4 Relationship between ion beam processing time and death rate of Cordyceps militaris JN168
从图4可以看出,随着处理时间的增长,孢子的死亡率也不断增加。当处理时间为14 s时,孢子的死亡率达78%,在16、18 s时,孢子死亡率几乎不再改变。当超过18 s时,孢子死亡率顿时提高,几乎全部死亡。根据文献报道,产量形状的诱变育种倾向于致死率70%~80%,因此选择14 s为最佳处理时间。
因为致死曲线只能作为一种参考,所以在14 s左右多选择几个处理时间。诱变后的菌株经多次传代培养后,进行摇瓶实验验证,结果见图5。原菌产量为203.57 mg/L,并且有4株菌高于原菌产量,产量最高的为诱变菌14-3,其产量为362.62 mg/L,高于原菌产量159.05 mg/L,所以选择诱变菌14-3作为这次诱变的目的菌株,进行下一步实验。
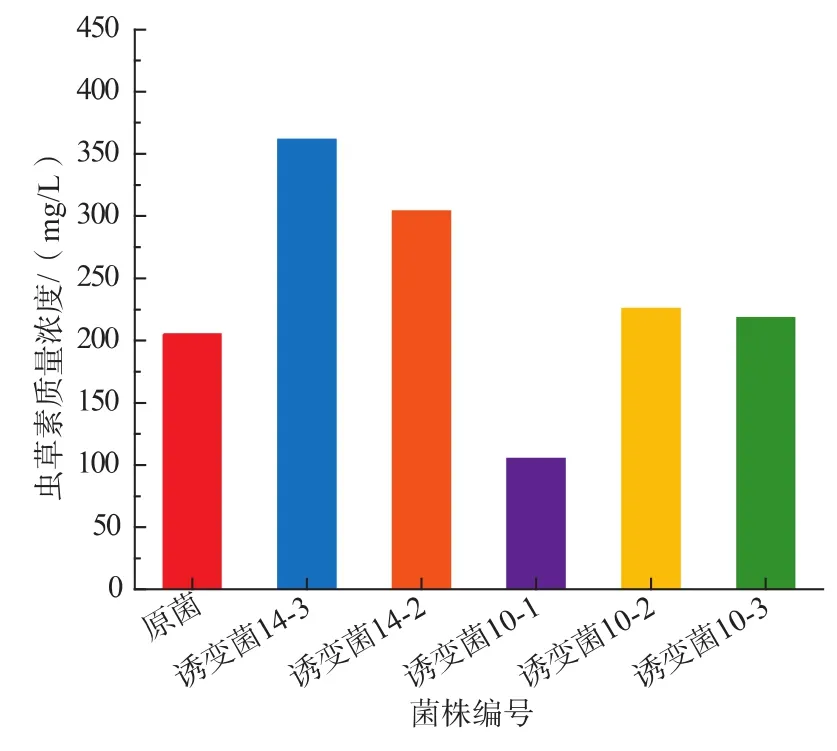
图5 离子束诱变菌液态发酵产虫草素的质量浓度Fig.5 Production of cordycepin by ion beam mutant strain in liquid fermentation
2.2.4 复合诱变菌株产虫草素浓度验证 复合诱变利用两种原理不同的诱变方法,先后对菌株进行诱变,在菌株自我修复的过程中,再对诱变菌株进行诱变。在整个诱变过程中,菌株遗传物质的损伤加大,生物细胞SOS修复更加紊乱,致使菌株的死亡率提高,存活下来的菌株在培养过程出现正突变的几率变大。所以,诱变菌株更有可能高于原菌产量。经过多次分离、纯化,得到复合诱变菌2等几株菌,如图1(e)所示。
原始菌株在平板及其他器皿培养过程中,很少会出现子实体。而且子实体的产生,在大多数情况下需要温差刺激。然而,复合诱变菌2并不需要温差刺激,并且子实体的产生时间稍微缩短。将菌株接种于斜面,培养至长满斜面为止。然后制成孢子悬液进行摇瓶实验,结果见图6。发酵8 d后,原菌产量为231.62 mg/L,复合诱变菌2的产量高达620.74 mg/L,选择复合诱变菌2继续实验。
2.3 液态发酵培养基优化
将得到的4株诱变菌进一步分离、纯化,在各代培养培养过程中,选择长势良好的菌落进行液态发酵,发酵后产虫草素的情况见图7。诱变菌1-16和诱变菌14-3在多次传代过程中,虫草素产量表现并不是很稳定,分别在250 mg/L和300 mg/L左右徘徊。诱变菌2-18的虫草素产量变化很不稳定,不宜进行下一步实验。复合诱变菌2的虫草素产量相当稳定,产量维持在600 mg/L左右,可以作为目的菌株,进行下一步实验。
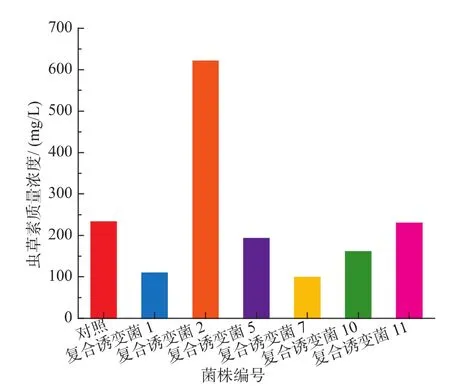
图6 复合诱变菌液态发酵产虫草素的质量浓度Fig.6 Production of cordycepin by compound mutation strain in liquid fermentation
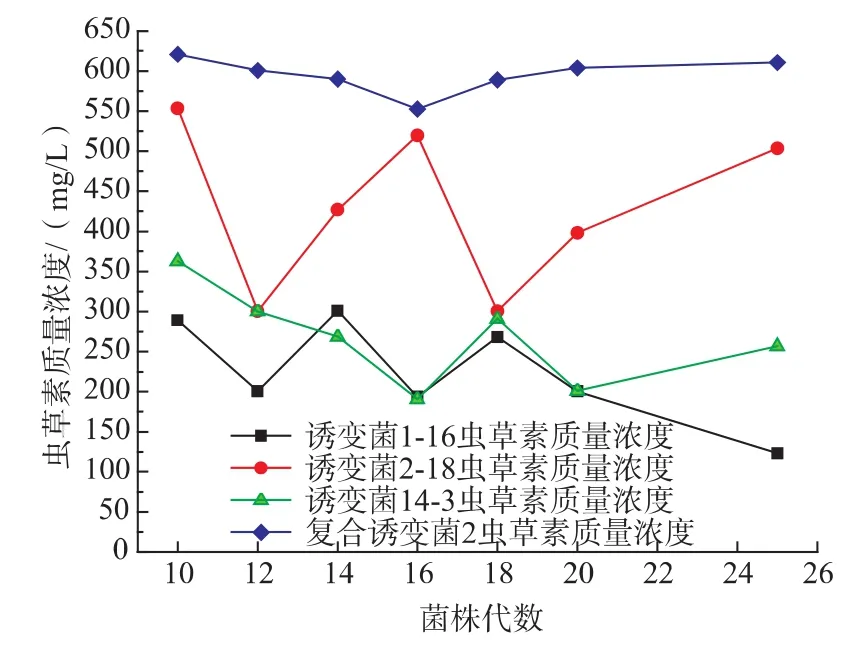
图7 诱变菌株液态发酵产虫草素的稳定性Fig.7 Stability study of liquid fermentation to produce cordycepin by mutant strains
2.3.1 葡萄糖质量浓度对Cordyceps militaris JN168菌体生长和产虫草素质量浓度的影响
葡萄糖作为还原糖的一种,也是培养基主要的碳源之一。对菌体的生长有重要的作用,而且对该菌产物虫草素的影响更为明显。将发酵培养基中葡萄糖质量浓度设为20、30、40、50、60 mg/mL,进行不同质量浓度的葡萄糖对Cordyceps militaris JN168产菌体和虫草素的实验。由图8可以看出,葡萄糖质量浓度为40 mg/mL时,虫草素质量浓度最高,达732.24 mg/L。随葡萄糖质量浓度的增加,菌体质量浓度也不断增加,但在葡萄糖质量浓度为50 mg/mL时,菌体质量浓度达到最大。
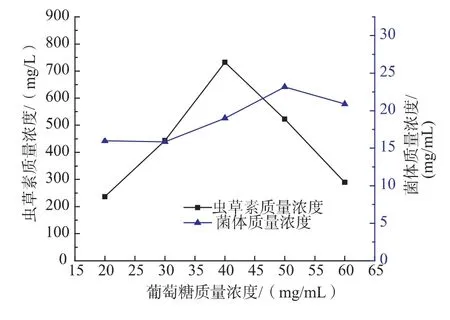
图8 葡萄糖质量浓度对蛹虫草菌体生长和产虫草素的影响Fig.8 Effect of maltose concentration on cell growth and the production of cordycepin
2.3.2 酵母浸粉质量浓度对 Cordyceps militaris JN168菌体生长和产虫草素的影响 酵母浸粉作为重要的氮源,对菌株的生长也是不可或缺,对实验中菌体的产物也尤为重要。设定培养基中酵母浸粉质量浓度为10、15、20、25、30、35、40、45 mg/mL,进行不同质量浓度的酵母浸粉对Cordyceps militaris JN168产菌体和虫草素的影响实验。由图9可以看出,酵母浸粉质量浓度为25 mg/mL时,虫草素质量浓度最高。菌体质量浓度与虫草素的产量并没有确定的关系,菌体质量浓度也并不是很有规律。从图9可以看出,菌体质量浓度取得最高值时,酵母浸粉质量浓度为30 mg/mL。
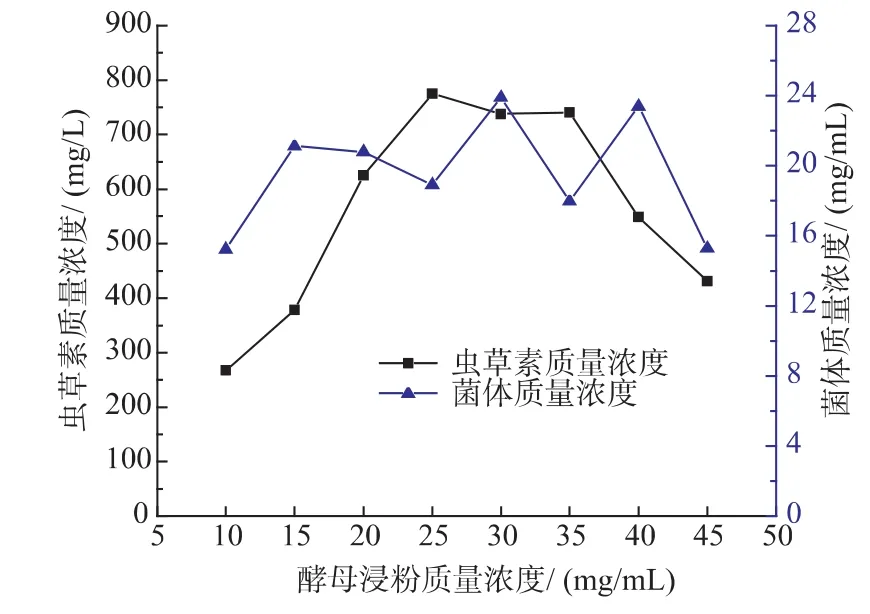
图9 酵母浸粉质量浓度对蛹虫草菌体生长和产虫草素的影响Fig.9 Effect of yeast extract powder concentration on cell growth and the production of cordycepin
2.3.3 硫酸镁质量浓度对Cordyceps militaris JN168菌体生长和产虫草素的影响 镁离子是许多重要酶(己糖激酶、柠檬酸脱氢酶、羧化酶等)的激活剂,能促进碳水化合物的新陈代谢、磷酸盐的转化等,其水平与细胞内聚胺水平相关,从而影响核糖体稳定性和RNA合成。过多的镁离子反而对菌体的生长及产物的形成有抑制作用。所以,合适的镁离子质量浓度对菌体的产物尤为重要。将培养基中MgSO4·7H2O质量浓度设定为0.2、0.4、0.6、0.8、1.0、1.2 mg/mL,进行不同质量浓度的MgSO4·7H2O对Cordyceps militaris JN168产菌体和虫草素的影响实验。由图10可以看出,MgSO4·7H2O质量浓度为0.6 mg/mL时,虫草素质量浓度最高,最高时达到879.27 mg/L。菌体质量浓度在MgSO4·7H2O质量浓度为1.0 mg/mL时最大,达到33 mg/mL。
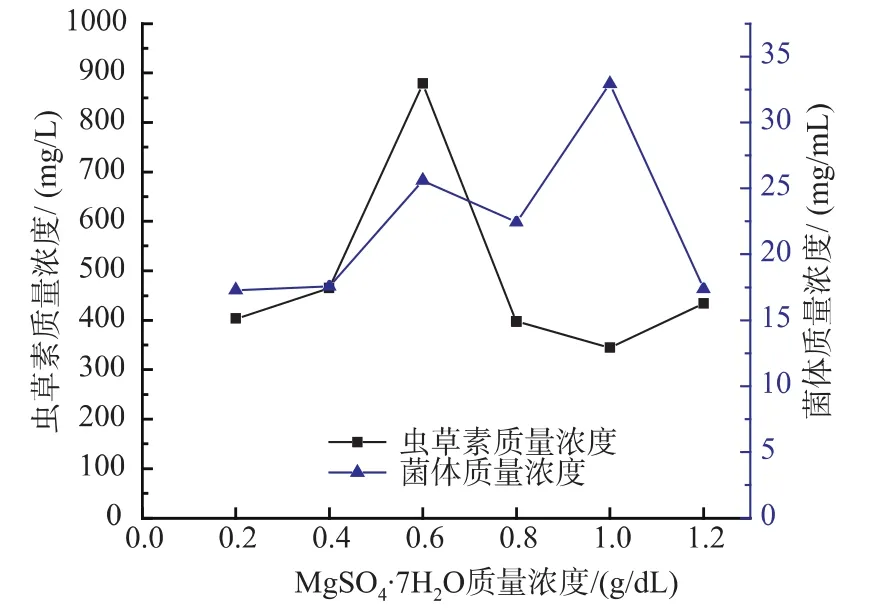
图10 MgSO4·7H2O质量浓度对蛹虫草菌体生长和产虫草素的影响Fig.10 Effect of MgSO4·7H2O concentration on cell growth and the production of cordycepin
2.3.4 磷酸氢二钾和磷酸二氢钾浓度对Cordyceps militaris JN168菌体生长和产虫草素的影响K2HPO4·3H2O和 KH2PO2不仅提供磷离子和钾离子,而且对培养液的pH有一定的影响,所以K2HPO4·3H2O和KH2PO2合适的质量浓度对菌体生长和产物形成尤为重要。选取K2HPO4·3H2O和KH2PO2的质量浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mg/mL进行试验。由图11可以看出,在K2HPO4· 3H2O和KH2PO2质量浓度为0.6 mg/mL时,虫草素产量最高,达1 045.65 mg/L,但菌体质量浓度最低。当K2HPO4·3H2O和KH2PO2质量浓度为0.8 mg/mL,菌体浓度最高,达23.36 mg/mL。
3 结语
虫草素具有抗癌、抗白细胞、抗菌等多种生物活性和丰富的药用价值,由于虫草的天然资源有限,人工生产虫草素已经迫在眉睫。目前虫草素的生产主要是化学合成和生物合成两种方法。然而,化学合成多采用一些有机溶剂,不但对产物有一定的影响,而且还会污染环境,因此生物合成就有了不可比拟的优势。尽管如此,生物合成还是有一些弊端难以克服,像产量低、周期长等。所以提高产量和缩短周期就成了科研人员及工作人员亟待解决的难题。
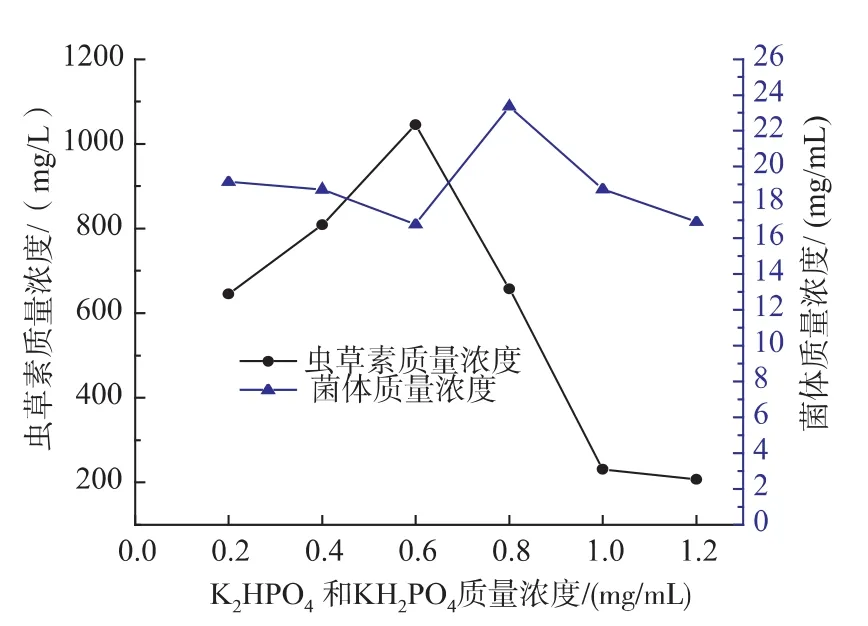
图11 K2HPO4·3H2O和KH2PO4质量浓度对蛹虫草菌体生长和产虫草素的影响Fig.11 Effect of K2HPO·43H2O and KH2PO4concentration on cell growth and the production of cordycepin
本研究经过实验,得出以下几项结论:
1)通过诱变育种和多次传代培养,得到两株比较有价值的菌株诱变菌14-3和复合诱变菌2。
2)通过优化得到最优培养基:葡萄糖40 g/L,酵母浸粉25 g/L,MgSO4·7H2O 0.6 g/L,K2HPO4·3H2O 0.6 g/L,KH2PO40.6 g/L。
3)在不添加前体物质,发酵时间8 d的条件下,得到虫草素产量为1 045.65 mg/L,与岳翠翠等报道的633.47 mg/L相比,提高了412.18 mg/L[12]。
[1]蔡友华,刘学铭.虫草素的研究与开发进展[J].中草药,2007,38(8):1269-1272. CAI Youhua,LIU Xueming.Advances in research and development of cordycepin[J].Chinese Traditional and Herbal Drugs,2007,38(8):1269-1272.(in Chinese)
[2]孟兆丽,朱凯,冯云,等.蛹虫草多糖抑菌及抗氧化作用研究[J].食品研究与开发,2008,29(9):31-33. MENG Zhaoli,ZHU Kai,FENG Yun,et al.Study on the bacteriostasic activity and antioxidation of Cordyceps Militaris polysaccharide[J].Food Research and Development,2008,29(9):31-33.(in Chinese)
[3]夏春雨,孙巍,刘学铭.虫草有效成分的研究进展[J].中国食用菌,2009,28(2):3-7. XIA Chunyu,SUN Wei,LIU Xueming.Research advances on bioactive constituents of Cordyceps[J].Edible Fungi of China,2009,28(2):3-7.(in Chinese)
[4]Seldin D,Lahey S,Urbano A,et al.Phase I trial of cordycepin and deoxycoformycin in TdT-positive acute leukemia[J].Blood,1997,90(10):246b.
[5]焦彦朝,梁宗琦,刘爱英.虫草生物活性物质研究概况[J].贵州农业科学,1990(3):53-58. JIAO Yanchao,LIANG Zongqi,LIU Aiying.Metabolites with biological activelity in the genus Cordyceps and it’s anamorph[J]. Journal of Guizhou Agricultural Sciences,1990(3):53-58.(in Chinese)
[6]刘东泽,陈伟,高新华,等.虫草菌素(3′-脱氧腺苷)研究进展(综述)[J].上海农业学报,2004,20(2):89-93. LIU Dongze,CHEN Wei,GAO Xinhua.Progress of research on cordycepin(3’-Deoxyadenosine)[J].Acta Agriculturae Shanghai,2004,20(2):89-93.(in Chinese)
[7]文庭池,康冀川,雷帮星,等.前体及营养物提高蛹虫草虫草菌素产量的研究[J].食品科学,2010,31(5):175-79. WEN Tingchi,KANG Jichuan,LEI Bangxing,et al.Enhanced production of cordycepin by submerged culture using additives in Cordyceps militaris[J].Food Science,2010,31(5):175-79.(in Chinese)
[8]Masuda M,Urabe E,Sakurai A,et al.Production of cordycepin by surface culture using the medicinal mushroom Cordyceps militaris[J].Enzyme and Microbial Technology,2006,39(4):641-646.
[9]余伯成,唐永范,唐亮,等.虫草素的药理作用研究进展[J].现代药物与临床,2011,26(5):434-436. YU Bocheng,TANG Yongfan,TANG Liang,et al.Advances in study on pharmacological effects of cordycepin[J].Drugs& Clinic,2011,26(5):434-436.(in Chinese)
[10]车振明,王燕,周黎黎,等.原生质体紫外诱变选育蛹虫草新菌种的研究[J].食品与发酵工业,2004,30(4):35-38. CHE Zhenming,WANG Yan,ZHOU Lili,et al.Study on the breeding of a new variety of Cordyceps militaris by mutated withultraviolet radiation[J].College of Bioengineering of Xihua University,2004,30(4):35-38.(in Chinese)
[11]付鸣佳.蛹虫草产类胡萝卜素的研究[J].食品与生物技术学报,2005,24(5):107-110. FU Mingjia.Study on the carotenoid produced from Cordyceps militaris L[J].Food and Fermentation Industries,2005,24(5):107-110.(in Chinese)
[12]岳翠翠,沈健增,蔡宇杰,等.蛹虫草Cordyceps militaris JN168产虫草素液态发酵条件的优化[J].食品与生物技术学报,2013,32(2):135-142. YUE Cuicui,SHEN Jiangzeng,CAI Yujie,et al.Optimization of fermentation condition for codycepin by Cordyceps militaris[J]. Journal of Food Science and Biotechnology,2013,32(2):135-142.(in Chinese)
[13]陈涛,沈健增,蔡宇杰,等.大孔树脂分离纯化蛹虫草深层发酵液中虫草素的工艺研究[J].食品与生物技术学报,2012,31(4):38-42. CHEN Tao,SHEN Jiangzeng,CAI Yujie,et al.Purification of cordycepin from fermentation broth of Cordyceps militaris with macroporous resin[J].Journal of Food Science and Biotechnology,2012,31(4):38-42.
Mutation Breeding and Cordycepin Production Study of Cordyceps militaris JN168
LIU Jinbin1,2, SHEN Jianzeng3, CAI Yujie*1,2, LIAO Xiangru1,2, LUO Junxia3, ZHANG Dabing3
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China;3.Hanbon Science and Technology Co. Ltd,Huaian 223001,China)
Cordycepin is the major effective component of Cordyceps militaris,which is getting more and more attention for its hygienic and medical effects.In this study,we obtained several strains with high cordycepin yield from Cordycepsmilitaris JN168 by using ion beam,nitrosoguanidine and ion beam-nitrosoguanidine mixed mutation.After further screened,the high yield compound mutation strain 2 was obtained.Furthermore,the liquid medium composition of this strain was optimized for the fermentation of cordycepin.The results showed that the components of optimized medium were as follows:glucose 40 g/L,yeast extract 25 g/L,MgSO4·7H2O 0.6 g/L,K2HPO4·3H2O 0.6 g/L,KH2PO40.6 g/L.With this optimized medium,the yield of cordycepin increased 5 times,reaching 1 045.65 mg/L.
Cordyceps militaris,cordycepin,mutation,liquid fermentation,optimization
TQ 920.1
A
1673—1689(2015)08—0806—08
2014-03-19
国家自然科学基金项目(21275066)。
*通信作者:蔡宇杰(1973—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事生物工程方面的研究。E-mail:yjcai@jiangnan.edu.cn
