新疆阿魏菇抗氧化肽分离纯化及抗氧化性质
2015-01-06郑晓吉许程剑牛博楠王雪铭朱丽莉
郑晓吉, 许程剑, 牛博楠, 陈 帅, 王雪铭, 朱丽莉
(石河子大学 食品学院,新疆 石河子832003)
新疆阿魏菇抗氧化肽分离纯化及抗氧化性质
郑晓吉, 许程剑*, 牛博楠, 陈 帅, 王雪铭, 朱丽莉
(石河子大学 食品学院,新疆 石河子832003)
采用超滤法、离子交换层析和凝胶过滤层析分离阿魏菇抗氧化多肽,研究其抗氧化性能。以胃蛋白酶-胰蛋白酶联合酶解阿魏菇多肽水解物为原料,采用超滤法分离阿魏菇水解液,使用10 000的超滤膜,将阿魏菇水解液分离成10 000以下的多肽组分和大于10 000的多肽组分,小于10 000的多肽组分的·OH自由基清除能力和DPPH·自由基清除能力较高。小于10 000的多肽组分经DEAE-32纤维素分离,得到3个洗脱峰,其中P3组分的羟基清除能力较高,达到
阿魏菇;抗氧化肽;分离纯化;抗氧化
Keywords:Pleurotus ferulae lenzi,antioxidant peptides,separation and purification,anti-oxidation
阿魏菇(Pleurotus ferulae lenzi)是新疆特色的食用菌,因其腐生或寄生在阿魏肥大的根茎部而得名,是一种干旱草原上生长的药食两用的食用菌,被誉为“西天白灵芝”、“草原上的牛肝菌”等美名。主要分布在印度、法国、中国新疆等地。在新疆分布在新疆准葛尔盆地边缘,这些区域一般都靠近沙漠,如伊犁、塔城、阿尔泰和木垒地区。阿魏菇子实体洁白如玉,肉质细嫩,营养丰富全面,其中富含蛋白质、多糖、氨基酸、维生素、不饱和脂肪酸、钙、磷、锌、锰、硒等营养成分,且蛋白质质量分数约占干菇的20%,含有18种氨基酸,具备人体必需的8种氨基酸[1]。经研究发现,阿魏菇在抗诱变、抗肿瘤、免疫调节、抗疲劳等方面具有良好的开发利用前景[2-4]。
阿魏菇抗氧化肽作为一种生物活性肽,既可以为机体提供营养,又可以清除机体内多余的自由基,具有增强机体抵御疾病、延缓衰老的作用。从阿魏菇中提取抗氧化肽不但经济效益好,并且天然健康。由于阿魏菇中蛋白质序列和结构的多样性,水解后的蛋白质也具有多样性,包含未完全水解的蛋白质、蛋白酶、多肽、寡肽、氨基酸和其他杂质。为了能得到纯度相对较高的多肽成分,还需对阿魏菇蛋白酶解产物进行分离纯化。分离多肽常用的方法有:超滤法、层析法、高效液相色谱法、凝胶色谱法等多种方法,其中大部分方法都是用活性肽的理化指标作为分离纯化的目的。分离多肽可以单独使用一种方法,如林倩[5]利用超滤法分离竹笋多肽,分别选用截留相对分子质量为5 000和1 000的竹笋多肽,优化了一级超滤和二级超滤,最终确定了超滤的最优条件。几种分离方法综合使用可以使分离效果更佳,如Bin Wang[6]等选用超滤、离子交换层析法、凝胶过滤层析分离法和反相高效液相色谱法对醇溶双髻鲨多肽进行分离纯化,最终获得抗氧化活性较高的抗氧化多肽活性组分。
作者采用超滤法、离子交换层析和凝胶过滤层析综合分离阿魏菇抗氧化多肽,以清除羟自由基的能力作为评价指标。超滤法采用截留相对分子质量为10 000的超滤膜,将阿魏菇多肽分成两个组分后,选择抗氧化活性高的组分进行离子交换层析,之后采用葡聚糖凝胶SephadexG-25进一步将阿魏菇抗氧化肽分离纯化,并初步测定其相对分子质量分布。并对阿魏菇抗氧化肽清除2,2-二苯基-1-苦基肼(DPPH·)、羟自由基(·OH)、超氧阴离子自由基(O2-·)还原能力进行测定,同时与维生素C作对照,测定其抗氧化活性,旨在为新疆阿魏菇有效成分的进一步研究提供理论基础。
1 材料与方法
1.1 材料与试剂
阿魏菇:新疆清河出产;胃蛋白酶:Biotopped公司;胰蛋白酶:Sigma公司;DEAE-32纤维素:Pharmacia公司;SephadexG-25:Sigma公司;10 000超滤膜(Pall Corporation);牛血清白蛋白;维生素B12;氧化型谷胱甘肽;还原性谷胱甘肽;L-酪氨酸;Tris;其他试剂均为国产分析纯。
阿魏菇抗氧化肽:制备;抗坏血酸、DPPH、无水乙醇、硫酸亚铁、水杨酸、双氧水、邻苯三酚、Tris、铁氰化钾、三氯化铁:均为分析纯。
1.2 仪器与设备
UV759紫外可见分光光度器:上海精科;BS2000电子天平:北京赛多利斯天平有限公司;LG100B鼓风干燥箱:上海实验仪器厂;Neofuge15R台式高速冷冻离心机:香港力康;真空冷冻干燥,上海爱朗仪器有限公司;酸度计:德国赛多利斯股份公司;超滤装置:科尔-帕默仪器公司;全自动收集器:上海琪特分析仪器有限公司;ELx808酶标仪,Biotek。
1.3 试验方法
1.3.1 超滤法分离纯化阿魏菇抗氧化肽阿魏菇抗氧化多肽配成20 mg/mL的溶液待用。组装超滤装置,将截留量为10 000的超滤膜装入装置,蒸馏水冲洗滤膜30 min。在室温条件下,压力30 000 Pa,将阿魏菇多肽水解液经循环泵输入到膜组件中。经过超滤装置可以将阿魏菇多肽水解液分为两个组分。超滤完成后用0.3 mol/L的氢氧化钠溶液正反冲洗滤膜30 min。最后,将分离到的两组分分别透析36 h后冷冻干燥,并测定其清除·OH自由基的能力[7-9]。
1.3.2 DEAE-32纤维素离子交换层析分离纯化阿魏菇多肽[10]
1)DEAE-32纤维素的活化处理:称取DEAE-32干粉10 g,浸泡在蒸馏水中大约24 h,然后倾去上层杂质,抽干。用0.5 mol/L的HCl溶液浸泡2 h,用去离子水冲洗到显中性为止,抽干。用0.5 mol/L的NaOH溶液浸泡2 h,用去离子水冲洗到显中性为止,抽干即可使用。
2)装柱、平衡、上样、洗脱、收集:DEAE-32洗脱。用50 mmol/L Tris-HCl(pH 8.0)的缓冲液平衡柱床,上样量2 mL,用0.1、0.3、0.5 mol/L NaCl平衡缓冲液分段洗脱,上样流速为1.5 mL/min,洗脱流速为1.0 mL/min,紫外检测波长220 nm。
1.3.3 葡聚糖凝胶SephadexG-25分离纯化阿魏菇多肽
1)葡聚糖凝胶SephadexG-25的活化处理:称取SephadexG-25干粉10 g[11],浸泡在蒸馏水中大约24 h,然后倾去上层杂质,抽干。用1 mol/L的NaOH溶液浸泡1 h,然后洗涤至中性。
2)装柱、平衡、上样、洗脱、收集:与离子交换层析相同。
3)葡聚糖凝胶SephadexG-25的洗脱条件:平衡缓冲溶液为100 mmol/L、pH7.5的Tris-HCl,收集过DEAE-32后抗氧化活性高的组分为上样液,上样量为2 mL,上样流速为0.3 mL/min,洗脱流速为0.2 mL/min,每管收集5 min,紫外检测波长220 nm。
1.4 阿魏菇抗氧化肽的相对分子质量分布
1.4.1 标准曲线的绘制在文献[12-13]的基础上,将方法略加改动。将相对分子质量已知的标品BSA(6 700)、维生素B12(1 355)、氧化型谷胱甘肽(612)、还原性谷胱甘肽(307)、L-酪氨酸(181),用蒸馏水将其配制成25 mg/mL的溶液,用滤膜过滤,然后分别进样2 mL。洗脱程序按照1.3.3,然后分别记下凝胶柱床的总体积(Vt)、外水体积(Vo)和分离物本身的体积(Ve),计算有效分配系数Kav
Kav=(Ve-Vo)/(Vt-Vo)
用相对分子质量的常用对数lgMw为纵坐标,Kav为横坐标,绘制标准曲线。
1.4.2 阿魏菇多肽的相对分子质量的测定将SephadexG-25分离得到的抗氧化活性最高的成分配成25 mg/mL的多肽溶液,膜过滤后按照1.3.3的洗脱程序洗脱。
1.5 抗氧化性能试验
1.5.1 DPPH·自由基清除能力的测定参照Qiang Zhao[14]等的方法并在此基础上进行了改进,具体方法如下:先向试管中加入3 mL DPPH·(0.1 mmol/L)乙醇溶液,再添加2 mL样品溶液,将混合物振荡后在室温下避光静置 30 min,517 nm下测定其吸光值。
DPPH·清除率=1-(A1-A2)/A3
式中:A1为DPPH+样品测定值;A2为95%乙醇+样品测定值;A3为DPPH+蒸馏水测定值。
1.5.2 ·OH自由基清除能力的测定参照林倩[5]的方法,具体方法如下:在试管中依次加入 3.5 mL去离子水,0.5 mL水杨酸(9.1 mmol/L)-乙醇溶液,0.5 mL样品,0.5 mL FeCl2溶液 (9.1 mmol/L),5 mL H2O2(8.8 mmol/L),振荡混匀,即可测定其在510 nm下吸光度A1。
羟自由基清除率=1-(A1-A2)/A3
式中:A1为样品测定值;A2为取0.5 mL的蒸馏水代替9 mmoL/L的FeCl2;A3为取0.5 mL去离子水替代样品溶液。
2 结果与讨论
2.1 超滤法分离纯化阿魏菇多肽的结果
利用10 000的超滤膜将阿魏菇多肽分成两个组分,然后分别测定这两个组分的抗氧化活性,结果见表1。
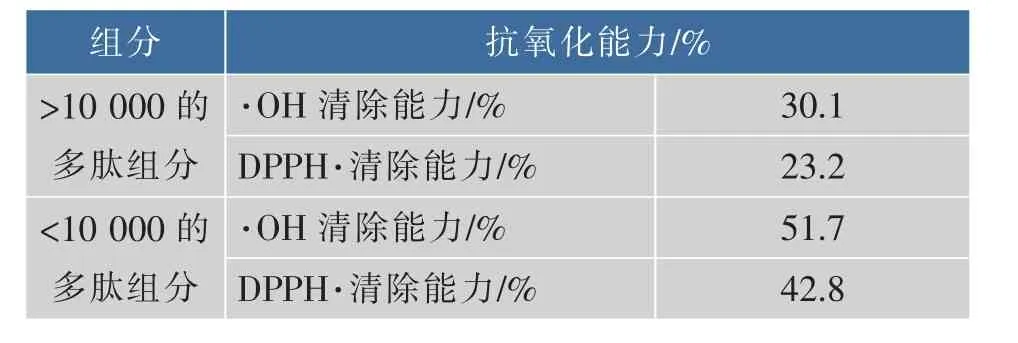
表1 超滤分离结果Table 1 Results of ultrafiltration
由表1可知,10 000的超滤膜可以将阿魏菇多肽分离成大于10 000的多肽组分和小于10 000的多肽组分,测定这两个组分的·OH清除能力和清除DPPH·能力,由测定结果可知,小于10 000的多肽组分的抗氧化活性较高,可以用于下一步的分离纯化。
2.2 DEAE-32分离阿魏菇多肽的结果
相对分子质量为1 000~10 000的阿魏菇多肽经DEAE-32分离后在220 nm处检测,得到3个洗脱峰,分别命名组分P1、P2、P3。然后分别收集这3个组分,冷冻干燥后分别配制成25 mg/mL的多肽溶液,分别测定其清除·OH的能力。由图1可知,相对分子质量为 1 000~10 000的阿魏菇多肽经DEAE-32分离后,在220 nm处检测,得到3个洗脱峰,分别命名组分P1、P2、P3。然后分别收集这3个组分,冷冻干燥后分别配制成25 mg/mL的多肽溶液,分别测定其清除·OH的能力。
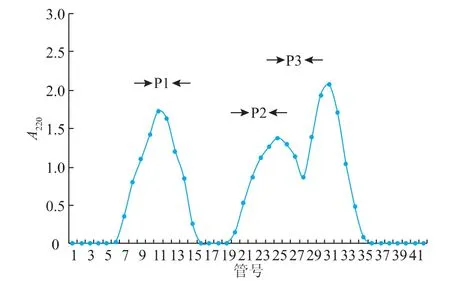
图1 DEAE-32纯化阿魏菇多肽的层析图Fig.1 Elution profile of Pleurotus ferulae lenzi peptide on DEAE-32 column
由图2可知,由DEAE-32分离得到的三个组分的·OH自由基清除能力大小关系为P3>P1>P2,P3的清除·OH的能力达到50.22%,由此选取组分P3做进一步分离纯化的研究。
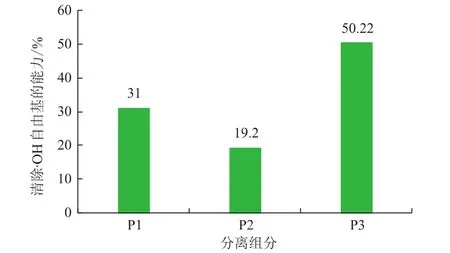
图2 各组分清除·OH自由基的能力Fig.2 ·OH radical seavenging activity of Pleurotus ferulae lenzi polypeptide
2.3 葡聚糖凝胶SephadexG-25分离纯化阿魏菇多肽水解液结果
图3为葡聚糖凝胶SephadexG-25分离DEAE-32洗脱出的组分P3的结果,经过葡聚糖凝胶SephadexG-25分离后,在220nm处检测洗脱峰,共得到5个峰,分别命名为组分P3-1、组分P3-2、组分P3-3、组分P3-4、组分P3-5。然后分别多次收集这5个组分,冷冻干燥后配制成25 mg/mL的多肽溶液,分别测定其·OH自由基的清除能力,见图4。
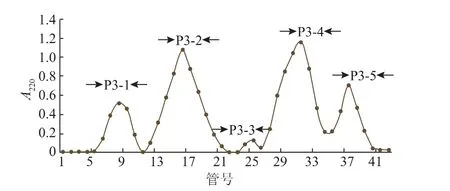
图3 SephadexG-25纯化阿魏菇多肽的层析图Fig.3 Elution profile of Pleurotus ferulae lenzi peptide on sephadexG-25 column

图4 各组分清除·OH自由基的能力Fig.4 ·OH radical seavenging activity of Pleurotus ferulae lenzi polypeptide
由葡聚糖凝胶SephadexG-25分离纯化出的各组分的·OH自由基清除能力的大小为P3-2>P3-5>P3-1>P3-3>P3-4,并且组分P3-2的·OH自由基清除能力达到77.23%,具有较高的抗氧化活性,可用于下一步的分析研究。
2.4 阿魏菇多肽相对分子质量的分布
2.4.1 标准曲线的绘制SephadexG-25分离范围为1 000~5 000,标准品相对分子质量对数与有效分配系数的关系为Y=-7.205 2X+4.440 1(X为有效分配系数,Y为相对分子质量对数),R2=0.988 4,见图5。
2.4.2 阿魏菇多肽分子量的分布将SephadexG-25分离得到的P3-2组分收集后再次由SephadexG-25进行分离鉴定,见图6。组分P3-2经葡聚糖凝胶SephadexG-25分离后为单一组分,同时计算分离物本身的体积为10.6 mL,计算得出有效分配系数Kav为0.162 5,经标准方程得相对分子质量大约为1 862。

表2 标准品各指标的测定值Table 2 Measured value of standard dextrans
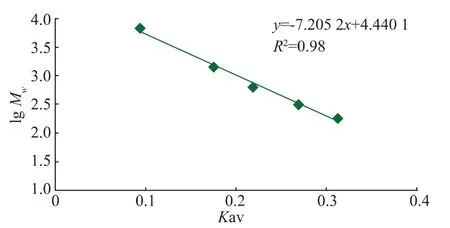
图5 相对分子质量测定标准曲线Fig.5 Calibration curve of determining molecular weight
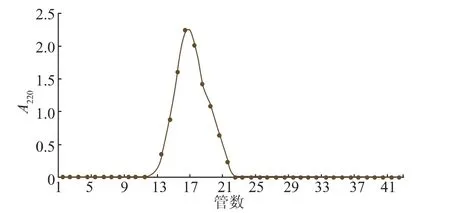
图6 组分P3-2的葡聚糖凝胶SephadexG-25的洗脱图谱Fig.6 Sephadex G-25 elution pattem of P3-2
3 结语
1)作者以胃蛋白酶-胰蛋白酶联合酶解阿魏菇多肽的水解物为原料,首先利用超滤法分离阿魏菇水解液,使用10 000的超滤膜,将阿魏菇水解液分离成大于10 000的多肽组分和小于10 000的多肽组分,并且小于10 000的多肽组分的清除·OH能力和清除DPPH能力均高于大于10 000的多肽组分。
2)将小于10 000的多肽组分经DEAE-32纤维素分离后,在220 nm处检测洗脱峰,得到3个洗脱峰,并且组分P3的羟基清除能力较高,达50.22%。
3)将DEAE-32纤维素分离得到的P3组分由葡聚糖凝胶SephadexG-25分离,在220 nm处得到5个洗脱峰,组分P3-2的清除·OH的能力最高,达到77.23%。
4)利用葡聚糖凝胶SephadexG-25测定分离纯化后的多肽分子,其结果为出现单一组分,其相对分子质量大约为1 862。
5)对分离纯化的阿魏菇多肽进行抗氧化活性研究,分别测定了阿魏菇多肽的DPPH·自由基清除能力、·OH自由基的清除能力、O2-·自由基的清除能力和还原力。结果表明,阿魏菇多肽的抗氧化活性较高,具有进一步研究的价值。
本研究对于抗氧化肽的分离纯化只局限在初级阶段,对深层次的分离纯化、结构鉴定、活性机理探究有待进一步研究。如何进一步对阿魏菇抗氧化肽对机体生物大分子的保护作用机理开展研究,将为阿魏菇的功能性利用提供更加详尽的理论依据。
[1]曾利平,翟金兰,童军茂,等.阿魏菇的营养与保鲜[J].新疆农垦科技,2005(5):24-25.
ZENG Liping,ZHAI Jinlan,TONG Junmao.Nutrition and fresh of Pleurotus ferulae lenzi[J].Xinjiang Farmland Science& Technology,2005(5):24-25.(in Chinese)
[2]牛博楠,许程剑.超声波辅助提取新疆阿魏菇蛋白质工艺优化[J].食品研究与开发,2014,35(8):29-33.
NIU Bonan,XU Chengjian.Extraction of Pleurotus ferulae lenzi of Xinjiang protein using ultrasonic-assisted alkali extraction-acid precipitation method[J].Food Research and Development,2014,35(8):29-33.(in Chinese)
[3]肖辉,张月明,刘岳强,等.阿魏蘑菇对氢化可的松处理大鼠免疫调节作用的研究[J].预防医学论坛,2006,12(2):177-181.
XIAO Hui,ZHANG Yueming,LIU Yueqiang,et al.The modulation effects and primary mechanism of Pleurotus ferulae on the immune function of hydrocortisone model[J].Preventive Medicine Tribune,2006,12(2):177-181.(in Chinese)
[4]Wang H X,Ng T B,Ooi V E C.Lectins from mushrooms-a review[J].Mycology Research,1998,102:897-906.
[5]付海田,徐静静.一种真菌复合多糖提取及体外抗氧化活性的研究[J].食品生物技术学报,2013,32(3):113-117.
FU Haitian,XU Jingjing.Extraction and antioxidative activity of a combined fungus polysaccharides[J].Journal of Food Science and Technology,2013,32(3):113-117.(in Chinese)
[6]Bin Wang,Zhong Rui Li,Chang Feng Chi,et al.Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J].Peptides,2012,36:240-250.
[7]Berot S,Popineau Y,Compoint J P,et al.Ultrafiltration to fractionate wheat polypeptides[J].Journal of Chromatography B:Biomedical Sciences and Applications,2001,753(1):29-35.
[8]Udenigwe C C,Lu Y L,Han C H,et al.Flaxseed protein-derived peptide fractions:antioxidant properties and inhibition of lipopolysaccharide-induced nitric oxide production in murine macrophages[J].Food Chemistry,2009,116(1):277-284.
[9]D Alvise N P,Lambert C L,Bazus A F.Continuous enzymatic solubilization of alfalfa proteins in an ultrafiltration reactor[J]. Enzyme and Microbial Technology,2004,34:380-391.
[10]孔天翰,郭进武.蝎毒抗癌多肽及其分离组分分析及鉴定方法[J].河南医科大学学报,2001,36(6):647-649.
KONG Tianhan,GUO Jinwu.Research on analysis of APBMV and its components[J].Journal of Henan Medical University,2001,36(6):647-649.(in Chinese)
[11]Kouhei M,Takayuki Y,Yumiko N,et al.Purification and primary structure of pituitary adenylate cyclase activating polypeptide(PACAP)from the brain of an elasmobranch,stingray,Dasyatis akajei[J].Peptides,1998,19(9):1489-1495.
[12]申衍豪.大米抗氧化活性肽的分离纯化和性质研究[D].长沙:中南林业科技大学,2011.
[13]Soo-Yong Kim,Jae-Young Je,Se-Kwon Kim.Purification and characterization of antioxidant peptide from hoki(Johnius belengerii)frame protein by gastrointestinal digestion[J].Journal of Nutritional Biochemistry,2007,18:31-38.
[14]Qiang Zhao,Hua Xiong,Cordelia Selomulya,et al.Enzymatic hydrolysis of rice dreg protein:effects of enzyme type on the functinal properties and antioxidant activities of recovered proteins[J].Food Chemistry,2012(134):1360-1367.
[15]胡建.牛蒡多糖的提取纯化及其抗氧化性研究[D].扬州:扬州大学,2011.
[16]张唐伟,杨乐,刘青海,等.地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报,2011,30(6):868-873.
ZHANG Tangwei,YANG Le,LIU Qinhai,et al.Antioxidant and antimicrobial activities of nostoc commune polysaccharides[J]. Journal of Food Science and Technology,2011,30(6):868-873.(in Chinese)
Separation,Purification and Antioxidant Activity Study of Antioxidant Peptides from Pleurotus ferulae lenzi in Xinjiang
ZHENG Xiaoji, XU Chengjian*, NIU Bonan, CHEN Shuai, WANG Xueming, ZHU Lili
(School of Food Science,Shihezi University,Shihezi 832000,China)
Antioxidant peptides of Pleurotus ferulae lenzi were separated using ultra-filtration,ion-exchange and gel filtration chromatography,and its antioxidant properties were also studied in this study.Two kinds of peptides(>10 000 polypeptide components and<10 000 polypeptide components)were isolated from the hydrolyzed solution of Pleurotus ferulae lenzi protein.The polypeptide components under 10 000 have higher·OH radical scavenging and DPPH·radical scavengingcapacitythan those above 10 000.After detachingofpolypeptide componentsunder 10 000 by DEAE-32,three elution peaks were obtained and P3 component showed higher hydroxyl scavenging capacity,reaching 50.22%.Five elution peaks at 220 nm were further isolated from P3 component by Sephadex G-25,and P3-2 component showed best capacity of·OH radical scavenging,reaching 77.23%.According to standard equation,the molecular weight of P3-2 was about 1 862.The results provide a theoretical basis for further studies of active ingredient from Pleurotus ferulae lenzi in Xinjiang province.
TQ 936.1
A
1673—1689(2015)05—0524—06
2014-02-04
国家自然科学基金项目(31101256)。
郑晓吉(1982—),男,甘肃通渭人,农学硕士,讲师,主要从事新疆特色资源综合利用方面的研究。E-mail:zhengxj1982@163.com
*通信作者:许程剑(1978—),男,新疆石河子人,工学博士,副教授,硕士研究生导师,主要从事天然产物制备与功能活性方面的研究。
E-mail:37377869@qq.com
50.22 %。P3组分采用葡聚糖凝胶SephadexG-25分离,在220 nm处得到5个洗脱峰,组分P3-2的羟自由基清除最高,达到77.23%,具有较高的抗氧化活性,其相对分子质量大约为1 862。
