免疫磁球性能影响因素
2015-01-06杜美红代凤英许迪莘孙永军
杜美红, 代凤英, 许迪莘, 张 淼, 孙永军, 左 嘉
(1.北京市理化分析测试中心,北京 100089;2.中国科学院过程工程研究所,北京 100190;3.北京市科学器材公司,北京100010)
免疫磁球性能影响因素
杜美红1, 代凤英2, 许迪莘3, 张 淼2, 孙永军1, 左 嘉1
(1.北京市理化分析测试中心,北京 100089;2.中国科学院过程工程研究所,北京 100190;3.北京市科学器材公司,北京100010)
利用化学键法制备沙门氏菌捕获富集用免疫磁球,通过平板培养计数法确定其对目标菌的捕获率,对影响免疫磁球性能的磁分离时间、目标菌捕获率、特异性及敏感性等主要因素进行了研究。结果表明,免疫磁球在不同的磁分离时间内对目标菌的捕获率不同,在一定的的磁分离时间内捕获率达到最高;磁球与抗体的投料比影响免疫磁球的捕获性能,磁球200 μg、抗体25 μg的投料制备的免疫磁球能获得40%以上的捕获效率,具有一定的灵敏性(100 cfu/mL的目标菌捕获率为50%以上);免疫磁球的粒径影响其捕获性能,大粒径(1 000 nm)免疫磁球目标菌捕获率小于小粒径(180 nm)免疫磁球目标菌捕获率;免疫磁球对单增李斯特菌、金黄色葡萄球菌、志贺氏菌非特异性在10%以下,在一定程度上影响免疫磁球的特异性捕获。
免疫磁球;捕获率;磁分离时间;特异性;敏感性
免疫磁性微球是免疫学与磁性微球技术结合的一类新型材料,它是在磁性复合微球表面引入活性基团,通过表面偶联反应或者吸附作用将抗体结合到微球上,形成免疫磁性微球。20世纪80年代,Ugelstad等人成功制成了第一批免疫磁性微球用于分离细胞并取得良好的效果[1]。此后,各国学者对免疫磁性微球的制备与应用展开了大量研究,免疫磁性微球以其磁性和免疫特异性的特点,在细胞的分离纯化、微生物富集与分离、蛋白质分离和纯化、核酸分离纯化等方面迅速得到广泛应用[2-5],从而引起了国内外诸多公司及企业对免疫磁球系列产品的开发与研制。商用和科研用免疫磁球逐步市场化,对其性能的研究与评价成为必需。免疫磁球性能受磁响应时间、目标捕获率、捕获特异性、磁球稳定性等多种因素影响。作者以抗沙门氏菌 (anti-Salmonella)免疫磁球为例,从免疫磁球的主要技术参数出发,探讨对免疫磁球性能的影响,旨在为免疫磁球的应用转化奠定基础,为免疫磁球的广泛应用提供有价值的参考及科学依据。
1 材料与方法
1.1 试剂与仪器
AllMag PM3-2磁球:粒径180 nm,上海奥润微纳 新 材 料 科 技 有 限 公 司 ;Dynabesds Myone Carboxyl:粒径1 000 nm,北京思尔成生物技术有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS):北京百灵威科技有限公司;anti-Salmonella多克隆抗体:01-95-99,KPL,美国;磁力架:0.5T,Invitrogen公司;鼠伤寒沙门氏菌(Salmonella typhimurium)(ATCC 14028)、单增李斯特菌 (ATCC 19115)、金黄色葡萄球菌(ATCC 25923)、志贺氏菌(ATCC 12022)、MH琼脂、营养琼脂:北京陆桥技术有限责任公司;超高分辨率场发射扫描电镜:德国MERLN;纯水仪:美国Mili-Q MILLIPORE。
1.2 方法
1.2.1 免疫磁球制备分别取 200 μg AllMag PM3-2磁球、Dynabeads Myone Carboxyl磁球到离心管中,用无菌磷酸缓冲液(PBS)洗涤两次,分别加入新配制的EDC和NHS溶液到离心管中,涡旋混匀,37℃活化30 min后移去多余的液体。加入25 μg anti-Salmonella多克隆抗体到离心管中,37℃偶联3 h。移去多余液体,加1%BSA于37℃、30 min封闭免疫磁球。
1.2.2 磁分离时间考察将培养好的沙门氏菌液稀释至约102cfu/mL,取1 mL菌液放入2 mL离心管中,分别加入相同一定量的anti-Salmonella免疫磁球,轻轻吹打均匀;在室温下轻轻旋转30 min;将离心管置于磁力架上,分别在5、10、15、20、30 min时小心取出离心管中全部液体 (上清液);去磁场后,加1 mL PBS冲洗离心管壁上的菌体-免疫磁球,并均匀打散(下沉液);将上清液与下沉液分别进行适当稀释,营养琼脂平板培养,37℃下经过24~48 h后计数;同时将原沙门氏菌液平板培养计数。
捕获率=下沉细菌总数/(上清细菌总数+下沉细菌总数)。
1.2.3 捕获率考察AllMag PM3-2磁球、Dynabeads Myone Carboxyl各 50、100、200、400 μg分别与25 μg anti-Salmonella多克隆抗体反应制备免疫磁球,与稀释好的不同浓度沙门氏菌104、103、102、101cfu/mL在室温下温育、捕获及磁分离,方法同1.2.2,通过平板培养计数法计算不同浓度免疫磁球对不同浓度沙门氏菌的捕获率。取捕获后适量免疫磁球/细菌复合物SEM表征。
1.2.4 特异性考察分别稀释培养好的大肠埃希菌、志贺氏菌、金黄色葡萄球菌菌液约102cfu/mL,形成原始菌液,取原始菌液各1 mL放入2 mL离心管中,加入200 μg anti-Salmonella免疫磁球,轻轻吹打均匀;在室温下轻轻旋转30 min后;将离心管置于磁力架上,至离心管溶液清澈透明;小心取出离心管中全部清液 (上清液);去磁场后,加1 mL PBS缓冲液反复冲洗离心管壁上的菌体-免疫磁球复合物,并均匀打散(下沉液);将上清液与下沉液分别涂布于营养琼脂平板,在各自的培养条件下,经过24~48 h培养;同时将原始菌液分别涂布于营养琼脂平板上,在相同的条件下培养,进行菌落计数并计算捕获率(捕获率计算方法同1.2.2)。
1.2.5 敏感性考察将培养好的沙门氏菌液稀释至约100、108cfu/mL形成原始菌液,取原始菌液各1 mL,放入2 mL离心管中,分别加入200 μg anti-Salmonella免疫磁球,温育、捕获,磁分离。方法同1.2.2,通过平板培养计数法计算免疫磁球对100、108cfu/mL沙门氏菌的捕获率。
2 结果与分析
2.1 免疫磁球磁分离时间
在外加磁场的情况下(0.5 T),粒径为180 nm anti-Salmonella免疫磁球磁分离时间在20min时对目标菌的捕获率达到最高(40.13%),随时间的增加逐渐趋于平衡,见图1。粒径为1 000 nm的免疫磁球在15 min时对目标菌的捕获率达到最高(57.68%),后随着磁分离时间的增加,捕获率呈下降趋势,见图2。

图1 免疫磁球在外加磁场作用下富集情况Fig.1 Immunomagnetic beads enriched under an applied magnetic field
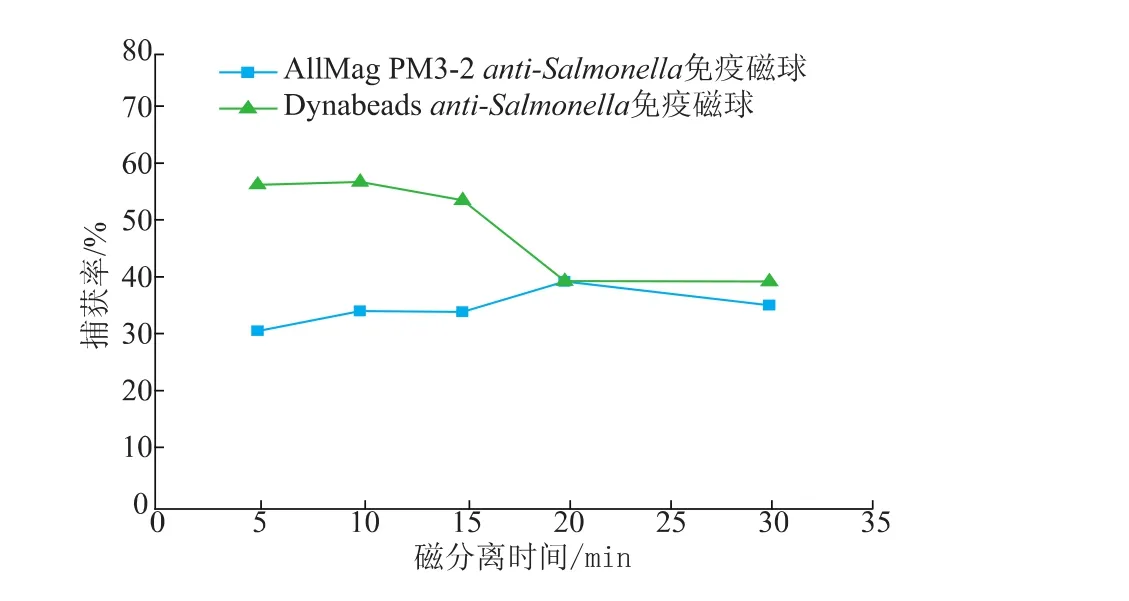
图2 anti-Salmonella免疫磁球在不同磁分离时间目标菌捕获率Fig.2 Capture rate of anti-Salmonella immunomagnetic beads on target bacteria in different magnetic separation time
2.2 免疫磁球目标物捕获率
通过平板培养计数法评价免疫磁球目标菌捕获性能见图3。50、100、200、400 μg anti-Salmonella免疫磁球对目标菌101~104cfu/mL的捕获率逐渐增加;显然,随着免疫磁球数量的增加,其对目标物的捕获率增大,200 μg免疫磁球的捕获率在50%以上,增加免疫磁球用量至400 μg以后,其捕获率与用量200 μg捕获率基本相当。anti-Salmonella免疫磁球(200 μg)及抗体(25 μg)为最佳投料比,用于后续的试验。两种免疫磁球捕获率有所差别,沙门氏菌菌落数一定时,粒径为180 nm免疫磁球比粒径为1 000 nm免疫磁球捕获率高。通过SEM手段评价了磁球与沙门氏菌复合体的结合情况,免疫磁球与沙门氏菌相互作用,磁球稳定结合于目标菌表面,见图4。
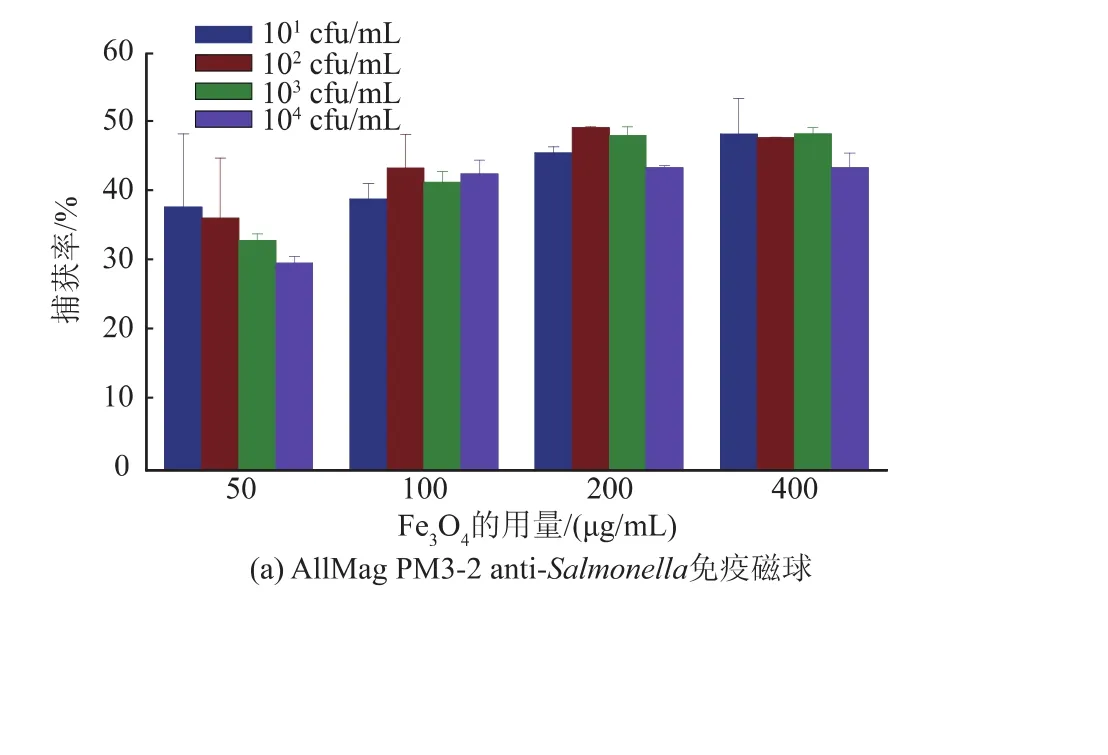
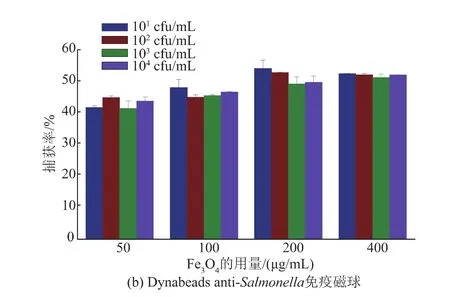
图3 不同质量免疫磁球对不同数量目标菌捕获率Fig.3 Capture rate of different quality immunomagnetic beads on different number of target bacteria
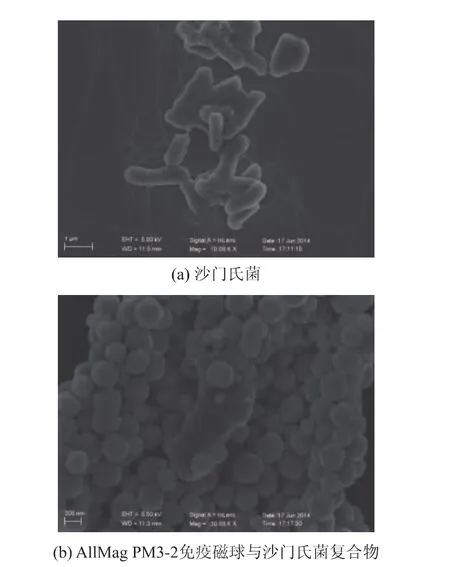
图4 免疫磁球与目标菌复合物SEM照片Fig.4 SEM of immunomagnetic beads and the target bacteria complexes
2.3 免疫磁球特异性
免疫磁球的特异性评价通过其对非目标菌的非特异性吸附来间接体现。anti-Salmonella免疫磁球对单增李斯特菌、志贺氏菌、金黄色葡萄球菌捕获都在10%以下,免疫磁球对除沙门氏菌之外的其它菌都有交叉反应,存在一定的非特异捕获现象,见表1。
2.4 免疫磁球敏感性
如图5所示,两种免疫磁球对于目标菌浓度为100cfu/mL时的捕获率高于对 108cfu/mL的捕获率;AllMag PM3-2 anti-Salmonella免疫磁球对100、108cfu/mL目标菌的捕获率分别为 73%、43%;Dynabeads anti-Salmonella免疫磁球对100、108cfu/ mL目标菌的捕获率分别为51%、24%。表明目标菌浓度越小,捕获效率越高,敏感性越好。
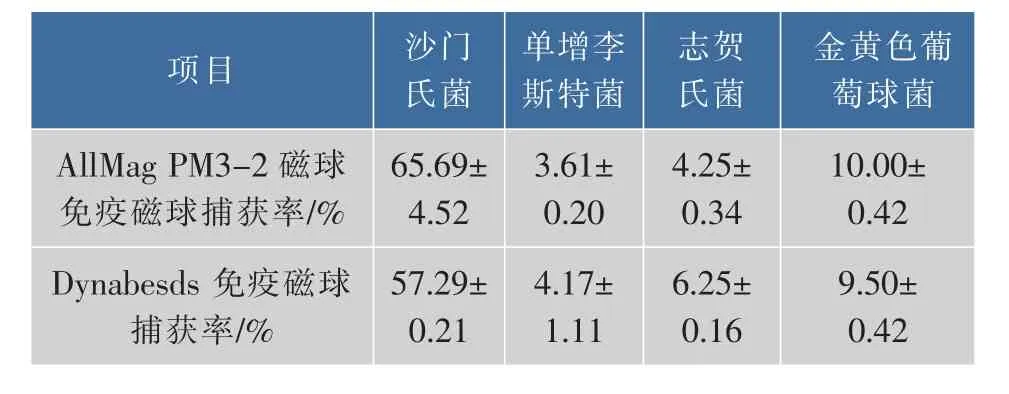
表1 anti-Salmonella免疫磁球对不同菌株(102cfu/mL)捕获率Table 1 Rate of anti-Salmonella immunomagnetic beads capturing on different strains(102cfu/mL)
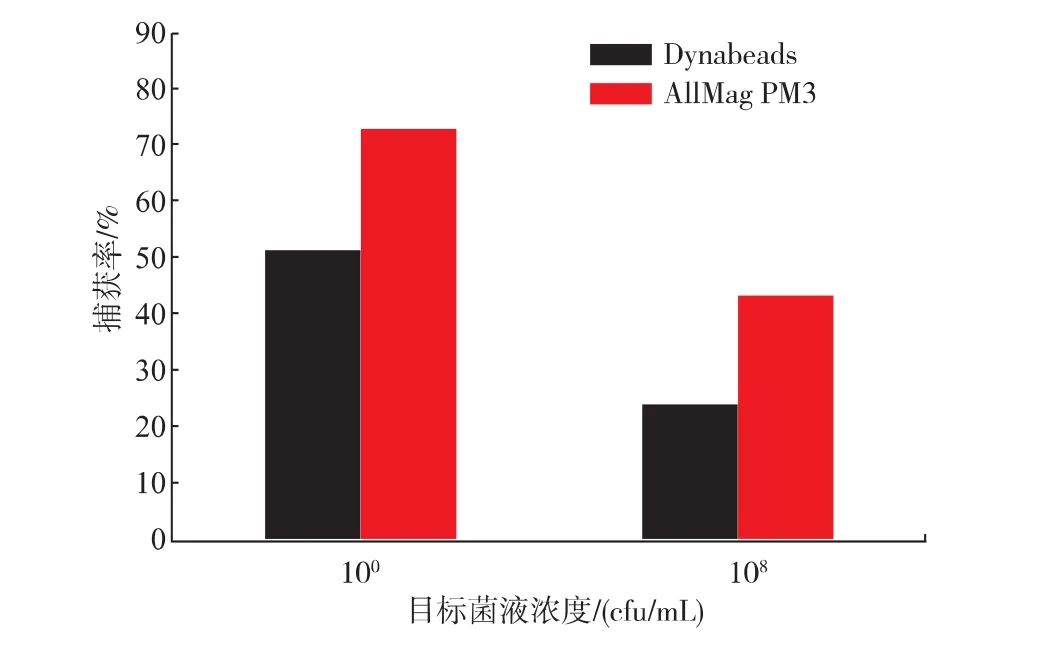
图5 免疫磁球对100、108cfu/mL目标菌的捕获率Fig.5 Capture rate of anti-Salmonella immunomagnetic beads on the concentration of 100cfu/mL and 108cfu/mL
2.4 讨论
免疫磁球性能受多方面因素影响,磁球本身粒径、磁球表面抗体固定量、抗体活性、磁响应时间等为主要因素。
磁响应时间是免疫磁球最基本的性能,它反映了免疫磁球在尽可能短的时间内分离出目标物的能力,作者通过在不同磁分离时间下目标菌的捕获率对其进行表征。由于磁球本身磁含量及粒径的不同,两种免疫磁球在相同的磁分离时间内表现出不同的捕获率,Dynabeads anti-Salmonella免疫磁球在捕获率达到最大后又开始下降,推测主要是由于粒径与质量大,在与目标菌长时间的接触过程中,由于重力或磁力作用对目标菌造成损伤,所以,应在恰当的时间及时停止磁分离操作,保证目标物的捕获效率。在实际研究或检测工作中,能将目标物捕获并快速地分离呈递给后续方法以定性或定量检测,节约样品的前处理时间,对科研工作及检测工作具有非常重要的意义。尤其是对于食品样品中的微生物检测工作来说,免疫磁球将目标菌尽可能有效地捕获后快速分离,能节约检测时间18~24 h[6],大大提高了工作效率。
本研究对各种影响因素的表征都采用了目标菌捕获率技术参数,因为每个影响因素对目标物的作用最终都会反映到捕获率上。捕获率的计算方法因不同的捕获目标物而异,对于微生物富集用免疫磁球采用微生物平板培养计数法能准确计算捕获率,而且能真实反应捕获活菌的数量;细胞富集用免疫磁球可采用流式细胞仪来确定捕获率。作者特别选取两种粒径不同的免疫磁球来考察其捕获效果。结果显示,当磁球表面抗体一定的情况下,小粒径(180 nm)的免疫磁球对大分子目标菌的捕获率要高于大粒径(1 000 nm)的免疫磁球,主要因为小粒径的免疫磁球比表面积大,表面连接的抗体数量多而导致高的捕获效率;另一方面,大粒径免疫磁球由于受重力的作用很容易沉淀,在反应过程中不能与目标菌充分接触,即使接触到目标物,也会由于其重力作用使目标物受到损伤,从而影响其对目标菌的捕获性能。有研究证实,较小的粒径及良好的胶体稳定性能大大提高免疫磁球与目标菌的免疫反应,从而表现出较高的捕获率[7]。对于大分子微生物来说,纳米级免疫磁球表现出更高的捕获性能[8]。
许多文献中报道所制备的免疫磁球目标物捕获率达到80%以上[9-14],本研究中制备的免疫磁球对目标菌的捕获率最高为76%,主要因为磁球表面偶联的抗体量不同,目标物捕获率表现出高低不同。本研究抗体投料仅为25 μg制备的免疫磁球,获得了较高的捕获率,对以后的产品应用转化、降低产品成本具有非常重要的现实意义。
3 结语
作者通过化学键法制备沙门氏菌捕获富集用免疫磁球,通过平板培养计数法确定其对目标菌捕获率,重点对影响免疫磁球性能的磁分离时间、目标菌捕获率、特异性及敏感性等主要技术参数作了考察。不同的磁分离时间影响免疫磁球捕获率,在最佳的时间内,捕获率达到最高;磁球表面抗体的特异性、与菌体的免疫反应性也是影响免疫磁球性能的重要因素。本研究为免疫磁球性能评价及实际应用检测提供了科学依据,同时为国产免疫磁球的应用转化奠定了基础。
[1]Ugelstad A.Process for preparing an aqueous emulsion or dispersion of a party water-soluble material and use of polymer particles prerared according to this process as a toner in xerography[P].European Patent:0003905,1979-09-05.
[2]Maciej Z,Chalmers J J,Rare C.Rare cell separation and analysis by magnetic sorting[J].Anal Chem,2011,83(1):8050-8056.
[3]Chinchun O,Christopher M E,Robert J W.Effect of magnetic field gradient on effectiveness of the magnetic sifter for cell purification[J].IEEE Trans Magn,2013,49(1):316-320.
[4]Yoshiaki O,Tomoko Y T,Nozomi K,et al.New protein purification system using gold-magnetic beads and a novel peptide tag“the Methionine Tag”[J].Bioconjugate Chem,2011,22(5):887-893.
[5]Shao M F,Ning F Y,Zhao J W,et al.Preparation of Fe3O4、SiO2、layered double hydroxide core-shell microspheres for magnetic separation of proteins[J].J Am Chem Soc,2012,134(2):1071-1077.
[6]Zhouli Wang,Tianli Yue,Yahong Yuan,et al.Preparation of immunomagnetic nanoparticles for the separation and enrichment of Alicyclobacillus spp.in apple juice[J].Food Research International,2013,54(1):302-310.
[7]牛牧,杜美红,邓奕,等.亚微米级免疫磁球及其在细菌分离中的应用[J].高等学校化学学报,2011,32(2):322-326.
NIU Mu,DU Meihong,DENG Yi,et al.Preparation and application in capturing bacteria of submicron immunomagnetic beads [J].Chemical Journal of Chinese Universities,2011,32(2):322-326.(in Chinese)
[8]梁光明,刘阳,孙力军,等.利用人免疫球蛋白构建免疫磁珠富集金葡菌条件优化[J].食品与生物技术学报,2013,32(3):265-271.
LIANG Guangming,LIU Yang,SUN LiJun,et al.Condition optimization of building immunomagnetic bead using humanimmunoglobulin G for enrichment Staphylococcus aureus[J].Journal of Food Science and Biotechnology,2013,32(3):265-271.(in Chinese)
[9]闻一鸣,李志清,童吉宇,等.免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌[J].生物工程学报,2013,29(5):672-680.
WEN Yiming,LI Zhiqing,TONG Jiyu,et al.Rapid detection of Listeria monocytogenes by immunomagnetic separation combined with selective medium[J].Chinese Journal of Biotechnology,2013,29(5):672-680.(in Chinese)
[10]Burcu Guven,Nese Basaran-Akgul,Erhan Temur,et al.SERS-based sandwich immunoassay using antibody coated magnetic nanoparticles for Escherichia coli enumeration[J].Analyst,2011,136(4):740-748.
[11]Somayyeh Poshtiban,Muhammad Afzal Javed,Denis Arutyunov,et al.Phage receptor binding protein-based magnetic enrichment method as an aid for real time PCR detection of foodborne bacteria[J].Analyst,2013,138(19):5619-5626.
[12]Longyan Chen,Fereidoon S Razavi,Abdul Mumin,et al.Muitifunctional nanoparticles for rapid bacterial capture,detection,and decontamination[J].RSC Adv,2013,3(7):2390-2397.
[13]Zhao W,Zhang W P,Zhang Z L,et al.Robust and highly sensitive fluorescence approach for point-of-care virus detection based on immunomagnetic separation[J].Anal Chem,2012,84(5):2358-2365.
[14]Kai Ma,Yi Deng,Yu Bai,et al.Rapid and simultaneous detection of Salmonella,Shigella,and Staphylococcus aureus in fresh pork using a multiplex real-time PCR assay based on immunomagnetic separation[J].Food Control,2014,42:87-93.
Factors Effected on Performance of Immunomagnetic Beads for Bacteria Enrichment
DU Meihong1, DAI Fengying2, XU Dixin3, ZHANG Miao2, SNN Yongjun1, ZUO Jia1
(1.Beijing CenterforPhysicaland ChemicalAnalysis,Beijing 100089,China;2.Institute ofProcess Engineering,Chinese Academy of Sciences,Beijing 100190, China;3.Beijing Scientific Instruments and Materials Cooperation,Beijing 100010,China)
In this study,we aims to study the main factors such as magnetic separation time,target capture rate,specificity,sensitivity that affect the performance of immunomagnetic beads(IMB). IMB were prepared chemically and the capture rate of target bacteria were determined by plate culture counting.The target bacteria capture rate varies in different magnetic separation time,which affected the capture rate,and the capture rate of IMB would reach the highest level.The amount of magnetic balls and antibody affect the capture performance of IMB.When the Feed ratio was 200 μg of magnetic ball and 25 μg of antibody,the capture rate would get more than 50%And IMB hasa sensitivity (the capture rate is above 50%on target bacteria with 100 cfu/mL).The target capture rate of IMB with the large diameter(1 000 nm)is less than that of those with the small diameter(180 nm)at the same mass.The nonspecific capture rate for Escherichia coli,Staphylococcus aureusand Shigella was below 10%,which affected the immune specificity of IMB.This study provided a foundation and some data for application of IMB and detection of microorganisms.
immunomagnetic beads(IMB),capture rate,magnetic separation time,specificity,sensitivity
Q 939.91
A
1673—1689(2015)05—0501—06
2014-02-28
国家“十二五”科技支撑计划项目(2012BAF14B02);国家重大科学仪器设备开发专项项目(2013YQ140371);北京市科学技术研究院创新团队项目(IG201307N/C2)。
杜美红(1974—),女,山西太谷人,理学博士,副研究员,主要从事食品安全及微生物快速检测方面的研究。
E-mail:dumeihong@tom.com
