一种氨基甲酸乙酯与尿素降解酶产生菌的鉴定及酶学特性
2015-01-06杨广明查小红田亚平
杨广明, 查小红, 田亚平
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
一种氨基甲酸乙酯与尿素降解酶产生菌的鉴定及酶学特性
杨广明, 查小红, 田亚平*
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
从小鼠消化系统中筛选到一株能产生氨基甲酸乙酯 (EC,Urethane)降解酶的菌株,16S rDNA序列分析和生理生化鉴定确定为Providencia sp.。酶底物特异性研究表明,该酶对尿素和氨基甲酸乙酯都有相对强的降解作用,而对一些酯类和氨基酸没有降解作用,该酶对两种底物的最适作用pH值均为4.5左右,最适温度均为35℃。单因素实验优化了培养基配方,在最佳培养条件下,酸性EC降解酶酶活从0.32 U/mL提高到0.63 U/mL,酸性脲酶酶活从0.87 U/mL提高到1.95 U/mL。初步应用研究表明,该酶在黄酒的复杂体系中仍然能有效的降解尿素和EC,且对黄酒中的风味物质几乎无影响。
菌株鉴定;酸性EC降解酶;酸性脲酶;产酶条件;酶学特性
氨基甲酸乙酯(Ethyl Carbamate,简称EC),又称尿烷(Urethane)早在1943年,Nettleship[1]等进行的动物实验就证明EC具有潜在的致癌性。基因毒性和致癌性测试显示EC是主要食源性致癌物质[2-3]。
EC广泛存在于发酵食品(如酱油、腐乳)和饮料酒中(如黄酒、清酒)及蒸馏酒中(如白兰地、威士忌等)中[4-5]。自从1985年12月加拿大的卫生与福利组织(Canadian Department of Health and Welfare)首先规定各类酒中的EC含量,日本酒行业也表示加强食品安全的检测,并把清酒和我国生产的黄酒加入限制的行列,要求我国黄酒的EC质量浓度必须低于100 μg/L,因此这就极大地限制了我国的绍兴黄酒出口日本和东南亚国家[6-7]。
对EC形成机制的研究表明,酒精饮料中90%以上的EC是来源于酒中的尿素和乙醇的化学反应[8-9],因此对于黄酒中EC的控制可分为两个方面,一种是直接降解黄酒中已经形成的EC,另一种是通过向后酵酒中添加酸性脲酶,将EC的前体物质尿素分解为CO2、H2O和NH3,从而减少EC的进一步形成。目前研究者主要致力于第二个方面的研究,即通过筛选产酸性脲酶的微生物来控制黄酒中的EC,国内吴伟祥,刘颖等[10]从污泥中筛选到产酸性脲酶的菌株,并研究了产酶条件;田亚平,王松华等[11-12]筛选到一株能产酸性脲酶的肠杆菌,并将该酸性脲酶应用于实际黄酒环境中,能够降解70%以上的尿素;江南大学的刘俊等[13]结合脲酶对尿素的降解和功能性材料对EC的吸附作用,首次建立了从底物到产物对黄酒中EC含量的集成控制策略;田亚平,谷晓蕾[14]筛选到了一株产氨基甲酸乙酯降解酶的变幻青霉并对酶的性质做了初步研究。目前国内外利用相关降解酶直接去除EC的研究报道尚比较少。
作者以筛选EC降解酶为目的,在小鼠的消化道中利用传统的微生物筛选方法,获得一株同时能产酸性脲酶和EC降解酶的菌株,16S rDNA法鉴定后优化其产酶条件,考察其所产酶的基本特性及在黄酒中的初步应用效果,为酶法降低酒类发酵食品中EC的研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种来源小鼠消化系统。
1.1.2 培养基富集培养基(组分g/L):葡萄糖2,EC 2,磷酸二氢钾2,乙酸钠2,氯化钠5;调节pH 5.0。115℃灭菌20 min。
种子培养基(组分g/L):葡萄糖20,蛋白胨10,牛肉膏10,酵母膏5,氯化钠5,磷酸氢二钾2,乙酸钠2,EC 2;调节pH 7.0。115℃灭菌15 min。
发酵培养基(组分g/L):葡萄糖20,蛋白胨10,牛肉膏 5,酵母膏 5,KH2PO42,NaCl 5,NaAc 2,尿素2,四水硫酸锰0.05,六水硫酸镍0.05;pH 5.5(用30%HCl调pH)。115℃灭菌20 min。
LB培养基(组分g/L):胰蛋白胨 10,NaCl 10,酵母膏5;pH 7.0,121℃灭菌20 min。
1.1.3 主要试剂细菌基因组DNA抽提试剂盒:上海生工生物工程公司;DNA标准相对分子质量、DNA胶回收试剂盒、琼脂糖、PrimeSTAR max DNA聚合酶:大连TaKaRa公司;分子级的酵母粉、蛋白胨:英国Oxoid公司;其他试剂:国产分析纯。
1.2 主要仪器与设备
722光栅分光光度计:上海第三分析仪器厂产品;超声波细胞粉碎机:宁波新芝生物技术股份有限公司产品;电热恒温水浴锅:上海医疗器械五厂产品;5804R台式高速冷冻离心机、5424高速离心机:德国Eppendorf公司产品;BioRad1000系列高性能PCR仪、核酸电泳仪、蛋白质电泳系统、GelDoc凝胶成像系统:美国Bio-Rad公司产品。
1.3 实验方法
1.3.1 EC降解酶产生菌的筛选初筛:在超净台中取2 g小鼠胃容物,加入到以EC为惟一氮源的富集培养基中,置于摇床上,37℃、200 r/min振荡培养24 h,用无菌水稀释将富集培养后的悬液稀释至不同的梯度:10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8,然后涂布在平板培养基上,37℃恒温培养箱中培养36 h,之后划线纯化接种至斜面保藏。复筛:将上一步分离得到的菌株接入发酵培养基中,37℃振荡培养24 h,之后将发酵液于4℃、8 000 r/min离心10 min,弃上清液,用0.05 mol/L的柠檬酸-柠檬酸三钠(pH 4.5)的缓冲溶液重悬后洗涤菌体,离心弃上清液,重复两次,之后测定EC降解酶的酶活。
1.3.2 全细胞的制备将菌种从斜面培养基上接种至种子培养基中,37℃、200 r/min振荡培养10 h,再按2%的接种体积分数接入发酵培养基中(50 mL/250 mL)中,于37℃、200 r/min振荡培养24 h。之后发酵液经6 000 r/min离心10 min,收集菌体,经柠檬酸缓冲液洗涤,离心收集菌体,再重复洗涤一次,离心获得全细胞。
1.3.3 粗酶液的制备将上步获得的细胞用柠檬酸缓冲液进行稀释,体积调整至离心之前发酵液体积的1/5,冰浴中超声破碎,破碎液在4℃、9 000 r/min离心10 min,收集上清液,即为粗酶液。
1.3.4 酶活测定采用Berthelot reaction比色法测定酶活[15]。酶活定义:在常压、37℃、pH 4.5的条件下,每分钟分解尿素或者EC产生1 μmol氨的酶量为1个酶活单位。
1.3.5 黄酒中尿素和EC去除率的测定黄酒中尿素含量的测定:采用二乙酰一肟法[16]。氨基甲酸乙酯去除率的测定:吸取酒样8 mL置于20 mL的顶空瓶中,逐渐加入NaCl至饱和,旋紧瓶盖,插入萃取头,在70℃下,250 r/min恒温搅拌萃取45 min。样品萃取及进样由德国Gerstel多功能进样系统自动完成。上述顶空固相微萃取技术富集黄酒中的EC,再用气相色谱-质谱联用进行定性定量分析[17]。
1.3.6 EC降解酶产生菌的鉴定观察菌株的生长状态,包括菌落特征、菌体形态、革兰氏染色和生理生化鉴定,参照《常见细菌系统鉴定手册》[18]。
细菌基因组的提取:将筛选的菌株接入20 mL的LB培养基中,37℃、200 r/min振荡培养过夜,按照上海生工SK8226柱式基因组DNA快速抽提试剂盒说明书进行提取该菌株的总DNA。
16S rDNA序列扩增与回收:PCR反应体系为(50 μL):1 μL primer 27F(10 μmol/L)(5’-AGAGT TTGATCCTGGCTCAG-3’),1 μL primer 1492R(10 μmol/L)(5’-GGTTACCTTGTTACGACTT-3’),5 μL 10×Prime STAR Buffer,4 μL dNTP,0.5 μL Prime STAR MAX DNA聚合酶,1 μL模板DNA,32.5 μL ddH2O。反应程序为:98℃5 min;98℃10 s,55℃15 s,72℃1 min 30 s;30个循环;72℃5 min。PCR扩增条带用0.8 g/dL的琼脂糖凝胶进行电泳分离,切割目的条带,用DNA凝胶回收试剂盒纯化。
16S rDNA序列分析:将纯化的PCR产物回收送上海生工生物工程公司测序,测序结果通过Blastn在NCBI数据库中进行检索,通过Clustal X和MEGA软件构建系统发育树。
1.4 EC降解酶酶学性质
最适pH值:用柠檬酸和柠檬酸三钠配制0.05 mol/L pH 3.0~7.0的柠檬酸缓冲液;用磷酸氢二钠和磷酸二氢钠配制0.05 mol/L的pH 6.0~8.0的PBS缓冲液;用Tris-HCl配制0.05 mol/L的pH 7.5~9.0的缓冲液;最适温度的测定方法同上,在不同的温度下测定酶活。
1.5 发酵条件的研究
1.5.1 碳源(葡萄糖)质量浓度对产酶的影响分别以1、2、3、4、5 g/dL的量加入葡萄糖,其他成分不变,按照1.3.2的方法进行培养,测定粗酶液的酶活。
1.5.2 氮源质量浓度对菌株产酶的影响以葡萄糖为碳源,分别以0.5、1、1.5、2、2.5、3.0 g/dL的量加入蛋白胨,其他成分和含量不变,按1.3.2的方法进行发酵培养,测定发酵粗酶液的酶活。
1.5.3 尿素质量浓度对产酶的影响尝试通过添加EC诱导EC降解酶基因的表达,当加入EC时对菌体的生长产生明显的抑制作用。根据文献报道,脲酶基因的启动子受到尿素的诱导,在尿素存在的情况下能够提高菌体的产酶能力,而尿素作为EC的结构类似物,有可能对于EC降解酶基因的表达也具有诱导作用,对于菌体产EC降解酶的能力是否有促进作用值得研究。在前面优化后的最佳的培养基的条件下,通过向培养基中添加0.2、0.4、0.6、0.8、1.0、1.2 g/dL的尿素,之后按照1.3.2的方法进行培养,测定发酵粗酶液的酶活。
1.5.4 起始pH值对发酵产酶的影响在优化的发酵培养基基础上,用0.1 mol/L NaOH或0.1 mol/L HCl将其调成不同的起始pH值,范围为3.5~7.0,按1.3.2方法进行发酵培养,之后测定粗酶液的酶活。
2 结果与分析
2.1 EC降解酶产生菌的筛选
按照1.3.1所述的方法,筛选到一株EC降解酶酶活较高的菌株,初始EC降解酶酶活约为0.32 U/mL初始脲酶酶活为0.87 U/mL。通过形态观察发现菌落形态呈圆形,乳白色半透明,边缘整齐,革兰氏染色实验证明该菌为革兰氏阴性菌,见图1。
16S rDNA遗传学鉴定:以菌株的总DNA为模板,采用16S rDNA通用引物27F 1492R进行PCR扩增,琼脂糖凝胶电泳检验到一条1 400 bp左右大小的条带,具有典型的16S rDNA特征,切胶回收纯化后送上海生工生物工程公司测序,得到菌株的16S rDNA序列,将序列在NCBI上进行同源性比较。采用 Clustal X和MEGA软件对菌株的16S rDNA进行系统发育分析,结果见图2。菌株经16S rDNA分子序列分析鉴定为 Providencia sp.,与Providencia vermicola和Providencia rettgeri的亲源性最近。

图1 菌落形态特征Fig.1 Colony morphology

图2 基于16S rDNA序列的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA sequence
2.2 酶的底物特异性
分别以不同的EC结构类似物作为底物,用Providencia sp.所产粗酶液测定酶活,发现该菌所产粗酶能有效的去除EC和尿素。而对于其它的氨基酸等结构类似物没有降解作用,该酶具有相对较强的底物专一性。因此该酶能够有效的去除尿素和EC等有害物质,见图3。
2.3 菌株所产脲酶和EC降解酶酶学性质的研究
图4表明,EC降解酶的最适作用pH值为5.0,但是在pH范围4.5~6.0 EC降解酶都具有较高的活性,图5表明脲酶的最适作用pH值为4.5,在酸性范围内对EC和尿素都有比较强的分解作用。黄酒的pH值一般在4.2左右,因此该菌所产的酶有在黄酒体系中作用的潜力。

图3 Providencia sp.所产酶的底物特异性Fig.3 Substrat specificity of the enzyme produced by Providencia sp.

图4 EC降解酶作用的最适pH值Fig.4 Optimal pH of the urethanase
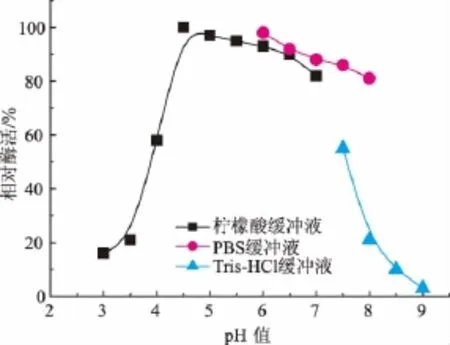
图5 脲酶作用的最适pH值Fig.5 Optimal pH of the urease
由图6可以看出,脲酶和EC降解酶的最适作用温度都是35℃左右,并且在30~55℃都有比较高的酶活。
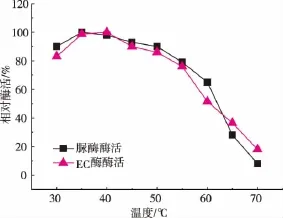
图6 脲酶和EC降解酶作用的最适温度Fig.6 Optimal temperature of the urease and urethanase
2.4 发酵条件的优化
2.4.1 葡萄糖及蛋白胨质量浓度对产酶的影响图7和图8结果表明,当葡萄糖质量浓度为3 g/dL时,菌体产生的酶活最高,EC降解酶的酶活达到了0.50 U/mL,脲酶的酶活达到了1.41 U/mL。图7结果表明,当蛋白胨的质量浓度为1.0 g/dL时,酶活最高。

图7 葡萄糖质量浓度对发酵产酶的影响Fig.7 Effect of the glucose concentration on enzyme production
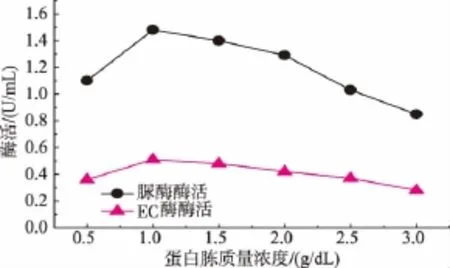
图8 蛋白胨质量浓度对发酵产酶的影响Fig.8 Effectofpeptone concentration on enzyme production
2.4.2 尿素对产酶的影响尿素作为EC的结构类似物,对EC降解酶的产生可能具有促进作用,据文献报道,脲酶基因的转录受到其它诱导剂和阻遏剂的调节,例如 Proteus mirabilis的脲酶基因受到UreR蛋白的诱导和H-NS的阻遏,当尿素存在的情况下能够阻止H-NS的阻遏作用,从而增加脲酶基因的转录表达量,提高菌体产酶[19]。图9结果表明,随着尿素添加量的增加,Providencia sp.发酵产酶活力先呈上升趋势。当尿素质量浓度为8 g/L左右时,该菌株产酶活力最高,EC降解酶的活力为0.59 U/mL,脲酶酶活为1.66 U/mL。

图9 尿素质量浓度对发酵产酶的影响Fig.9 Effect of the urea concentration on enzyme production
2.4.3 初始pH值对产酶的影响EC降解酶催化底物EC分解为CO2和NH3,这种催化作用产生的产物与脲酶相同,脲酶对尿素作用能够将尿素分解为CO2和NH3,起到酸缓冲作用[20],产生的净效果是使体系的pH回升[21],当微生物处于酸性的环境中时,这种酸缓冲作用能够保护菌体免受酸性环境的毒害作用,在酸胁迫条件下脲酶给菌体提供抗酸保护[22],有报道表明,酸性培养基环境能够诱导菌体产生更多的脲酶来抵御环境的酸性毒害[23]。图10结果表明,当培养基的初始pH为4.5时,菌株产酶活力最高,EC降解酶的酶活达到和0.63 U/mL,脲酶酶活为1.95 U/mL。
2.5 酶在黄酒中的作用效果初探
配制尿素质量浓度为25 mg/L的黄酒溶液,将制得的粗酶液按照0.1 U/mL的量,向黄酒中添加粗酶,将待处理的混合黄酒液体置于37℃的环境下进行反应,分别经过1、2、3、4 d测定尿素去除率,由图11可以看出:粗酶作用于黄酒时,随着处理时间的延长,酶的作用的效果没有明显的增加,第一天的去除率为50%左右,第二天达到67%左右,之后尿素质量浓度趋于稳定。
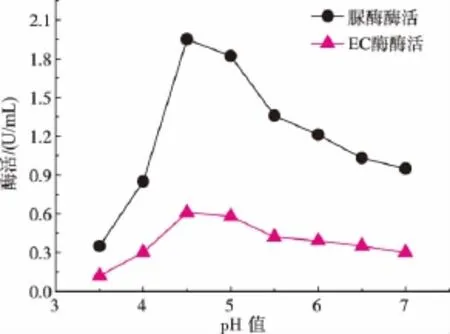
图10 初始pH值对产酶的影响Fig.10 Effect of the initial pH on the enzyme production

图11 尿素去除率结果Fig.11 Effect of the removal percentage of urea
表1的结果表明,该菌所产的酶在黄酒体系中对EC具有明显的降解作用,EC去除率随着加酶量的增加有一定的上升,当加酶量为0.2 U/mL的时候,EC去除率达到25%。

表1 EC降解酶在黄酒中的EC去除率的作用效果Table 1 Effect of the urethanase on the removal of the EC in Chinese rice wine
初步应用结果表明,该菌所产的酶在黄酒体系中仍然对两种底物都有明显效果,且在一定加量情况下其中的脲酶降解酒中尿素的作用更加有效,属于相对耐乙醇的酸性脲酶,而EC降解酶的作用在黄酒中较弱,可能是由于酶在黄酒复杂体系中活性降低所致,可在进一步纯化考察其特性的基础上通过化学修饰或固定化修饰或分子定向进化的手段提高其耐乙醇和黄酒中各种复杂成分的能力,以期达更好的应用效果。
2.6 酶处理对黄酒中风味物质的影响
图12为原黄酒的对照实验,图13为经过粗酶液处理的黄酒风味物质检测结果(加酶量为0.2 U/mL)。通过GC-MS的检测结果发现,风味物质的种类没有变化,测定前后都为50种,各种风味物质的含量仅有微小的变化,可以认为酶法处理对黄酒中的风味物质影响极小。图12 原黄酒中风味物质GC-MS谱图Fig.12 Content of flavor component in original Chinese rice wine
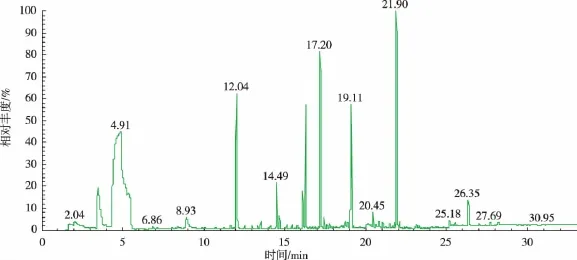
图13 酶处理后黄酒中风味物质GC-MS谱图Fig.13 Content of flavor component in Chinese rice wine processed by Urethanase
3 结语
作者筛选出一株能同时产脲酶和EC降解酶的菌株,通过16S rDNA结合生理生化鉴定确定为Providencia sp.。
对该菌株所产的酶的酶学性质进行了初步的研究,并在实际黄酒体系中尿素和EC的去除能力进行了考察,发现该酶在复杂的黄酒体系中仍然能有效的去除尿素和EC,且对酒中风味物质几乎无影响,具有实现从源头到终端综合控制黄酒中EC质量浓度的应用潜力。
发酵条件优化及酶的特性研究发现,两种酶有一样的变化趋势,初步纯化后两个酶的活性峰仍然一致,初步推测这是一种双功能酶,与文献报道的一般的中性脲酶具备的绝对专一性特征明显不同,该初步结论将有待进一步的分离纯化验证。
该菌所产脲酶基因全序列已经获得,该基因在NCBI中未见报道,进一步通过基因工程手段将该脲酶基因在安全宿主菌中进行异源表达具有重要意义。
[1]Anderson N,Henshaw Paul S,Induction of pulmonary tumors in mice with ethyl carbamate[J].Journal of The National Cancer Institute,1943,4(3):309-319.
[2]Le Kim Y K,Koh E,Chung H J,et al.Determination of ethyl carbamate in some fermented Korean foods and beverages[J].Food Additives and Contaminants,2000,17(6):469-475.
[3]Tang A S P,Chung S W C,Kwong K,et al.Ethyl carbamate in fermented foods and beverages:dietary exposure of the Hong Kong population in 2007-2008[J].Food Additives and Contaminants:Part B,2011,4(3):195-204.
[4]Ough C S.Ethyl carbamate in fermented beverage and foods.I.Naturally occurring ethylcarbamate[J].Journal of Agricultural and Food Chemistry,1976,24(2):323-328.
[5]周景文,堵国成,陈坚.发酵食品有害氨(胺)类代谢物:形成机制和消除策略[J].中国食品学报,2011,11(9):8-25.
ZHOU Jingwen,DU Guocheng,CHEN Jian.Harmful amines(ammonia)metabolites in fermented foods:formation mechamism and the elimination strategy[J].Journal of Chinese Institute of Food Science and Technology,2011,11(9):8-25.(in Chinese)
[6]Weber J V,Sharypov V I.Ethyl carbamate in foods and beverages:a review[J].Environmental Chemistry Letters,2009,7(3):233-247.
[7]Lachenmeier,Dirk Lima,Maria Nóbrega,et al.Cancer risk assessment of ethyl carbamate in alcoholic beverage from Brazil with special consideration to the spirits cachaca and tiquira[J].BMC Cancer,2010,10(1):266-280.
[8]刘俊,赵光鳌,徐岩.黄酒中氨基甲酸乙酯直接减除技术的研究[J].食品与生物技术学报,2011,31(2):171-175.
LIU Jun,ZHAO Guangao,XU Yan.Directly removal of ethyl carbamate in Chinese rice wine[J].Journal of Food Science and Biotechnology,2011,31(2):171-175.(in Chinese)
[9]Kitomoto K,Oda K,Gomi K,et al.Genetic engineering of a sake yeast producing no urea by successive disruption of arginase gene[J].Applied and Environmental Microbiology,1991,57(1):301-306.
[10]Scott D R,Marcus E A,Weeks D L,et al.Expression of the Helicobacter pylori ureI gene is required for acid pH activation of cytoplasmic urease[J].Infection and Immunity,2005,73(10):6737-6445.
[11]王松华,田亚平.产酸性脲酶菌株的筛选、鉴定及脲酶的应用初探[J].生物技术通报,2008,6:175-178.
WANG Songhua,TIAN Yaping.Isolation and identification of acid urease-producing strain and primary application[J]. Biotechnology Bulletin,2008,6:175-178.(in Chinese)
[12]Yang L Q,Wang S H,Tian Y P.Purification,properties,and application of a novel acid urease from Enterobacter sp.[J].Appl Biochem Biotechnol,2010,160(2):8159-8160.
[13]刘俊.中国黄酒中氨基甲酸乙酯控制策略及机制的研究[D].无锡:江南大学,2012.
[14]谷晓蕾,田亚平.变幻青霉氨基甲酸乙酯降解酶产酶条件优化及酶的底物特异性 [J].食品与生物技术学报,2013,32(6):603-607.
GU Xiaolei,TIAN Yaping.Optimization of fermentation conditions of variabile JN-525 and substrate specificity of urethanase[J]. Journal of Food Science and Biotechnology,2013,32(6):603-607.(in Chinese)
[15]Weatherburn M W.Phenol-hypochlorite reaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[16]王立媛,冯靓,吴平谷,等.分光光度法测定黄酒中尿素含量[J].中国卫生检验杂质,2010,20(11):3059-3061.
[17]刘俊,徐岩,陈双,等.顶空-固相微萃取-气质联用技术快速测定黄酒中氨基甲酸乙酯的方法研究 [J].食品工业科技,2012,33(4):60-69.
LIU Jun,XU Yan,CHEN Shuang,et al.Rapid determination of ethyl carbamate in Chinese rice wine by HS-SPME and GC-MS [J].Science and Technology of Food Industry,2012,33(4):60-69.(in Chinese)
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:85-87.
[19]Poore C A,Mobley H L T.Differential regulation of the Proteus mirabilis urease gene cluster by UreR and H-NS[J]. Microbiology,2003,149(12):3383-3394.
[20]Mobley H L,Island M D,Hausinger R P.Molecular biology of microbial urease[J].Microbiological Reviews,1995,59(3):451-480.
[21]Sachs G,Weeks D L,Wen Y,et al.Acid acclimation by Helicobacter pylori[J].Physiology,2005,20(6):429-438.
[22]Scott D,Weeks D,Hong C,et al.The role of internal urease in acid resistance of Helibobacter pylori[J].Gastroenterology,1998,114(1):58-70.
Identification and Enzyme Characterization of a Urease and Urethanase-Producing Strain
YANG Guangming, ZHA Xiaohong, TIAN Yaping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
A strain capable of producing urethanase was isolated from the mouse intestines and identified as Providencia sp.By analyzing the 16S rDNA sequence and conducting the physiology and chemistry experiment.The substrate specificity experiment showed that the enzyme can catalyze both urea and urethane with the optimal pH of 4.5 and optimal temperature of 35℃but had no influence on the ester and amino acid.The fermentation condition was optimized based on single factor experiment.Under the optimal condition,the acid urethanase activity was increased from 0.32 U/mL to 0.63 U/mL and acid urease activity from 0.87 U/mL to 1.95 U/mL.The crude enzyme can effectively decompose the urea and EC in the Chinese rice wine and has little effect on the flavor components.
strain identification,acid urethanase,acid urease,enzyme-producing condition,enzyme characterization
Q 55
A
1673—1689(2015)01—0007—08
2014-04-10
国家973计划项目(2012CB720802)。
*通信作者:田亚平(1964—),女,江苏无锡人,工学博士,教授,主要从事生物活性物质研究。E-mail:yapingtian@hotmail.com
