HPLC法测定肾茶中3种甲氧基黄酮类活性成分*
2015-01-05李光路娟李学兰张宁刘斌陈曦
李光,路娟,李学兰,张宁,刘斌,陈曦
·药物制剂与药品质量控制·
HPLC法测定肾茶中3种甲氧基黄酮类活性成分*
李光1,2,路娟3,李学兰1,2,张宁4,刘斌4,陈曦3
(1.中国医学科学院药用植物研究所云南分所,景洪 666100;2.云南省西双版纳傣族自治州傣药南药重点实验室,景洪 666100;3.中国医学科学院药用植物研究所,北京 100193;4.黑龙江中医药大学佳木斯学院,佳木斯 154007)
目的 建立测定肾茶提取物中橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚含量的方法。方法 采用高效液相色谱(HPLC)法,Symmetry C18(4.6 mm×150 mm,5 μm)色谱柱,流动相为乙腈-0.05%磷酸盐缓冲液,梯度洗脱;流速:1 mL·min-1,柱温:35 ℃,检测波长:365 nm,进样量为10 μL。结果 橙黄酮在0.50~5.00 μg、半齿泽兰素在0.50~5.00 μg、半齿泽兰素-5-甲醚在0.05~0.50 μg范围内具有良好的线性关系;平均加样回收率分别为101.26%,100.28%和99.66%。RSD分别为1.73%,0.82%和1.68%。结论 该方法简便、准确,可用于肾茶的质量评价。
肾茶;色谱法,高效液相;橙黄酮;半齿泽兰素;半齿泽兰素-5-甲醚
肾茶(又名猫须草,傣药名为雅糯渺)来源于Clerodendranthusspicatus(Thunb.)C.Y.Wu ex H.W.Li(又称Orthosiphonstamineus)的全草,是傣医常用的排解人体内积蓄毒素的药物,具有清热解毒、利水消肿、利尿化石等功能,是传统傣医用于预防和治疗肾、膀胱、尿道等泌尿系统感染疾病的首选药材[1]。现代研究表明,肾茶提取物具有利尿排石[2]、抗氧化[3]、降血压[4]、保肝[5]等活性,课题组前期研究发现,肾茶提取物具有明显的降血糖[6]、提高半乳糖所致衰老小鼠学习能力[7]等作用,具有较大的应用开发价值。
肾茶中主要的活性成分是甲氧基黄酮[8-9],由橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚等组成[10]。甲氧基黄酮类具有明显的抗氧化[11-12]、抗肿瘤[13]、抗炎[14]、免疫调节[15]及保护心血管[16]作用,被誉为“天然抗氧化剂”。目前肾茶质量控制的方法多为测定肾茶中酚酸类成分[17-18],或者测定甲氧基黄酮类成分[19],这些方法尽管分离度较好,但出峰时间短,5 min中内全部出峰,对样品处理要求较高,对于传统药物中复杂提取物测定有效成分适用性不高。笔者拟建立一种较为快速测定肾茶中3种主要甲氧基黄酮方法以完善肾茶质量控制,在此基础上,比较不同产地肾茶中甲氧基黄酮类的含量,为后期产品开发奠定基础。
1 仪器与试药
1.1 仪器 超高效液相色谱仪(PDA检测器,Waters ACQUITY UPLC H-CLASS),AB265-S型分析天平(感量0.01 mg,瑞士梅特勒托利多公司);优普超纯水仪。
1.2 试药 橙黄酮、半齿泽兰素对照品(含量分别为95.0%,98.3%,批号分别为12101311,10111422)购自百灵威公司,半齿泽兰素-5-甲醚对照品(含量为98.5%,批号:0305100)购自Indofine Chemical Company;乙腈为色谱纯(Fisher公司),水为超纯水,其他试剂为分析纯。肾茶样品采自云南、福建、广东、广西、海南等全国各主产区,采集时间为2009年9—10月,经中国医学科学院药用植物研究所云南分所李学兰研究员鉴定为唇形科肾茶属Clerodendranthusspicatus(Thunb.)C.Y.Wu植物的地上部分。
2 方法与结果
2.1 色谱条件 色谱柱:Symmetry C18(4.6 mm×150 mm,5 μm),流动相为乙腈-0.05%磷酸盐缓冲液,洗脱梯度为0~30 min 乙腈浓度为5%→100%,30~40 min 乙腈浓度为100%;流速:1 mL·min-1,柱温:35 ℃,检测波长:365 nm,进样量为10 μL,样品经孔径0.45 μm微孔滤膜滤过,各种甲氧基黄酮类成分色谱峰与其他色谱峰基线分离,方法学考察结果显示此条件适用于肾茶中甲氧基黄酮类的含量测定。
2.2 对照品溶液的制备 分别精密称取橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚对照品各5 mg,置10 mL量瓶中,加甲醇超声溶解并定容,过孔径0.22 μm微孔滤膜,取续滤液作为对照品溶液,备用。
2.3 供试品溶液的制备 精密称取肾茶粉末4.0 g,加入甲醇25 mL,超声提取30 min,滤过,滤液过孔径0.22 μm微孔滤膜,取续滤液作为供试品溶液,4 ℃冷藏备用。
2.4 线性关系考察 在“2.1”项色谱条件下分别进样对照品溶液1,2,4,6,8,10 μL,以进样量为横坐标(X),峰面积为纵坐标(Y),建立标准曲线,得到橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚对照品的回归方程分别为Y=323 704X+29 378,r=0.999 5;Y=338 223X+17 097,r=0.999 2;Y=381 229X+709.5,r=0.999 1,显示橙黄酮在0.50~5.00 μg、半齿泽兰素在0.50~5.00 μg、半齿泽兰素-5-甲醚在0.05~0.50 μg范围内具有良好的线性关系。见图1。
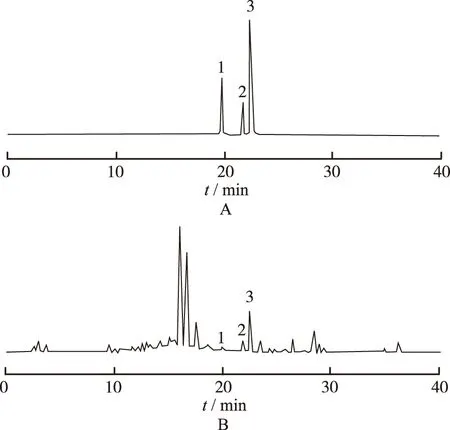
A.对照品;B.肾茶样品;1.半齿泽兰素-5-甲醚;2.橙黄酮;3.半齿泽兰素
图 1 两种溶液的HPLC图谱
A.reference substance;B.Orthosiphonstamineussample;1.3′-hydroxy-5,6,7,4′-tetramethoxyflavone;2.sinensetin;3.eupatorin
Fig.1 HPLC chromatograms of two kinds of solutions
2.5 精密度实验 精密量取“2.3”项制备供试品溶液10 μL,于“2.1”项色谱条件下,连续进样6次,记录色谱图,分别计算样品中3种甲氧基黄酮峰面积的RSD。结果表明RSD在0.566%~1.634%,说明仪器精密度良好。
2.6 重复性实验 按照“2.3”项供试品溶液制备方法,平行制备供试品溶液5份。于“2.1”项色谱条件下进样测定,计算样品中3种甲氧基黄酮含量的RSD。结果表明RSD在1.219%~1.852%,说明实验重复性良好。
2.7 稳定性实验 按照“2.3”项制备供试品溶液,在“2.1”项色谱条件下分别于0,2,4,6,8,10 h进样,计算样品中3种甲氧基黄酮峰面积RSD。结果表明RSD在1.195%~1.910%,说明供试品10 h内稳定性良好。
2.8 加样回收率实验 取已知含量的肾茶样品4.0 g,精密称定,分别精密加入橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚对照品(按纯品计算)47.50,78.64,9.85 mg,与样品混合,按“2.3”项方法制备供试品溶液,在“2.1”项下色谱条件进行测定,计算橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚回收率。结果表明平均加样回收率分别为101.26%,100.28%和99.66%。RSD在0.82%~1.73%,RSD<2%,说明3种甲氧基黄酮类的回收率符合要求。见表1。
2.9 样品测定 分别取不同产地肾茶按“2.3” 项方法制备供试品溶液并进行测定,结果见表2。
通过测定13份肾茶样品,3种主要甲氧基黄酮总含量6.23%~9.29%,平均含量为7.82%,白花肾茶的含量为7.45%,紫花肾茶含量为8.40%,紫花肾茶含量普遍较高,并以景洪药植所的含量最高,为9.29%。
3 讨论
肾茶为西双版纳傣族自治州的傣族人常用药物,平时代茶饮,用于治疗肾炎、肾结石等疾病,东南亚地区居民也习惯应用该药材,相继发现该药材还具有降血脂及抑菌作用,该药物保健功能逐渐受到广泛关注[20],深入研究其质量控制方法显得尤为重要。
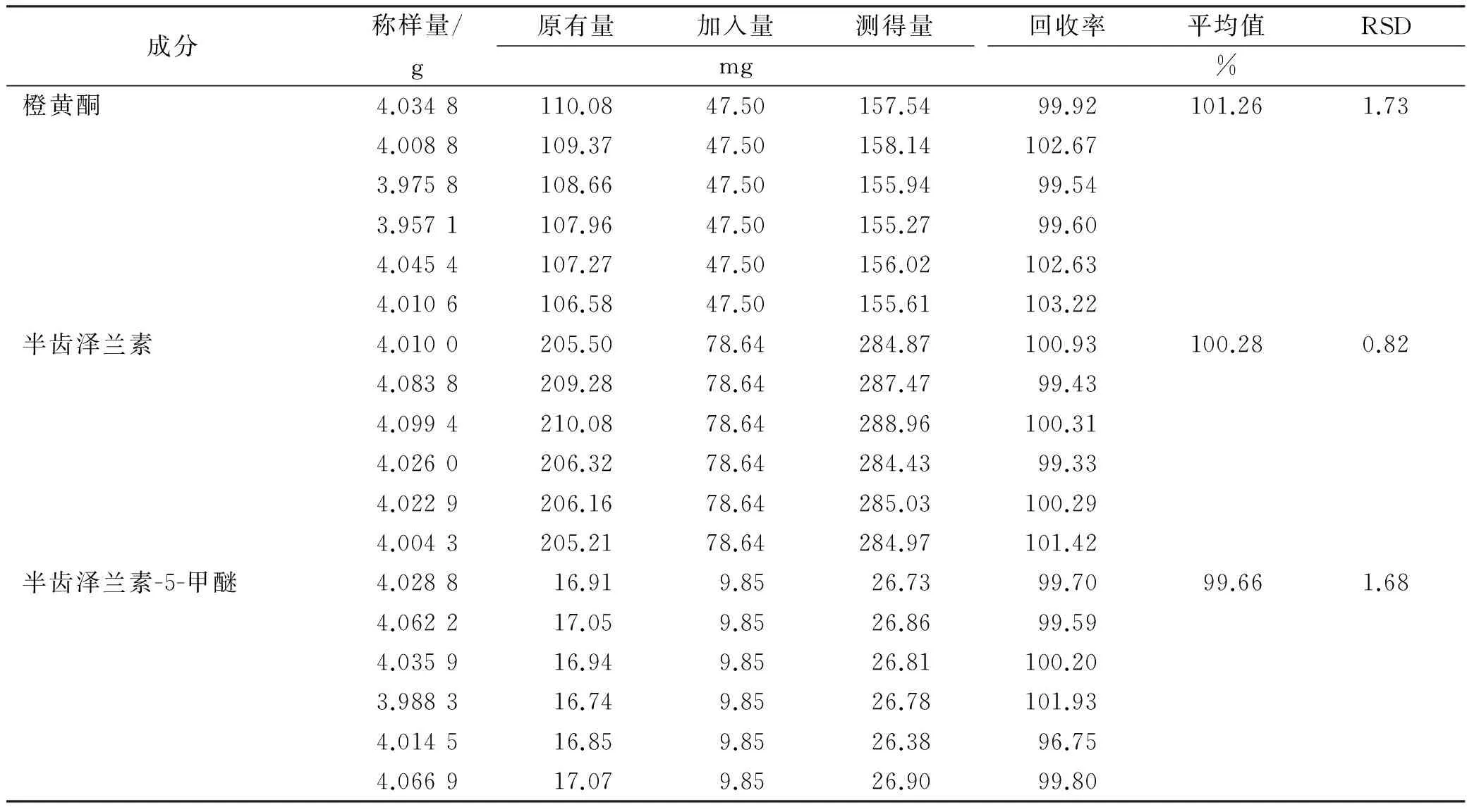
表1 肾茶样品中3种甲氧基黄酮类成分加样回收率Tab.1 Recovery test of three kinds of methoxy flavonoids ingredients in shencha sample
表2 不同产地肾茶中3种甲氧基黄酮类成分含量比较
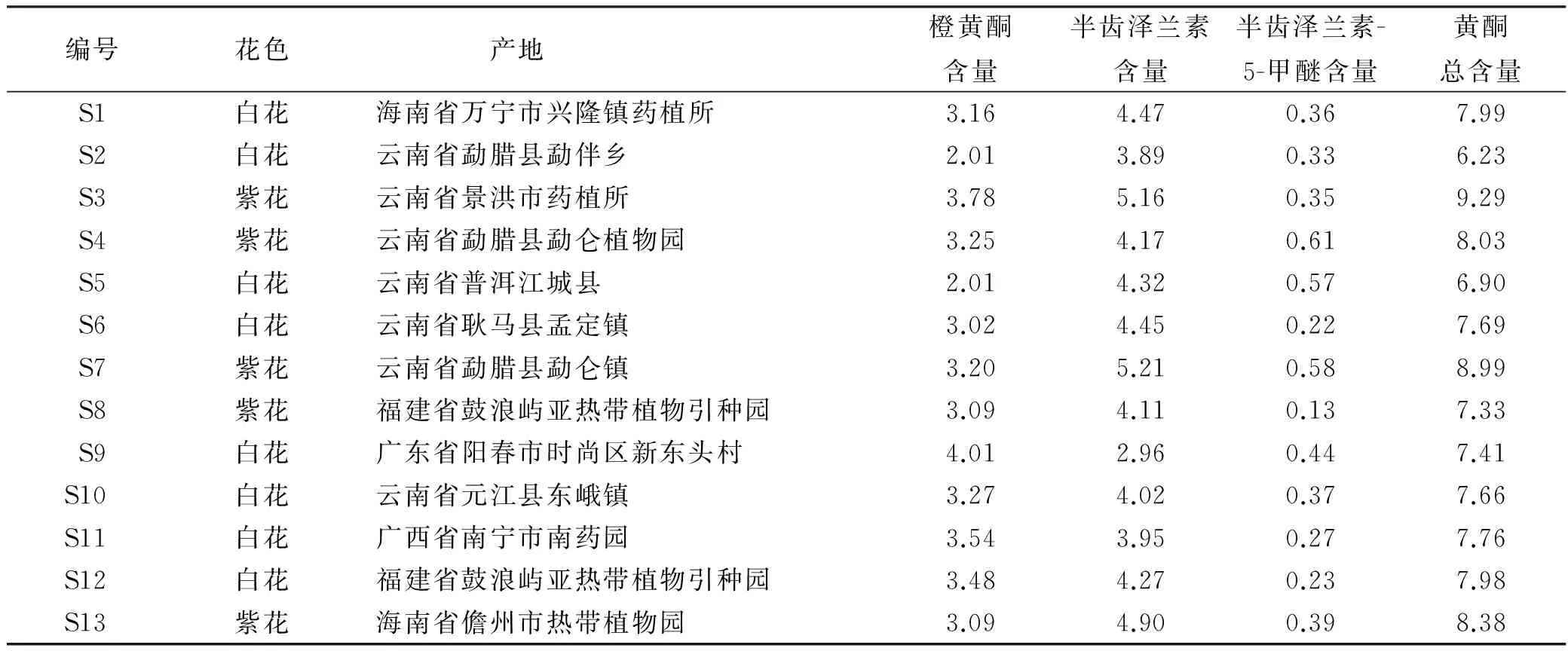
Tab.2 Comparision of content determination among three kinds of methoxy flavonoids ingredients in Orthosiphon stamineus samples from different habitats %
本实验建立了同时测定3种主要甲氧基黄酮类成分的方法,能够实现对肾茶提取物中甲氧基黄酮类成分的同时测定。本实验结果显示,紫花肾茶中甲氧基黄酮总含量明显高于白花肾茶品种,这与之前指纹图谱[21]测定结果吻合,而且景洪市肾茶含量最高,这可能与该地区充足的日照条件有关,高日照条件下可刺激植物产生大量的黄酮类次生代谢产物[11]。
[1] 林艳芳,依专,赵应红.中国傣医药彩色图谱[M].昆明:云南民族出版社,2003:408-409.
[2] ARAFAT O M,THAM S Y,SADIKUN A,et al.Studies on diuretic and hypouricemic effects ofOrthosiphonstamineusmethanol extracts in rats[J].J Ethnopharmacol,2008,118(3):354-360.
[3] MATKOWSKI A.Antioxidant activity of extracts and differ-ent solvent fractions ofGlechomahederaceaL.andOrthosiphonstamineus(Benth.)Kudo[J].Clin Exp Med,2008,17(6):615-624.
[4] AZIZAN N A,AHMAD R,MOHAMED K,et al.Theinvivoantihypertensive effects of standardized methanol extracts ofOrthosiphonstamineuson spontaneous hypertensive rats: a preliminary study[J].African J Pharm Pharmacol,2012,6(6):376-379.
[5] ALSHAWSH M A, ABDULLA M A, ISMAIL S, et al.Hepatoprotective effects ofOrthosiphonst-amineusextract on thioacetamide-induced liver cirrhosis in rats[J].Evid Based Complement Alternat Med,2011,doi:10.3390/molecules17055385.
[6] 李光,陈曦,路娟,等.肾茶水提物喷干粉对链脲霉素所致糖尿病大鼠降血糖作用机制研究[J].中华中医药杂志,2013(12):3653-3656.
[7] 汪泽栋,李宜航,陈曦,等.肾茶水提物喷干粉对D-半乳糖所致衰老小鼠学习记忆功能的影响[J].天然产物研究与开发,2013(12):1649-1652.
[8] LYCKANDER I M,MALTERUD K E.Lipophilic flavonoids fromOrthosiphonspicatusprevent oxidative inactivation of 15-lipoxygenase[J].Prostaglandins Leukot Essent Fatty Acids,1996,54(4):239-246.
[9] OLAH N K,RADU L,MOGOSAN C,et al.Phytochemical and pharmacological studies onOrthosiphonstamineusBenth.(Lamiaceae)hydroalcoholic extracts[J].J Pharm Biomed Anal,2003,33(1):117-123.
[10] AKOWUAH G A,ZHARI I,NORHAYATI I,et al.Sinen-setin,eupatorin,3'-hydroxy-5,6,7,4'-tetramethoxyflavone and rosmarinic acid contents and antioxidative effect ofOrthosiphonstamineusfrom Malaysia[J].Food Chem,2004,87(4):559-566.
[11] FARHAN M,RAZAK S A,PIN K Y,et al.Antioxidant activity and phenolic content of different parts ofOrthosiphonstamineusgrown under different light intensities.[J].J Tropical Forest Sci,2012,24(2):173-177.
[12] 单杨,李高阳,李忠海.柑橘皮中多甲氧基黄酮的体外抗氧化活性研究[J].食品科学,2007,28(8):100-103.
[13] AKAO Y,OHGUCHI K,IINUMA M,et al.Interactive effe-cts of polymethoxy flavones fromCitruson cell growth inhibition in human neuroblastoma SH-SY5Y cells[J].Bioorg Med Chemist,2008,16(6):2803-2810.
[14] 张金杰,陈宇峰,颜鸣,等.野菊花中的黄酮类化学成分[J].医药导报,2013,32(1):15-18.
[15] MANTHEY J A,BENDELE P.Anti-inflammatory activity of an orange peel polymethoxylated flavone,3′,4′,3,5,6,7,8-heptamethoxyflavone,in the rat carrageenan/paw edema and mouse lipopolysaccharide-challenge assays[J].J Agric Food Chem,2008,56(20):9399-9403.
[16] GREEN C O,WHEATLEY A O,HANCHARD B,et al.His-topathological alterations in organ structures of hypercholesterolemic rats fed ortanique peel polymethoxylated flavones[J].Basic Appl Pathol,2011,4(3):71-77.
[17] 张丽丽,敬应春,彭崇胜,等.HPLC 法测定不同产地傣药肾茶中的迷迭香酸[J].中成药,2011,33(8):1378-1381.
[18] 康绍建,侯安国,沈妍.傣药肾茶中熊果酸的含量测定[J].云南中医中药杂志,2010,31(7):54-56,96.
[19] HUSSIN M E A,YAM M F,ANG L F,et al.A simple iso-cratic HPLC method for the simultaneous determination of sinensetin,eupatorin,and 3′-hydroxy-5,6,7,4′-tetramethoxyflavone inOrthosiphonstamineusextracts[J].J Acupunct Merid Studies,2012,5(4):176-182.
[20] SON J Y,PARK S Y,KIM J Y,et al.Orthosiphonstamineusreduces appetite and visceral fat in rats[J].J Korean Soc Appl Biolog Chemist,2011,54(2):200-205.
[21] 李光,陈曦,李宜航,等.不同产地肾茶HPLC指纹图谱研究[J].中国现代中药,2013,15(6):448-451.
Determination of Three Active Flavones in Orthosiphon stamineus by HPLC
LI Guang1,2,LU Juan3,LI Xuelan1,2,ZHANG Ning4,LIU Bin4,CHEN Xi1,3
(1.YunnanBranch,InstituteofMedicinalPlant,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Jinghong666100 ,China;2.KeyLaboratoryofDaiandSouthernMedicineofXishuangbannaDaiAutonomousPrefecture,YunnanProvince,Jinghong666100 ,China;3.InstituteofMedicinalPlant,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Beijing100193,China;4.JiamusiCollege,HeilongjiangUniversityofTraditionalChineseMedicine,Jiamusi154007,China)
Objective To develop a method for content determination of sinensetin,eupatorin,and 3′-hydroxy-5,6,7,4′-tetramethoxyflavone inOrthosiphonstamineus. Methods The determination was carried out on a Symmetry C18column (4.6 mm×250 mm,5 μm) by HPLC.The mobile consisted of acetonitrile and water containing 0.05% H3PO4in gradient elution.The flow rate was 1 mL·min-1,the column temperature was 35 ℃,the detected wavelength was set at 365 nm, and the injection volume was 10 μL. Results The peak areas and the sample quantity of the three components presented good linear relationship in the range of 0.50-5.00 μg for sinensetin,0.50-5.00 μg for eupatorin,and 0.05-0.50 μg for 3′-hydroxy-5,6,7,4′-tetramethoxyflavone.The average recoveries were 101.26%,100.28% and 99.66%,respectively. RSD were 1.73%, 0.82% and 1.68%, respectively. Conclusion The method is proved to be simple,accurate and can be used for the quality evaluation ofOrthosiphonstamineus.
Orthosiphonstamineus; Chromatography,high performance liquid; Sinensetin; Eupatorin; 3′-hydroxy-5,6,7,4′-tetramethoxyflavone
2014-04- 03
2014-11-14
*北京协和医学院协和青年基金资助项目(3332013081,33320140076);中央级公益性科研院所基本科研业务基金资助专项(YZYN-14-02、YZYN-13-02);黑龙江省自然科学基金面上项目(H201328)
李光(1985-),男,河北安国人,助理研究员,硕士,从事民族药药理及开发工作。电话:0691-2136981,E-mail:lhbg311@hotmail.com。
陈曦(1973-),男,黑龙江齐齐哈尔人,副研究员,博士,从事中药药理及开发工作。电话:010-62799771,E-mail:91chenxi12@163.com。
R286;R927.2
B
1004-0781(2015)09-1203-04
10.3870/j.issn.1004-0781.2015.09.023
