甲氧西林耐药金黄色葡萄球菌SCCmec耐药元件及其菌株间水平转移机制
2015-01-05于俊媛张雯庆
于俊媛, 张雯庆, 祁 琳, 李 萌, 黎 庶
·综述·
甲氧西林耐药金黄色葡萄球菌SCCmec耐药元件及其菌株间水平转移机制
于俊媛, 张雯庆*, 祁 琳*, 李 萌**, 黎 庶
葡萄球菌盒式染色体元件; 金黄色葡萄球菌盒式染色体重组酶; 耐甲氧西林金黄色葡萄球菌; 基因水平转移
金黄色葡萄球菌(金葡菌)是人及动物正常菌群的重要组成成分。部分金葡菌可导致疾病,引起皮肤、黏膜等处的化脓性感染,甚至导致菌血症、中毒性休克综合征等危及患者生命的严重疾病,是医院感染和社区获得性感染的重要病原菌之一。自1961年出现以来,耐甲氧西林金葡菌(MRSA)的感染率逐年攀升[1]。据估计,2005年美国因MRSA感染死亡的住院患者总数已超过同年因肝炎和艾滋病(AIDS)死亡的人数之和[2];在我国,2012年医院细菌耐药监测资料显示金葡菌分离株中MRSA的平均检出率为47.9%[3]。MRSA感染已经成为严重的全球性公共卫生问题。
MRSA的出现源于基因组上一个可移动遗传元件——葡萄球菌盒式染色体元件(staphylococcal cassette chromosome,SCC)的获得,菌株也因此获得针对包括甲氧西林在内的多种抗菌药物的耐受能力[4]。SCC元件可在不同MRSA菌株之间水平转移,进而导致金葡菌耐药性的传递与播散。金葡菌盒式染色体重组酶(cassette chromosome recombinase,Ccr)则在此转移过程中发挥着重要作用。本文即针对MRSA SCC元件及其由Ccr介导的菌株间转移作一综述。
1 SCCmec元件的结构
MRSA SCC元件整合于MRSA菌株基因组复制起始点附近,全长约21~67 kb,由mec复合体区域、ccr复合体区域以及非mec非ccr高变区域(junkyard regions,J区)3部分组成,与编码金葡菌碱基转移酶的orf X基因3'-末端存在15 bp的重合(图1)[4-5]。
mec复合体区域由mecA基因、mecA表达调控基因(包括调节基因mecR1和抑制基因mecI)及位于其上下游的一些插入序列(如IS431、IS1272等)组成。mecA基因编码一种新型的青霉素结合蛋白PBP2a(PBP2'),PBP2a与甲氧西林的亲合力低于内源性青霉素结合蛋白PBP2,能替代被甲氧西林抑制的PBP2蛋白行使转肽酶及转糖基酶活性,维持细菌细胞壁的合成,干扰甲氧西林抗菌作用的发挥,使细菌获得针对β内酰胺类抗生素的耐药性,故SCC元件也称为SCCmec元件[6]。mecI和mecR1共同调控mecA基因的表达,但对临床分离的绝大多数MRSA而言,mecI基因常常缺失或突变,mecR1也呈现出不同程度的残缺和不完整[4]。根据mecA基因调控元件的完整性及插入序列的不同,mec复合物可分为A~E 5类,见表1[7]。
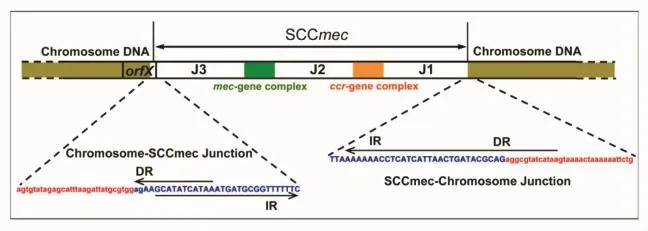
图1 SCC mec元件的基本结构(引自文献4)
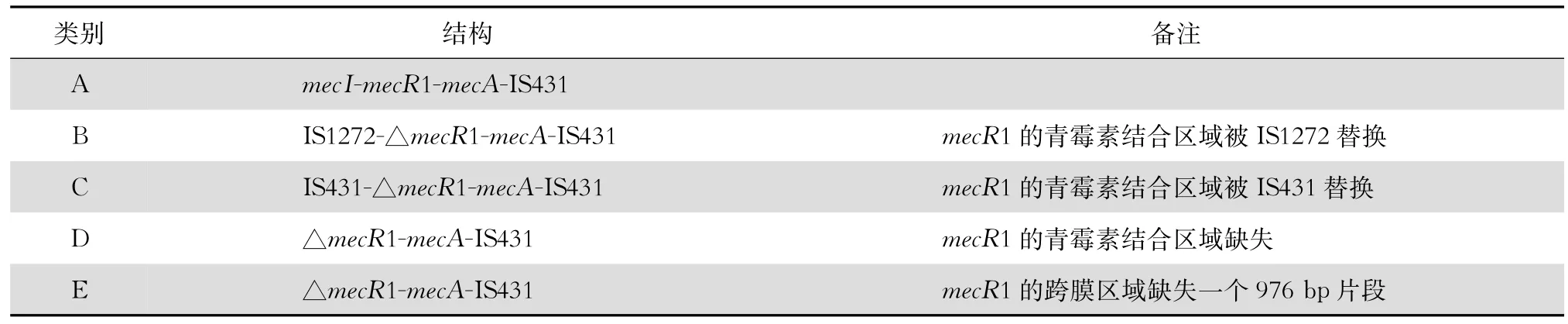
表1 mec复合物分类
ccr复合体区域由ccr基因及包绕其左右的序列组成。ccr基因编码的位点及方向特异性重组酶(即Ccr),属于丝氨酸重组酶家族,参与SCCmec元件从MRSA供体菌基因组上精确切离过程并能介导游离SCCmec元件以正确的方向整合入受体菌基因组中,在SCCmec元件的水平转移过程中发挥着重要的作用。根据碱基序列同源性,Ccr编码基因可分为ccrA、ccrB和ccrC3类[7-8]。其中,ccrA和ccrB基因位于同一个基因操纵子中,常以异源二聚体的形式存在。ccrAB基因可进一步分为4个亚型(ccrA1B1~ccrA4B4),各亚型之间碱基同源性在50%~85%。而ccrC基因的碱基组成则较为保守,同源性大于 87%,故目前仅划定一种类型,即ccrC1[8]。
J区是指SCCmec元件上除了mec和ccr复合体外的区域,是SCCmec元件的非必需组分,包含大量的假基因及转座、插入序列,是SCCmec元件划分亚型的依据。J区中携带着多种抗生素耐药决定簇(如Tn554携带介导红霉素、链霉素耐药的基因;PUB110带有博来霉素、妥布霉素耐药基因;Tn4001转座子中aacA-aph D基因介导氨基糖苷类抗生素耐药;而PT181则与四环素耐药密切相关等),因而,除耐甲氧西林外,SCCmec元件的存在使 MRSA菌株同时获得对四环素类、氨基糖苷类、β内酰胺类、大环内酯类等多种抗生素的耐药能力[4],SCCmec元件也被称作金葡菌的抗生素耐受岛(drug-resistant genomic island),是MRSA等耐药菌具有多重耐药性的重要原因,也使得 MRSA感染的临床治疗成为目前临床医学所面临的巨大难题。
2 SCCmec元件分类
依据mec复合体组成及ccr复合体类型的不同,以及被发现的先后顺序,目前已鉴定出11种不同的SCCmec亚型(SCCmecⅠ~Ⅺ),见表2、图2[4,9]。
3 SCCmec元件的转移
SCCmec元件在金葡菌染色体中并不是稳定存在的。即使是在正常生长状态下,SCCmec元件也可自发从 MRSA基因组中脱落,头尾相连形成闭合环状结构游离于菌体细胞内,环化的SCCmec元件可以在不同种属葡萄球菌之间水平转移,是一种可移动遗传元件,所编码的多重耐药性也得以在不同MRSA菌株间转移与播散[10-11]。
多项研究显示,SCCmec元件的水平转移与该元件编码的Ccr重组酶密切相关[12]。细菌体内Ccr AB重组酶的过表达能显著提高SCCmec元件的解离率(the frequency of excision)[13]。Misiura等[8]分析认为,SCCmec元件的整合或切离过程包括以下步骤;①外源性环状SCCmec元件进入细菌体内,Ccr启动表达,特异性识别并结合位于MRSA菌株基因组复制起始位点附近的attB序列(与MRSAorf X基因3'-末端有15 bp的碱基重叠)以及位于游离的环状SCCmec元件上的attSCC序列;②通过Ccr介导,attB序列和attSCC序列彼此靠拢;③借助Ccr的切离酶(excisionase)活性,attB及attSCC DNA片段断裂进而发生180°旋转,彼此交换一半的DNA序列,形成2个杂合的新型att位点;att L位点(由attB位点的5'-端序列及attSCC位点的3'-端序列组成)及attR位点(由attSCC位点的5'-端序列及attB位点的3'-端序列组成);④Ccr发挥整合酶活性,催化SCCmec元件插入细菌基因组中(此时,SCCmec元件两端的att位点分别为att L位点和attR位点),金葡菌因此获得SCCmec元件编码的新的生物学特征,由MSSA转变为MRSA。反之,则为MRSA基因组SCCmec元件的切离过程。见图3。

表2 SCC mec元件分类
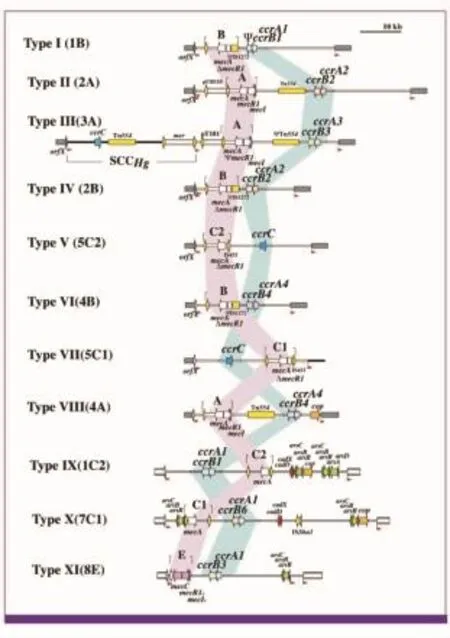
图2 MRSA SCC mecⅠ-Ⅺ组成模式图(引自文献4)
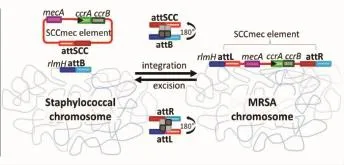
图3 SCC mec元件整合/切离模式图(引自文献8)
在Ccr AB参与的SCCmec元件切离/整合过程中,Ccr A亚基主要发挥DNA识别结合功能,能特异性识别attB及att L位点5'-端与基因组orf X基因重叠的序列(图3中深蓝色DNA片段),从而确定SCCmec元件插入或切离的部位[8]。CcrB亚基则发挥整合酶或切离酶的功能,催化SCCmec元件插入与切离脱落过程的发生。研究显示,当CcrB蛋白单独表达时,CcrB能催化两端序列分别为attSCC×attSCC、attSCC×attR及attR×attR的SCCmec元件的切离与插入;而当Ccr A、CcrB亚基同时表达时,除两端序列分别为attB×attB、att L×att L、attB×att L的组合外,其余类型的SCCmec元件均能被正确的切离与插入。CcrB亚基识别重组位点的非特异性,使得其他具有与SCCmecatt位点相似序列的移动元件均可能在Ccr作用下插入到MRSA基因组的att L与attR位点之间,使MRSA菌株能快速获得新的基因及生物学性状,有利于MRSA的进化及对生存环境的快速适应。同时,这也是SCCmec元件具有多样性,逐步进化形成21~67 kb的SCCmec超家族的重要原因[8]。
4 Ccr的表达调控
通常情况下,SCCmec元件自发切离频率极低。Stojanov等[14]对ccrAB基因启动子的研究显示;一个MRSA培养物中,绝大多数菌株ccrAB基因启动子的活性处于抑制状态,仅1%~3%细菌能表达Ccr。这部分细菌的SCCmec元件就能在Ccr作用下从基因组上切离、脱落下来并转移到新的菌株中,使细菌的耐药性得以传递。而对于那些ccrAB基因启动子处于激活状态的 MRSA菌株而言,其对数生长期ccrAB基因启动子的活性明显高于平台期;并且,高温(如42℃)、培养条件(如不同培养基)、生存环境、细菌遗传背景、丝裂霉素及某些抗菌药物(如苯唑西林、头孢西丁、氨苄青霉素等β内酰胺类抗生素及万古霉素)的使用均可影响ccrAB基因启动子活性的高低,进而影响 Ccr的表达[14-15],提示ccr基因启动子的激活受着严格的调控,只是调控的具体分子机制至今仍不清楚。Stojanov等[14]曾将克隆了ccrAB基因启动子的质粒转入SCCmec元件缺失的MRSA N315突变株体内,ccrAB基因启动子能正常激活并启动报告基因的表达,提示MRSA SCCmec元件中不含有能调节ccrAB基因启动子活性的基因,SCCmec元件及表达产物不参与Ccr的表达调控;Stojanov等[14]也曾分析MRSA的核心基因组及SCCmec元件序列,没有找到类似调节枯草芽孢杆菌ICEBs1基因岛切离插入所需的阻遏/反阻遏调控系统(repressor/antirepressor system)[14];也未能在ccrAB基因启动子区域发现RNA聚合酶核心酶σ因子的特异性结合位点[14]。因而,迄今为止,ccrAB基因的表达调控机制尚有待人们深入研究。对Ccr表达调控机制的深入认识,将进一步阐明MRSA菌株SCCmec元件的水平转移机制,揭示MRSA多重耐药性的播散机制。
[1] Iwamoto M,Mu Y,Lynfield R,et al.Trends in invasive methicillin-resistantStaphylococcus aureusinfections[J].Pediatrics,2013,132(4);e817-e824.
[2] DeLeo FR,Chambers HF.Reemergence of antibiotic-resistantStaphylococcus aureusin the genomics era[J].J Clin Invest,2009,119(9);2464-2474.
[3] 汪复,朱德妹,胡付品,等.2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2013,13(5);321-330.
[4] Hiramatsu K,Ito T,Tsubakishita S,et al.Genomic basis for methicillin resistanceinStaphylococcusaureus[J].Infect Chemother,2013,45(2);117-136.
[5] Boundy S,Safo MK,Wang L,et al.Characterization of theStaphylococcus aureusrRNA methyltransferase encoded byorf X,the gene containing the staphylococcus chromosome casstte mec(SCCmec)insertion site[J].J Biol Chem,2013,288(1);132-140.
[6] Xia J,Gao J,Kokudo N,et al.Methicillin-resistantStaphylococcusaureusantibiotic resistance and virulence[J].Biosci Trends,2013,7(3);113-121.
[7] Hanssen AM,Ericson Sollid JU.SCCmecin staphylococci;genes on the move[J].FEMS Immunol Med Microbiol,2006,6(1);8-20.
[8] Misiura A,Pigli YZ,Boyle-Vavra S,et al.Roles of two large serine recombinases in mobilizing the methicillin-resistance cassette SCCmec[J].Mol Microbiol,2013,88(6);1218-1229.
[9] International Working Group on the Classification of Staphylococcal Cassette Chromosome Elements(IWG-SCC).Classification of staphylococcal cassette chromosomemec(SCCmec);guidelines for reporting novel SCCmecelements[J].Antimicrob Agents Chemother,2009,53(12);4961-4967.
[10] Boundy S,Zhao Q,Fairbanks C,et al.Spontaneous staphylococcal cassette chromosomemecelement excision inStaphylococcus aureusnasal carriers[J].J Clin Microbiol,2012,50(2);469-471.
[11] Bloemendaal AL,Brouwer EC,Fluit AC.Methicillin resistance transfer fromStaphylococcus epidermidisto methicillin-susceptibleStaphylococcus aureusin a patient during antibiotic therapy[J].PLoS One,2010,5(7);e11841.
[12] Wang L,Archer GL.Roles of Ccr A and CcrBin excision and integration of staphylococcal cassette chromosomemec,aStaphylococcus aureusgenomic island[J].J Bacteriol,2010,192(12);3204-3212.
[13] Noto MJ,Archer GL.A subset ofStaphylococcus aureusstrains harboring staphylococcal cassette chromosomemec(SCCmec)type IV is deficient in Ccr AB-mediated SCCmecexcision[J].Antimicrob Agents Chemother,2006,50(8);2782-2788.
[14] Stojanov M,Sakwinska O,Moreillon P.Expression of SCCmeccassette chromosome recombinases in methicillin-resistantStaphylococcus aureusandStaphylococcus epidermidis[J].Antimicrob Chemother,2013,68(4);749-757.
[15] Higgins PG,Rosato AE,Seifert H,et al.Differential expression of ccr A in methicillin-resistantStaphylococcusaureusstrains carrying staphylococcal cassette chromosomemectype II and IVa elements[J].Antimicrob Agents Chemother,2009,53 (10);4556-4558.
The staphylococcal cassette chromosome mec(SCC mec)element ofS.aureusand its horizontal transfer
YU Junyuan,ZHANGWenqing,QI Lin,LI Meng,LI Shu.(Department of Microbiology,the Third Military Medical University,Chongqing 400038,China)
R378.11
A
1009-7708(2015)02-0180-04
2014-04-16
2014-09-09
国家自然科学基金(31470241);重庆市自然科学基金(cstc2011jjA10050,CSTC 2011BB5026);第三军医大学基础部本科生‘创新杯’奇思妙想活动资助项目(jc2013049)。
第三军医大学基础部微生物学教研室,重庆400038;*护理学院;**学员11营。
于俊媛(1989—),女,硕士,主要从事耐甲氧西林金黄色葡萄球菌耐药机制研究。
黎庶,E-mail;lishu72®aliyun.com。
