食品中邻苯二甲酸酯类化合物的分析方法研究进展
2015-01-04李晓敏张庆合李红梅
李晓敏, 王 景,2, 张庆合*, 李红梅
(1. 中国计量科学研究院化学计量与分析科学研究所, 北京 100029; 2. 北京普立泰科仪器有限公司, 北京 100095)
食品中邻苯二甲酸酯类化合物的分析方法研究进展
李晓敏1, 王 景1,2, 张庆合1*, 李红梅1
(1. 中国计量科学研究院化学计量与分析科学研究所, 北京 100029; 2. 北京普立泰科仪器有限公司, 北京 100095)
邻苯二甲酸酯是应用最广泛的增塑剂,具有生殖、发育毒性及致癌性,是近年来食品污染的一个重要来源。该类化合物种类多、同系物和同分异构体性质接近、在基体中含量范围宽,高效样品前处理、高选择性分离和高灵敏检测、降低本底干扰等技术是食品中邻苯二甲酸酯类化合物准确测定面临的挑战。本文综述了液液萃取、液液微萃取、固相萃取、固相微萃取、基质固相萃取等传统及新型的提取与净化技术在食品样品分析中的应用,比较分析了气相色谱、液相色谱、串联质谱、高分辨质谱以及酶联免疫、离子迁移谱等快速检测技术的特点,并展望了发展趋势。
邻苯二甲酸酯;食品;前处理技术;分析方法
邻苯二甲酸酯类化合物(PAEs),一般指的是邻苯二甲酸与1~15个碳的醇形成的酯,是广泛使用的增塑剂。大量的动物实验研究表明,PAEs具有生殖、发育毒性及致癌性[1,2],邻苯二甲酸二(2-乙基)己酯(DEHP)已被美国环保署列为2B类致癌物[3]。美国、欧盟、中国、日本等均制订相关法规限制PAEs的使用,特别是儿童用品、食品接触材料[4]等。我国(卫办监督函[2011]551号)关于通报食品及食品添加剂邻苯二甲酸酯类物质最大残留量规定DEHP、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二异壬酯(DINP)的最大残留量分别为1.5、0.3和9.0 mg/kg。因为PAEs无处不在,已经成为一类全球性的环境污染物。台湾“起云剂”风波,内地白酒的塑化剂事件,以及中国产“老干妈”瓶盖聚氯乙烯(PVC)垫圈中检出DEHP等,均对食品中PAEs的监测提出关注和要求。
食品中通常检测的PAEs有十几种(见表1),结构性质类似,对分离和定性定量技术提出较高的要求。食品基体复杂多样,针对不同类型的基体优化样品制备、高效提取和净化是主要的技术难点;另外,由于塑化剂类化合物在实验环境、试剂、仪器设备管路中均存在,会导致检测本底值干扰、灵敏度低、重现性差等问题,对痕量和超痕量检测的影响尤其显著。本文综合分析了近年来样品前处理、检测技术在食品中邻苯二甲酸酯类化合物分析的研究进展。

表1 常见邻苯二甲酸酯类化合物的名称和性质
1 样品前处理方法
食品中PAEs的样品前处理通常包括提取和净化两个步骤,目的在于尽可能完全地从食品基质中提取目标物,并去除干扰仪器检测的蛋白质、脂肪、色素等。
液液萃取是塑化剂检测中应用最为广泛的提取技术,PAEs是高脂溶性化合物,所以提取溶剂通常为正己烷、乙酸乙酯、二氯甲烷、乙醚、丙酮等非极性溶剂或不同比例的混合溶剂。根据食品基体组成差异,如固态或液态、油性或水性、蛋白及脂肪含量等性质,选择样品分散溶剂、提取溶剂及其比例,以最大限度地提取样品中的PAEs。对于水或果汁饮料等水性基质样品,仅需采用正己烷提取即可获得满意的回收率[5]。蜂蜜样品经过水溶后,采用正己烷提取,蜂王浆采用正己烷和丙酮(1∶1, v/v)提取,回收率可达80.1%~110.9%[6]。对于酒类样品,因为乙醇的存在改变了塑化剂在非极性提取溶剂和水相的分配系数,直接萃取效率低,实验表明,先去除酒类样品中大部分的乙醇后,用正己烷提取的效率可从20%~75%提高至80.8%~128.6%[7]。祝伟霞等[8]采用乙腈溶剂分散植物油、起酥油、辣椒酱、豆瓣酱、饼干等多种含油食品,加水稀释后,再用正己烷萃取其中的18种PAEs,除邻苯二甲酸二异癸酯(DIDP)的平均回收率为53.4%外,其他17种PAEs的回收率在76.8%~107.9%之间。液液微萃取技术是一种集采样、萃取和浓缩于一体的样品前处理方法[9]。Leng等[10]采用涡旋辅助表面增强乳化液相微萃取,以表面活性剂Triton X-100辅助四氯化碳萃取白酒中的PAEs,回收率为77.8%~93.7%,整个前处理仅需30 s。Cinelli等[11]以二氯甲烷为萃取剂,采用超声辅助分散液液微萃取结合气相色谱-离子阱质谱(gas chromatography-ion trap mass spectrometry, GC-IT/MS)测定红酒中的PAEs,回收率为85%~100.5%,富集倍数达到220~300倍,检出限为0.022 g/L。
对于水、酒等相对简单的样品,溶剂提取后可直接上样或浓缩后检测,但是对于复杂的食品样品,食品中的脂肪及色素可被提取剂同时萃取,会严重干扰仪器检测,需要进行净化处理以减小或消除基质干扰,并实现浓缩。除了传统的固相萃取(SPE)、固相微萃取(SPME)和凝胶渗透色谱(GPC)等净化技术之外,一些新型的样品前处理技术也有应用与尝试。
SPE是目前PAEs净化常见的一种方式,根据分析样品基质差异,N-丙基乙二胺键合硅胶玻璃柱(ProElut PSA)[12,13]、混合型阴离子交换(MAX)[14]、中性氧化铝柱[15]、硅胶柱[16]、C18[17,18]等固相萃取吸附剂均有应用。李拥军等[16]采用硅胶柱净化分析罗非鱼样品中PAEs,净化效果较好,基质干扰小,回收率为75%~107.9%。当采用单一类型固相萃取柱净化效果不理想时,可采用混合填料、多级净化等模式改善。Wu等[19]采用SILICA/PSA玻璃固相萃取柱有效去除了食用油中油脂、色素、有机酸和酚类化合物等干扰,检测了食用油中的17种PAEs,回收率为78.3%~108.9%。张帆等[17]比较了单壁碳纳米管玻璃固相萃取小柱(SWCNTs)、PSA玻璃固相萃取小柱和C18玻璃固相萃取小柱对PAEs的净化效果,SWCNTs SPE对选取的6种PAEs的回收率范围为86.7%~114.6%, PSA SPE为77.9%~120.1%, C18 SPE为74.5%~104.8%。比较发现单壁碳纳米管固相萃取净化油样品,净化效果不亚于商业吸附剂。
SPME是集采样、萃取、浓缩和进样于一体的无溶剂样品微萃取技术,在食品中PAEs化合物的分析中得到较广泛应用。Carrillo等[20]比较了顶空固相微萃取(HS-SPME)的聚乙二醇-二乙烯基苯(CW-DVB)、聚丙烯酸酯(PA)和聚二甲氧基硅烷-二乙烯基苯(PDMS-DVB)3种纤维萃取头的萃取效果,发现CW-DVB和PDMS-DVB均可有效提取红酒中的PAEs,检出限为35 ng/L。Li等[21]采用多壁碳纳米管-硅涂层实现了对饮料和酒中塑化剂的快速分析,回收率为68%~115%。Ye等[22]采用杯芳烃涂层的SPME实现了啤酒中PAEs的富集,8种PAEs的检出限为0.003~3.429 g/L。
GPC技术已广泛用于去除油脂样品中的脂质和色素等干扰物,油样直接用流动相稀释后经GPC净化、浓缩后检测[23],二氯甲烷-环己烷、乙酸乙酯-环己烷是常用的流动相,但是在PAEs类化合物检测中最主要的问题是控制调整馏分切割起止时间,其会影响油脂、色素等成分的去除及目标化合物的收集效果,所以必须根据实际样品选择最佳的截取时间[24]。
为简化操作流程、节约溶剂、提高通量,基质固相分散(MSPD)、分散固相萃取(DSPE)、QuEChERS等前处理技术在PAEs分析中也有报道。杨悠悠等[5]采用无水MgSO4和PSA基质分散净化牛奶样品,可显著降低基质的干扰、提高结果准确度,方法回收率为60%~110%。王明林等[25]采用弗罗里硅土-石墨化炭黑为基质分散剂和净化剂、乙酸乙酯为淋洗剂的基质固相分散样品前处理方法,较好地提取了蔬菜样品中的5种PAEs,回收率为76%~90%,检出限为0.01~0.024 mg/kg。邓莉等[26]采用PSA材料分散固相萃取(DSPE),有效消除了油、罐头食品共萃取物中脂肪酸、有机酸、极性色素及糖类等的干扰,回收率为78%~113%,检出限为0.03~0.5 mg/L。孙欣等[27]采用QuEChERS技术实现了黄瓜中PAE的提取净化,回收率为63.3%~127.8%,检出限为0.2~3.5 μg/kg。
2 分析方法
2.1 气相色谱及气相色谱-质谱联用技术
PAEs是弱极性化合物,其沸点在180~500 ℃,适合GC分离分析。GC具有效率高、分离效果好、分离能力强等特点,是PAEs定性、定量首选的检测手段,应用最为广泛。
分离PAEs最常用的是DB-5类型的毛细管色谱柱,大多数PAEs能够较好地分离,满足分析要求,但是对于碳原子数较多的异构体化合物(如DINP和DIDP)分离效果差,峰形重叠,呈五指峰形,检出限高,影响准确的定性和定量[15]。王美飞等[28]发现采用不同上样溶剂,PAEs在GC-FID上的响应有显著差异,甲醇作溶剂时,目标化合物的响应值偏小、峰形不对称、进样重复性差,对定量结果影响较大;而采用弱极性和非极性溶剂,如正己烷、乙酸乙酯、丙酮、二氯甲烷等,能够提高样品测定的精密度和准确度。因为FID检测中主要靠色谱保留时间定性,对于复杂食品基体,可能存在杂质干扰、分离度不理想等问题而导致假阳性结果,因此近年来质谱检测器的应用越来越普遍。2008年,我国颁布食品中16种PAEs残留检测的国家标准(GB/T 21911-2008), GC-MS选择离子扫描(SIM)检测,不含油脂样品采用正己烷提取,检出限为0.05 mg/kg;含油脂样品采用GPC净化,检出限为1.5 mg/kg[29]。
因为部分PAEs化合物的离子峰相同,且存在较严重的基质干扰,定性对色谱分离的要求依然较高,而二级质谱则能够进一步提高定性、定量的准确度与灵敏度。Cavaliere等[30]比较了GPC净化橄榄油样品几种分析方法的检测结果,EI-GC-MS检测DMP的LOD为68 μg/kg, EI-GC-MS/MS则为0.1 μg/kg,可见MS/MS检测的灵敏度显著提高;同时比较了EI源和化学电离(CI)源对PAEs响应的差异,EI源的定量重复性为3.0%~9.7%,而CI源为3.2%~64.4%,表明EI源稳定性更佳。
Ye等[22]建立了SPME-GC联用方法检测啤酒中的PAEs,回收率为86.3%~109.3%,检出限可达0.003~3.429 μg/L,操作简单,溶剂用量少。
GC-MS分析中,外标法因为受目标物提取与净化过程损失、分离与检测条件(柱温、柱效、检测器响应、基质效应)等影响较大,在多组分PAEs分析中应用较少,内标法的应用更加普遍。Guo等[14]以己二酸二丁酯作内标分析了火腿肉中的PAEs,方法回收率为87.3%~108%,重复性为3.6%~8.2%。为了进一步提高方法的准确度,Carrillo等[31]首次采用HS-SPME GC-MS同位素内标法测定酒中的6种PAEs,回收率介于72%~121%之间,大部分都在100%左右,相比非同位素定量方法的回收率64%~135%[20],有了显著的改善。Ierapetritis等[15]采用SPE净化样品,建立了植物油中PAE的同位素内标定量方法,LOD达7~10 ng/g。我们[7]采用对应的16种同位素标记物,建立了白酒中16种PAEs的同位素稀释气相色谱-三重四极杆串联质谱( isotope-dilution coupled with gas chromatography-tandem mass spectrometry, GC-IDMS/MS)的MRM模式定量方法。外标校准曲线法测定16种PAEs的回收率为80.8%~128.6%,相对标准偏差为1.1%~12.9%。同位素内标法回收率范围为94.3%~105.3%,相对标准偏差低于6.5%,同位素内标法提高了定量结果的准确性。同时,对于色谱分离度不佳的邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸二己酯(DHXP)两个化合物,文献检测均采用m/z149/65离子对定量,我们选择m/z206/149检测BBP,m/z251/149检测DHXP,可实现两者基线分离,检出限为0.1~10.0 ng/g。因此,同样的实验条件下,同位素内标定量方法可以校正前处理过程的损失,在基体的痕量成分测定中较外标法的灵敏度更高,特异性更强,精密度更好。若实验条件许可,同位素内标法更适合复杂基体痕量成分的准确定量分析。
表2给出了食品中PAEs测定的样品前处理方法及分析方法。
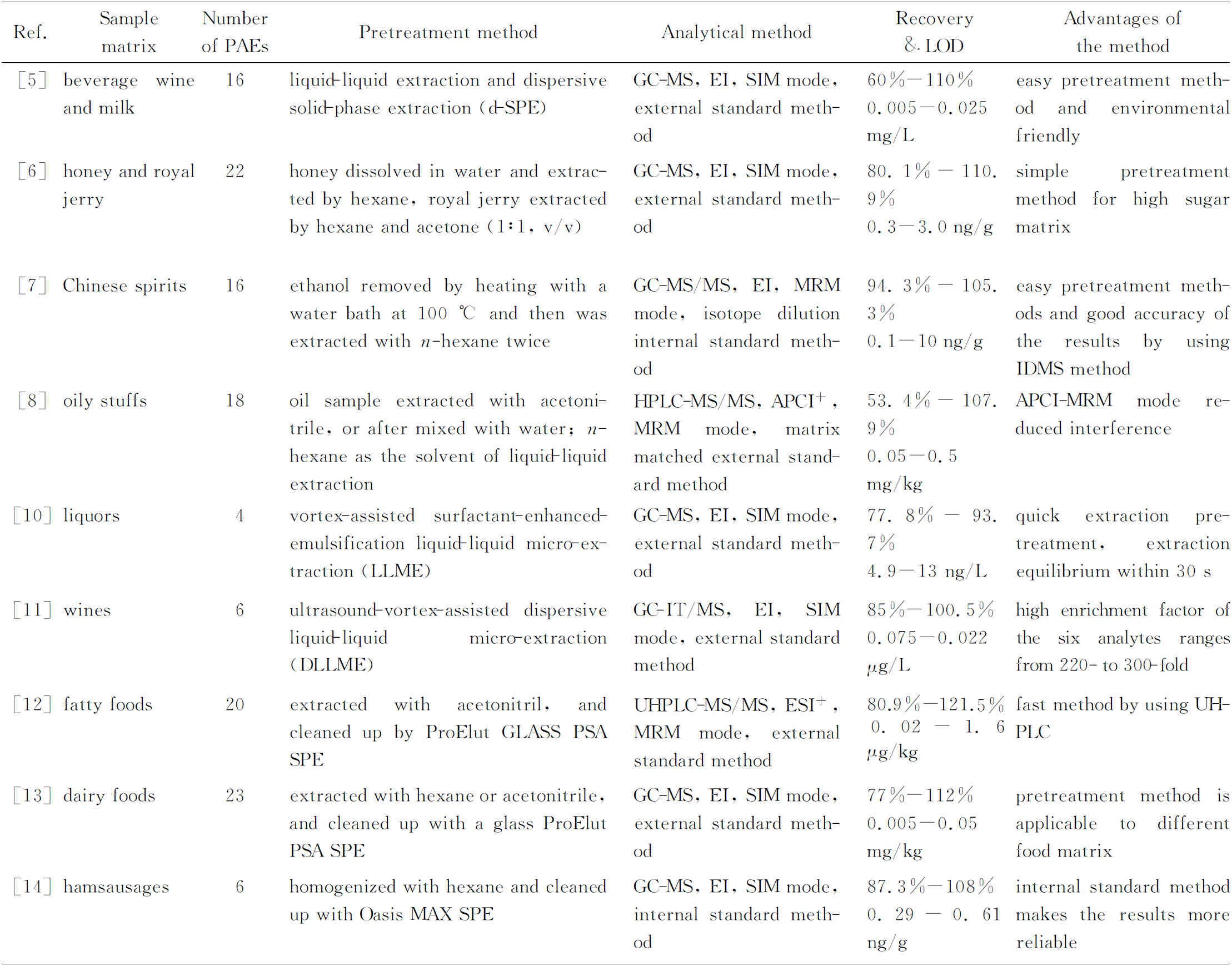
表2 用于食品中邻苯二甲酸酯类化合物分析的前处理方法及分析方法
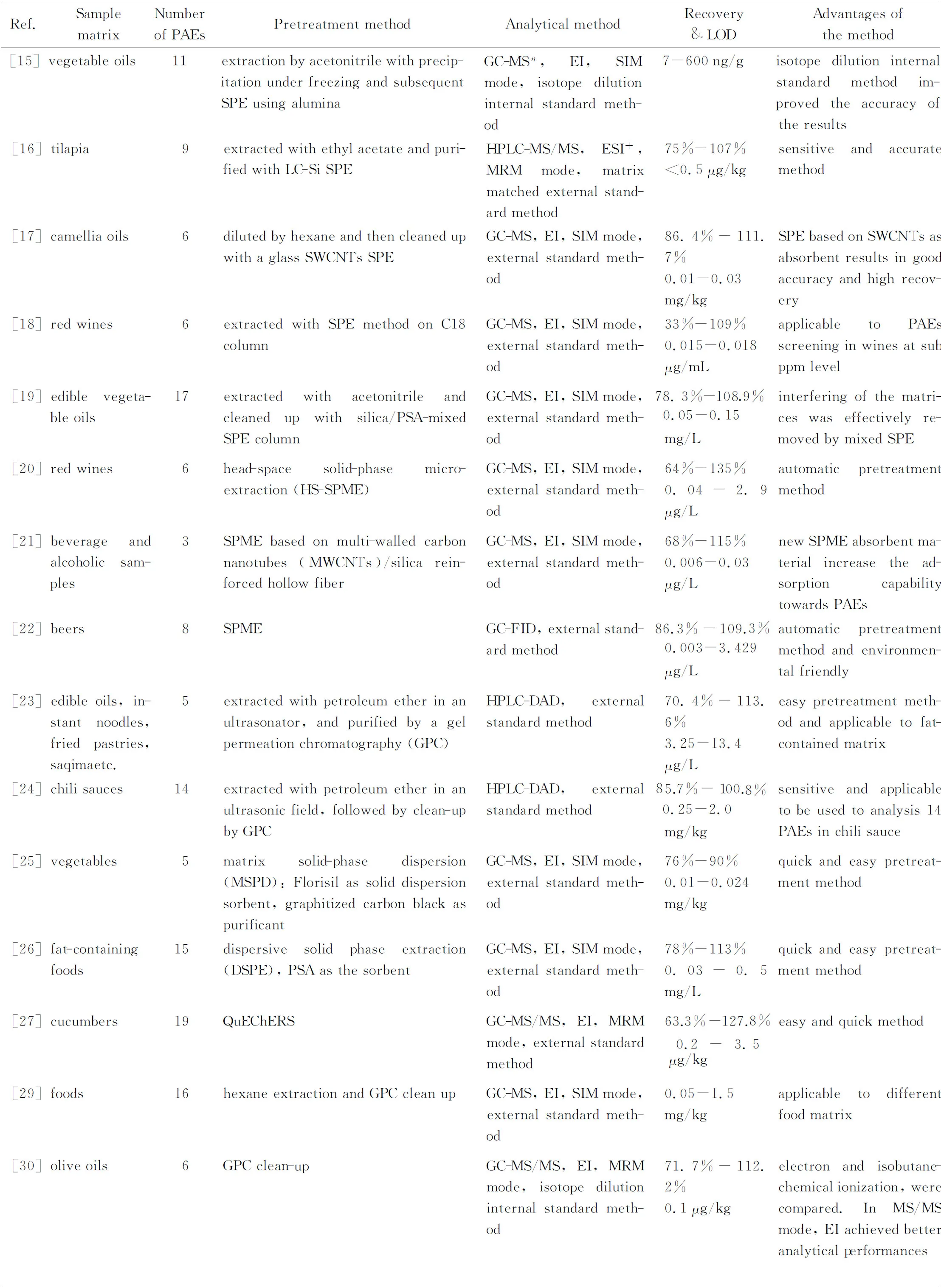
表2 (续)
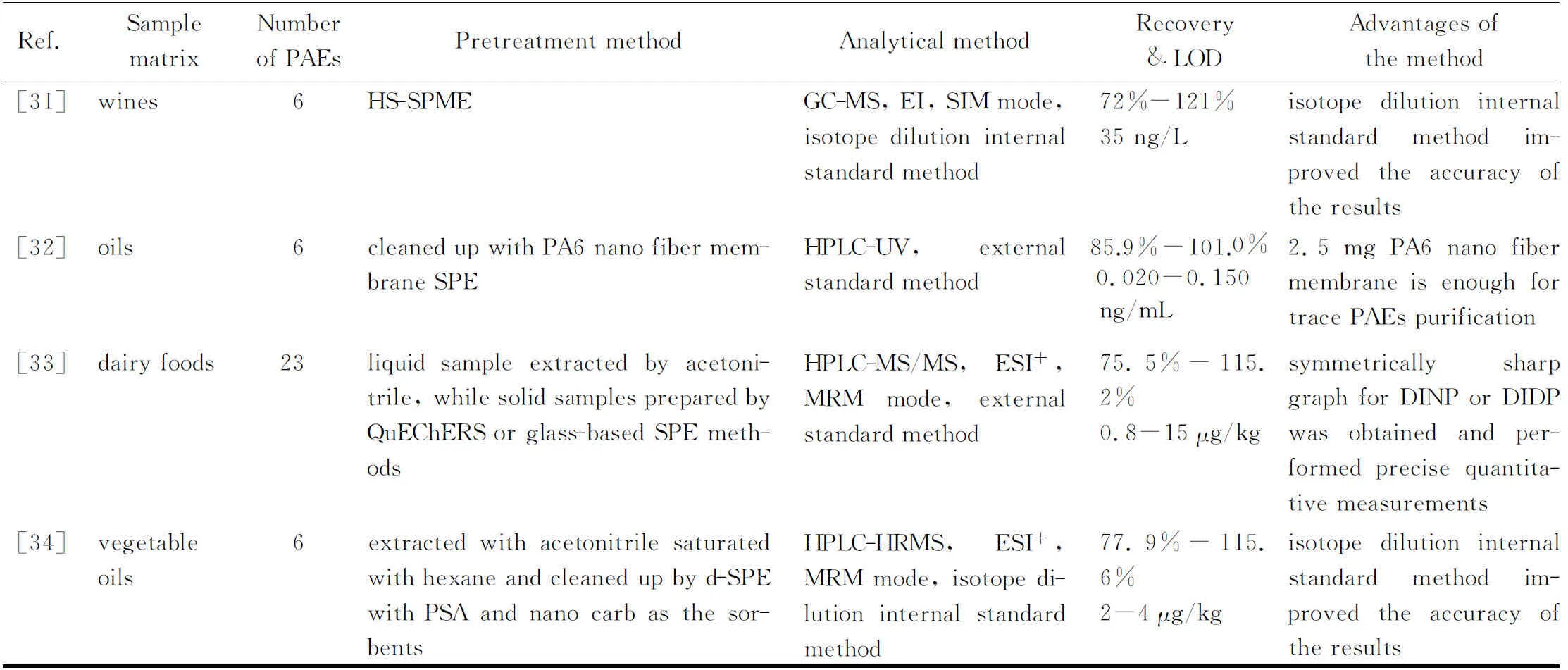
表2 (续)
IDMS: isotope dilution mass spectrometry; APCI: atmospheric pressure chemical ionization; IT: ion trap; UHPLC: ultra high performance liquid chromatography; SWCNTs: single-wall carbon nanotubes; DAD: diode array detector; HRMS: high resolution mass spectrometry.
2.2 液相色谱和液相色谱-质谱联用技术
与气相色谱法相比,液相色谱法在PAEs的同分异构体的分离及定量分析中更具有优势,通过选择合适的HPLC流动相组成及梯度洗脱条件,可以实现气相色谱分离中五指峰DINP和DIDP形成单峰分离检测,同时可以有效提高质谱的离子化效率,分析速度快,灵敏度高,适合于复杂基体中PAEs的准确定量。
曹阳等[32]考察了HPLC二极管阵列检测器(DAD)检测PAEs的3个特征吸收峰(198、224、272 nm),发现198 nm处吸收强度最大但杂质干扰较多,综合考虑选择224 nm波长进行测定。Fan等[12]采用SPE-UHPLC-MS/MS测定油脂食品中的20种PAEs, 7 min内测定了油脂食品中的20种PAEs,检出限可达0.02 μg/kg。且在ESI+模式下,通过选用不同的[M+H]+母离子产生的定量离子对,克服了GC-MS检测异构体PAEs时均采用m/z149或m/z149/65的定量离子的缺点,实现了一些不同的烷基取代难分离异构体的检测。
李拥军等[16]建立了SPE-LC-MS/MS测定水产品中PAEs的方法,通过比较乙腈、甲醇有机相及添加甲酸、乙酸铵的水相的不同流动相组合,选择0.1%的甲酸水溶液(含5 mmol/L乙酸铵)-甲醇溶液作为流动相,采用梯度洗脱,9种PAEs在13 min内达到理想的分离效果。由于水产品基质复杂,采用MRM特征离子对进行定性和定量,大大减少了干扰,提高了检测灵敏度,同时选用基质匹配的校准溶液进行定量分析,保证了准确性。
祝伟霞等[8]采用LC-APCI-MS/MS测定食品中的PAEs,发现ESI离子化效率与灵敏度均高于APCI,但ESI基质抑制现象明显,与标准溶液响应强度相比,信号响应减少至约1/5,而APCI基质抑制效应小。同时,与GC-MS分析DINP和DIDP灵敏度低(得到一组五指峰群)相比,LC-APCI-MS/MS测定DINP和DIDP时,均能获得峰形对称的单峰,提高了检测灵敏度。Xu等[33]采用C18色谱柱、甲醇-0.1%甲酸水为流动相的LC-ESI-MS/MS方法,也实现了DINP和DIDP的对称尖峰分离,同时实现了对这两类同分异构体的准确定量,检出限小于15 μg/kg。
陈达炜等[34]采用高效液相色谱-四极杆/静电场轨道阱高分辨质谱建立了PSA与Nano Carb混合填料的分散固相萃取快速分析植物油中16种PAEs的检测方法,并比较了UPLC BEH C18和UPLC BEH Phenyl两种色谱柱对于邻苯二甲酸酯的分析效果。由于邻苯二甲酸酯结构中有苯环,Phenyl柱比C18柱具有更好的保留行为,更为适合邻苯二甲酸酯的分析。该研究采用高分辨质谱的精确相对分子质量进行定性,同位素稀释质谱法定量,16种PAEs的平均回收率为77.9%~115.6%,相对标准偏差为0.3%~8.9%。
王晓兵等[35]采用LTQ-Orbitrap高分辨质谱仪结合全自动筛选软件,通过精确相对分子质量、离子阱多级碎片的结构信息、保留时间,建立了PAEs的筛查和确证方法,有效地去除了基体干扰,并在一定程度上降低了对色谱分离的要求。高分辨质谱能够在缺乏标准品或标准物质的情况下,最大限度地提高鉴别能力,有效提高未知物的鉴别效率。
由于PAEs广泛存在于塑料和有机溶剂中,而液相色谱系统中某些组成部分使用的是塑料管路,这些管路会溶出PAEs。采用液相色谱分析PAEs,背景PAEs污染的控制对降低假阳性、提高方法准确度至为重要。张海婧等[36]在液相色谱仪的溶剂混合器和进样器中间安装捕集柱,用于富集流动相中的PAEs,延迟其出峰时间,从而与样品中的目标峰区分。同时将样品瓶盖塑料部分换成锡箔纸封口,液相系统接触流动相的塑料管路更换为PEEK材料,可有效降低体系的环境干扰。
2.3 其他分析方法
毛细管电泳(CE)是电泳技术与色谱技术的结合,它具有高柱效、高选择性、分析速度快、进样量少等优点。李海燕等[37]建立了CE测定水中的5种不同PAEs的方法,水样过滤后可直接进行分析,回收率在104.8%~108.9%之间。
Zhang等[38,39]以辣根过氧化物酶为标记物,建立了直接竞争酶联免疫分析测定PAEs的方法,水及液态食品检测的最优LOD为0.03 ng/mL,回收率为96.6%~112.4%,交叉反应小于10%。同时,他们[40]还以4-氨基邻苯二甲酸二甲酯(DMAP)半抗原重氮化反应结合BSA制备多克隆抗体,建立了间接竞争酶联免疫分析法,快速测定饮料、奶、茶等食品中的邻苯二甲酸二乙酯(DEP),检出限为0.004 9 ng/mL,与类似物的交叉反应小于9%。另外,通过PAEs单克隆抗体的制备,可提高PAEs快筛检测的准确性,减少假阳性,这是未来PAEs免疫方法研究的热点方向。
彭丽英等[41]以丙酮作为掺杂剂,建立了白酒中痕量PAEs快速筛查的离子迁移谱方法(IMS),并采用离子阱质谱对检测结果进行了验证,单个样品的分析周期小于95 s,适于大量白酒样品中PAEs的快速筛查。
3 展望
随着人们对环境、原料与工艺、水等残留PAEs迁移进入食品中的认识及安全评估的持续开展,对检测效率和准确度的要求也越来越高。目前,串联质谱、高分辨质谱等应用越来越广泛,明显提高了检测灵敏度、降低了基质干扰,也在一定程度上降低了对样品前处理和分离的要求,但因为塑化剂通常为多组分同时检测,化合物种类多,同时又存在异构体等性质非常接近的化合物,因此高效的提取与前处理技术的发展必不可少;针对不同食品基体和化合物的特性,多种溶剂提取、新型高特异性的净化材料及混合材料的开发应用,提高复杂基体中化合物的提取、净化和富集效率是最主要的发展方向之一;适合于现场检测的试剂盒和试纸条、便携式快速检测仪器技术等,作为色谱、质谱等方法的补充,具有广阔的现实需求。另外,食用油、奶粉等复杂食品基质中多组分痕量PAEs有证标准物质的研制,满足方法准确度验证需求,对于促进检测新技术开发具有重要的基础作用。
[1] Tyl R W, Myers C B, Marr M C, et al. Reprod Toxicol, 2004, 18: 241
[2] Wine R N, Li L H, Barnes L H, et al. Environ Health Perspect, 1997, 105: 102
[3] US Department of Health and Human Services. National Toxicology Program (NTP) Technical Report Series No. 217, 1982
[4] Kamrin M A. J Toxicol Environ Health, 2009, 12: 157
[5] Yang Y Y, Xie Y F, Tian F F, et al. Chinese Journal of Chromatography (杨悠悠, 谢云峰, 田菲菲, 等. 色谱), 2013, 31(7): 674
[6] Zhou J H, Qi Y T, Wu H M, et al. J Sep Sci, 2014, 37: 650
[7] Wang J, Li X M, Zhang Q H, et al. J Sep Sci, 2015, 38: 1700
[8] Zhu W X, Yang J Z, Yuan P, et al. Modern Food Science and Technology (祝伟霞, 杨冀州, 袁萍, 等. 现代食品科技), 2012, 28(1): 115
[9] Rezaee M, Assadi Y, Hosseini M M, et al. J Chromatogr A, 2006, 1116(1/2): 1
[10] Leng G, Chen W J, Zhang M F, et al. J Sep Sci, 2014, 37: 684
[11] Cinelli G, Avino P, Notardonato I, et al. Anal Chim Acta, 2013, 769: 72
[12] Fan J C, Wu L, Wang X F, et al. Anal Methods, 2012, 4: 4168
[13] Zheng X H, Lin L Y, Fang E H, et al. Chinese Journal of Chromatography (郑向华, 林立毅, 方恩华, 等. 色谱), 2012, 30(1): 27
[14] Guo Z Y, Wang S, Wei D Y, et al. Meat Sci, 2010, 84: 484
[15] Ierapetritis I, Lioupis A, Lampi E. Food Anal Methods, 2014, 7: 1451
[16] Li Y J, Xiong W M, Chen J W, et al. Journal of Instrumental Analysis (李拥军, 熊文明, 陈坚文, 等. 分析测试学报), 2012, 31(3): 278
[17] Zhang F, Li Z H, Zhang Y, et al. Chinese Journal of Chromatography (张帆, 李忠海, 张莹, 等. 色谱), 2014, 32(7): 735
[18] Del Carlo M, Pepe A, Sacchetti G, et al. Food Chem, 2008, 111: 771
[19] Wu P, Yang D, Zhang L, et al. J Sep Sci, 2012, 35(21): 2932
[20] Carrillo J D, Salazar C, Moreta C, et al. J Chromatogr A, 2007, 1164: 248
[21] Li J, Su Q, Li K Y, et al. Food Chem, 2013, 141: 3714
[22] Ye C W, Gao J, Yang C, et al. Anal Chim Acta, 2009, 641: 64
[23] Zhang C Y, Wang H, Zhang X H, et al. Chinese Journal of Chromatography (张春雨, 王辉, 张晓辉, 等. 色谱), 2011, 29(12): 1236
[24] Zhang H J, Zhang J X, Li H, et al. Food Science (张会军, 张敬轩, 李挥, 等. 食品科学), 2011, 32(4): 152
[25] Wang M L, Kou L J, Zhang Y Q, et al. Chinese Journal of Chromatography (王明林, 寇丽娟, 张玉倩, 等. 色谱), 2007, 25(4): 577
[26] Deng L, Hao X C. Chinese Journal of Analytical Chemistry (邓莉, 郝学财. 分析化学), 2013, 41(7): 1037
[27] Sun X, Qi L, Qin Y T, et al. Chinese Journal of Chromatography (孙欣, 齐莉, 秦延亭, 等. 色谱), 2014, 32(11): 1260
[28] Wang M F, Hu E Y, Yang L L, et al. Chemical Analysis and Meterage (王美飞, 胡恩宇, 杨丽莉, 等. 化学分析计量), 2015, 24(1): 94
[29] GB/T 21911-2008
[30] Cavaliere B, Macchione B, Sindona G, et al. J Chromatogr A, 2008, 1205: 137
[31] Carrillo J D, Martínez M P, Tena M T. J Chromatogr A, 2008, 1181: 125
[32] Cao Y, Yin X Y, Zhou F Q, et al. Chinese Journal of Analytical Chemistry (曹阳, 殷雪琰, 周方晴, 等. 分析化学), 2013, 41(12): 1837
[33] Xu D M, Deng X J, Fang E H, et al. J Chromatogr A, 2014, 1324: 49
[34] Chen D W, Zhao X X, Zhao Y F, et al. Journal of Food Safety and Quality (陈达炜, 赵晓雪, 赵云峰, 等. 食品安全质量检测学报), 2014, 5(9): 2640
[35] Wang X B, Ding L, Zhu S H, et al. Packaging Engineering (王晓兵, 丁利, 朱绍华, 等. 包装工程), 2011, 32(15): 43
[36] Zhang H J, Hu X J, Lin S B. Chinese Journal of Analytical Chemistry (张海婧, 胡小键, 林少彬. 分析化学), 2014, 42(9): 1281
[37] Li H Y, Shi Y T, Zeng Q F. Industrial Water Treatment (李海燕, 施银桃, 曾庆福. 工业水处理), 2004, 24(8): 55
[38] Zhang M C, Cong Y, Sheng Y L, et al. Anal Biochem, 2011, 406(1): 24
[39] Zhang M C, Wang Y, Yu X N, et al. Food Agr Immunol, 2014, 25(2): 229
[40] Zhang M C, Yu X N, Wang Y, et al. Food Anal Methods, 2013, 6(4): 1223
[41] Peng L Y, Wang W G, Wang X, et al. Chinese Journal of Analytical Chemistry (彭丽英, 王卫国, 王新, 等. 分析化学), 2014, 42(2): 287
2016年度《化学分析计量》杂志征订启事
全国各地邮局均可订阅 邮发代号24-138
《化学分析计量》是中国兵器工业集团第五三研究所(国防科技工业应用化学一级计量站)主办的全国性分析测试、化学计量专业技术刊物。主要报道分析测试、化学计量行业的技术、学术论文;标准物质的研制与应用;分析、计量仪器的研制、开发、检定、维修经验;相关专业的法规、政策、标准,管理经验,技术发展动态,综述和技术经济信息等。主要栏目有分析测试、仪器设备、标准物质、计量管理、不确定度、经验交流、综述、讲座、企业风采、市场动态、简讯、广告等。
《化学分析计量》是中国科技核心期刊,美国《化学文摘》(CA)千种表收录期刊,中国学术期刊综合评价数据库统计源期刊,中国石油和化工行业优秀期刊,山东省优秀期刊,荣获多项项省部委级优秀期刊奖。本刊特色为学术性和技术性相结合,报道及时,信息容量大,涵盖面广。
《化学分析计量》为双月刊,大16开本,单月20日出版,2016年全年定价共90元。公开发行,国内邮局发行代号24-138,中国国际图书贸易总公司办理国外订阅,国外发行代号4794 BM,同时杂志社自办发行业务。
本刊自创刊号以来至2015年共计24卷109期的合订本光盘已公开发售,利用该合订本光盘,既可按作者、文题、关键词、年、期等分类查阅本刊已发表的所有科技文章和科技信息的全文,又可根据读者自定义的关键词进行全文检索,方便、实用。该合订本光盘优惠价200元。
欢迎广大读者到当地邮政局(所)办理订阅手续,漏订或订阅合订本光盘及过期刊物的读者可直接向杂志社订阅。
邮局汇款 银行汇款
地 址:济南市108信箱杂志社 户 名:山东非金属材料研究所
邮 编:250031 开户银行:济南市工商银行经十一路支行
电 话:0531-85878132, 85878223, 85878278 帐 号:1602001229014425546
传 真:0531-85947355 网 址:www.cam1992.com
电子信箱:anameter@126.com
化学分析计量编辑部 供稿
Advances on the development of detection methods for the phthalate esters in food
LI Xiaomin1, WANG Jing1,2, ZHANG Qinghe1*, LI Hongmei1
(1.DivisionofChemicalMetrologyandAnalyticalScience,NationalInstituteofMetrology,Beijing100029,China; 2.PolytechInstrument,Beijing100095,China)
Phthalate esters are most widely used as plasticizers which have toxicity and carcinogenicity. Phthalate esters are found as contaminants in many food products and they are a branch of compounds, homologues and isomers, which present similar structures and properties. And the residue contents vary a lot in different matrices. Efficient sample pretreatment, highly selective separation mode, sensitive detection methods as well as reducing background interference are challenges for their determination in complex samples. In this paper, some sample pretreatment methods such as liquid-liquid extraction, liquid-liquid micro-extraction, solid phase extraction, solid phase micro-extraction, matrix solid-phase extraction and other traditional and new types of extraction and purification technology applied in the food samples are reviewed. The characteristics of analytical methods including gas chromatography, liquid chromatography, tandem mass spectrometry, high resolution mass spectrometry, enzyme-linked immunoassay, and ion mobility spectrometry are also discussed.
phthalate esters; food; sample pretreatment; analytical methods
10.3724/SP.J.1123.2015.06027
科技部科学仪器开发重大专项项目(2012YQ09016703).
2015-06-17
O658
:A
:1000-8713(2015)11-1147-08
特殊选择性分离介质的制备专栏·专论与综述
*通讯联系人.E-mail:zhangqh@nim.ac.cn.
