新型萘酰亚胺类衍生物8c诱导结肠癌耐药细胞HCT116/L-OHP凋亡作用研究
2015-01-04
上海中医药大学附属普陀医院实验中心,上海中医药大学中西医结合肿瘤介入研究所,上海200062
新型萘酰亚胺类衍生物8c诱导结肠癌耐药细胞HCT116/L-OHP凋亡作用研究
王子元,殷佩浩,许建华,季青,倪振华,孙健,马艳春
上海中医药大学附属普陀医院实验中心,上海中医药大学中西医结合肿瘤介入研究所,上海200062
背景与目的:细胞凋亡受阻是肿瘤细胞产生耐药的重要因素,从细胞凋亡的研究入手,将为肿瘤的治疗和耐药性的逆转开辟新的途径。本研究观察一种新型萘酰亚胺类衍生物8c对结肠癌HCT116/L-OHP耐药细胞的作用,探讨诱导HCT116/L-OHP耐药细胞凋亡的分子机制。方法:采用CCK-8法检测8c对HCT116/ L-OHP细胞的增殖抑制作用;采用流式细胞术观察8c对HCT116/L-OHP细胞凋亡的影响;采用实时定量PCR(realtime PCR)检测p53 mRNA、Bax mRNA及Bcl-2 mRNA水平变化;蛋白[质]印迹法(Western blot)检测p-p53、Bax、Bcl-2及细胞色素c(Cyt-c)的蛋白表达水平。结果:8c抑制HCT116/L-OHP细胞增殖的半数抑制浓度(IC50=8.16 µmol/L)低于阳性对照氨奈菲特(IC50=28.37 µmol/L);药物作用后,8c诱导耐药细胞产生凋亡,凋亡通路中p53(Ser15)磷酸化水平上升,但p53 mRNA水平不受影响;Bax蛋白水平及mRNA水平明显上升,Bcl-2蛋白及mRNA水平下降,使得Bax/Bcl-2比例增加,同时8c又引起细胞色素c的释放。结论:8c通过磷酸化p53 Ser-15位点激活p53,随即激活细胞凋亡通路相关蛋白的表达,这可能是8c抑制结肠癌HCT116/L-OHP耐药细胞增殖的重要机制之一。8c具有良好的抗肿瘤及抗耐药潜力和开发应用前景。
萘酰亚胺类衍生物;结肠癌;凋亡
结肠癌是一种常见的消化道恶性肿瘤,其发病率仅次于肺癌和胃癌[1]。以奥沙利铂(oxaliplatin,L-OHP)、长春新碱(vincristine,VCR)等为基础的术后辅助化疗已成为结肠癌患者的一线治疗方案。然而,肿瘤细胞的异质性及对化疗药物的耐药性,使化疗的临床效果受到不同程度的限制[2-4]。近几年,细胞凋亡与多药耐药及肿瘤细胞的抗药性的关系日益受到关注。有研究[5]发现,抑制凋亡与耐药的形成存在一定的关系。目前很多化合物或药物具有抗肿瘤作用,但都存在较强的不良反应和易引发耐受等不足。因此,筛选一种高效低毒的抗肿瘤药物就成了抗癌新药的研发首选,具有重要的经济效益和社会效益。
本研究前期合成了一系列萘酰亚胺类衍生物,发现其中一种化合物6-{2-[2-(二甲胺基)乙基胺基]乙基}-2-辛基-1H-苯并[de]异喹啉-1,3(2H)-二酮(8c)能明显抑制结肠癌耐药细胞生长。8c是在萘酰亚胺类topoⅡ抑制剂——氨奈菲特(amonafide)的基础上,通过在6位引入多氨链,2位引入长烷链(图1),从而有效缓解氨奈菲特的毒性,具有一定开发潜力[6]。
本研究在此基础上,研究8c对结肠癌耐药细胞HCT116/L-OHP的增殖影响作用,探讨8c诱导HCT116/L-OHP细胞凋亡作用的分子机制。目前国内外对于萘酰亚胺类化合物的抗肿瘤的分子机制凋亡研究报道较少,因此,本研究对于开发新的抗肿瘤药物有潜在的经济价值和广阔的开发前景。
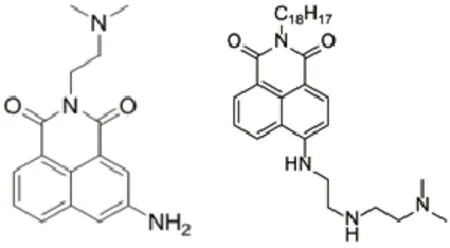
图1 氨奈菲特与8c化合物结构Fig. 1 Chemical structure of amonafide and 8c
1 材料和方法
1.1 实验材料
化合物8c由华东理工大学钱旭红教授课题组合成并提供,纯度>99.5%,可用于后续实验;HCT116/L-OHP耐奥沙利铂HCT116耐药细胞由本院实验中心诱导,培养于含10%小牛血清的RPMI-1640培养基中(含有100 U/mL的青霉素和100 µg/mL的链霉素),并置于37 ℃、CO2体积分数为5%的培养箱中培养。为了获得耐药株HCT116/L-OHP的多药耐药表型,L-OHP (终浓度为5 µg/mL)始终加在HCT116/L-OHP细胞的培养基中,实验前1周停止加药。小牛血清、培养基均购自美国Gibco公司。p-p53、Bax、Bcl-2和Cyt-c抗体购自美国Santa Cruz公司。CCK-8试剂盒、Hoechst33258和碘化丙啶(propidium iodide,PI)染料购自美国Sigma公司,Annexin-Ⅴ/FITC试剂盒购自上海美季生物医药科技有限公司,其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 CCK-8比色法检测细胞增殖活性
收集对数生长期细胞,以1×104个/mL接种于96孔培养板,置于CO2体积分数为5%、37 ℃恒温培养箱中温育24 h后,加入不同浓度的化合物,以不含化合物的培养细胞为空白对照组,以含DMSO的培养细胞为阴性对照,以含氨奈菲特的培养细胞为阳性对照,每孔设3个复孔,同时设不含细胞和不做任何处理的培养基3个孔消除背景干扰。共同温育48 h后,于培养结束前4 h加入CCK-8(10 µL/孔),使每孔总体积为100 µL,用酶标仪检测吸光度(D)值,检测波长450~490 nm,参比波长600~650 nm,分析数据。按以下公式计算细胞存活率,然后绘制成图表,细胞存活率为50%的值为半数抑制浓度(IC50)。细胞存活率(%)=(D试验组-D空白组)/(D对照组-D空白组)×100%。
1.2.2 LDH法(乳酸脱氢酶法)检测细胞活力
收集对数生长期细胞置于24孔板中,每孔细胞浓度为2×105个/mL,置于CO2体积分数为5%、37 ℃的恒温培养箱中培养,加入不同浓度的化合物,同时以氨奈菲特为阳性对照药,培养48 h后,上清液按照LDH试剂盒说明操作;沉淀细胞分别加1 mL终浓度为0.2%的TritonX-100裂解液37 ℃避光振荡15 min后按照LDH试剂盒说明操作[7]。
1.2.3 Hoechst染色检测药物对HCT116/L-OHP细胞形态学的影响
将处于对数生长期细胞(2×105个/mL)接种于24孔板,加入不同浓度8c,以氨奈菲特为阳性对照药,空白对照组加入等体积的培养液。处理48 h后离心,弃上清液,用PBS洗2次,离心去上清液(370×g,5 min)。加固定液(甲醇∶乙酸=3∶1),4 ℃固定10 min。采用Hoechst33258(5 μL/mL)染色5 min。356 nm紫外激发,荧光显微镜下观察并拍照。
1.2.4 流式细胞术检测药物对细胞凋亡的影响
采用Annexin Ⅴ-FITC/PI双染法细胞凋亡检测试剂盒(Promega)进行凋亡诱导检测。严格按照试剂商提供指南进行操作,简述如下:以氨奈菲特为阳性对照药,8c作用细胞48 h后,重悬于Annexin Ⅴ-FITC结合液(1×)中,加入5 μL Annexin Ⅴ-FITC,轻轻混匀,室温避光温育10 min,1 000×g离心5 min,弃上清液,加入195 μL Annexin Ⅴ-FITC结合液(1×)轻轻重悬细胞,加入10 μL碘化丙啶染色液,轻轻混匀,冰浴中避光放置10 min;用FACS流式细胞仪检测样品,Cell Quest软件(Becton)及Modifit软件并分析数据。
1.2.5 反转录PCR(reverse transcription PCR,RT-PCR)和实时定量PCR(real-time PCR)检测
利用Total RNA Isolation试剂盒(Qiagen)提取总RNA,测定浓度并检测RNA完整性,符合后续实验要求。利用Prime Script逆转录试剂盒[购自宝生物工程(大连)有限公司]将RNA逆转录为cDNA,按照试剂盒提供信息配置反应体系,反应条件如下:37 ℃ 15 min,85 ℃ 5 s。利用SYBR PrimeScript real-time PCR反应试剂盒[购自宝生物工程(大连)有限公司]进行realtime PCR反应,按照试剂盒提供信息配置反应体系,反应条件如下:95 ℃变性5 min,95 ℃15 s,55 ℃ 30 s和72 ℃ 30 s。以GAPDH作为内参,使用引物序列见表1。

表1 引物序列Tab. 1 Sequences of primers
1.2.6 蛋白[质]印迹法(Western blot)检测
药物作用后,细胞弃去培养基,冷PBS液冲洗2遍,采用细胞刮片收集细胞,用蛋白裂解液裂解细胞,冰浴30 min,15 294×g离心10 min,收集上清液,进行蛋白定量,制备好的蛋白样品置-80 ℃冰箱保存备用。每泳道以50 µg蛋白上样,经SDS-PAGE凝胶电泳,转至硝酸纤维膜。室温封闭3 h,加一抗,室温下温育2 h。再加辣根过氧化物酶标记二抗,室温下温育1 h,采用NBT/BCIP系统显色,记录结果并进行D值扫描分析,除以β-actin D值所得的比值,并进行统计学分析。
1.3 统计学处理
2 结 果
2.1 8c对结肠癌耐药细胞HCT116/L-OHP的生长抑制作用
CCK-8增殖实验结果显示,8c组细胞增殖受到明显抑制,随着浓度的增加,细胞的增殖数目下降,各浓度组与空白对照组比较,差异有统计学意义(P<0.05)。经Origin软件作图分析计算,48 h的IC50为8.16 μmol/L,阳性对照药物氨奈菲特对该细胞的IC50为28.37 μmol/L,8c的IC50较阳性对照药物明显偏小,且随剂量增大,呈现出一定的剂量依赖性(图2)。
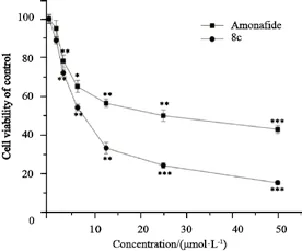
图2 8c和氨奈菲特对HCT116/L-OHP细胞存活率的影响Fig. 2 The effect of 8c and amonafide on the viability of HCT116/L-OHP cells.
2.2 8c对结肠癌耐药细胞HCT116/L-OHP LDH漏出率的影响
HCT116/L-OHP耐药细胞经不同浓度8c作用48 h后,LDH漏出率有不同程度的增加,并呈剂量依赖性。各组细胞LDH漏出率值见表2。
2.3 8c对结肠癌耐药细胞HCT116/L-OHP的形态学影响
结果如图3显示,空白对照组无明显形态学变化,所发荧光较均匀。与空白对照组相比,随着8c浓度的提高,凋亡特征越发明显,呈现出一定的剂量依赖性,呈现细胞核染色质浓缩、核碎裂以及出现凋亡小体等典型的细胞凋亡特征;提示8c能诱导细胞产生凋亡,与阳性对照药氨奈菲特相比,凋亡效果明显,可能是其抗肿瘤及抗耐药作用的重要分子机制。
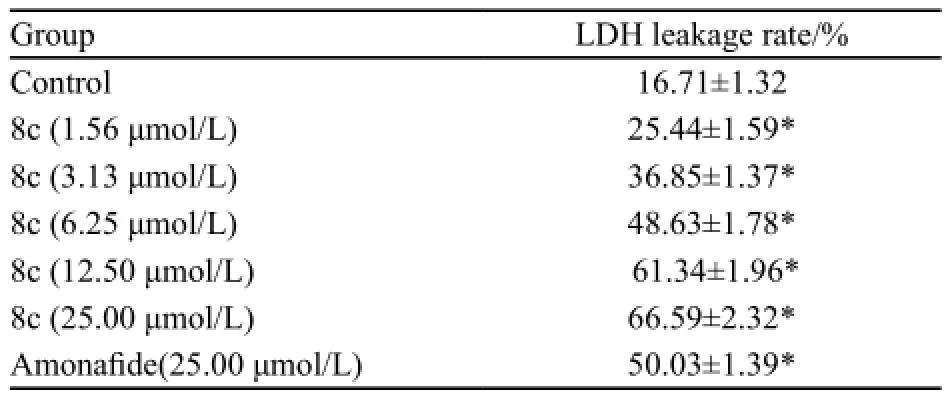
表2 8c对结肠癌耐药细胞HCT116/L-OHP LDH漏出率的影响Tab. 2 Effect of 8c on LDH leakage rate of HCT116/L-OHP cells
2.4 8c对结肠癌耐药细胞HCT116/L-OHP凋亡的影响
凋亡结果显示,药物作用48 h后,8c诱导耐药细胞产生凋亡,与对照组相比,差异有统计学意义(图4A,P<0.05)。总凋亡率随8c浓度升高而升高,呈现出良好的剂量依赖性且明显高于对照组。与8 μmol/L 8c作用HCT116/L-OHP细胞相比,8 μmol/L氨奈菲特作用该细胞后凋亡比率变化不大,25 μmol/L氨奈菲特作用后的总凋亡率与8 μmol/L 8c作用后的凋亡率基本一致(图4B),由此表明HCT116/L-OHP细胞对8c作用比氨奈菲特敏感。
2.5 8c对结肠癌耐药细胞HCT116/L-OHP中凋亡相关通路的影响
8c作用后,凋亡通路中p53(Ser-15)磷酸化水平和Bax蛋白表达水平呈浓度依赖性增加,Bcl-2蛋白表达水平降低,且8c诱导细胞色素C的释放(图5A)。阳性对照组氨奈菲特不影响p53(Ser-15)磷酸化水平,但Bax、Bcl-2及细胞色素C的表达趋势与8c一致。同时,real-time PCR检测结果显示,8c作用后,耐药细胞中Baχ的转录水平上升,Bcl-2转录水平下降,呈现出明显的剂量依赖性,与对照组相比,差异有统计学意义(P<0.05,图5B)。该结果与WB蛋白表达水平的结果相一致,然而,8c作用HCT116/L-OHP细胞后,没有影响p53 mRNA水平,阳性对照组氨奈菲特具有与8c相同的表达趋势。提示8c抗肿瘤活性可通过磷酸化Ser-15位点活化抑癌因子p53,同时Bax/Bcl-2比例的增加、细胞色素c的释放在8c诱导的HCT116/L-OHP细胞凋亡过程中起重要作用。
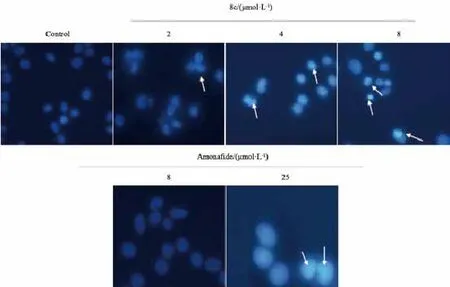
图3 Hoechst 33258荧光核染色法对8c和氨奈菲特作用的HCT116/L-OHP细胞进行核染色Fig. 3 Fluorescent staining of nuclei in 8c and amonafide-treated HCT116/L-OHP cells by Hoechst 33258
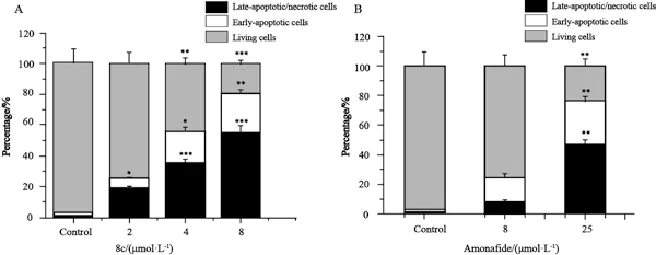
图4 Annexin V-FITC/PI双染后经流式细胞术分析8c及amonafide诱导的HCT116/L-OHP细胞凋亡作用Fig. 4 Flow cytometry analysis of 8c and amonafide induced apoptosis in HCT116/L-OHP cells using Annexin Ⅴ-FITC/PI
3 讨 论
结肠癌是人类高发恶性肿瘤,发病率在全球癌症中位居第3位,其死亡率居恶性肿瘤死因的第2位,而且其发病率呈上升趋势[8]。以L-OHP、长春新碱等为基础的术后辅助化疗已成为结肠癌患者的一线治疗,但化疗药物在抑制恶性肿瘤生长的同时,其较强的不良反应和易引发耐受等不足限制了其药理机制的研究及进一步的临床应用。因此,提高治疗的疗效和选择性,克服耐药是今后开发抗癌药物的主要目标。近几年,在治疗癌症的研究领域中,因萘酰亚胺类衍生物具有良好的抗肿瘤作用,已引起了国内外学者的广泛关注[9-10]。
本研究在此背景下,通过对氨奈菲特母体进行改造,设计、合成一系列萘酰亚胺类衍生物,从中筛选出化合物8c,低浓度即可抑制结肠癌HCT116/L-OHP细胞的增殖,半数抑制浓度为8.16 μmol/L,并围绕该化合物的抗癌效果,进行其药物作用机制的研究。通过Hoechst染色及Annexin Ⅴ-FITC/PI双染实验结果显示,细胞出现明显的凋亡现象。与对照组相比,4 μmol/L浓度可引起耐药细胞总凋亡率为56.35%,差异有统计学意义(P<0.05)。诱导肿瘤细胞凋亡,是近年众多化疗药物杀伤肿瘤细胞的共同目的[11],因此,凋亡受抑可能是肿瘤细胞产生耐药的机制之一[12-13]。明确有利于药物诱导凋亡的分子机制以及肿瘤是怎样逃避凋亡,可以解释癌症发生和治疗之间的联系,并且能够得到更合理的方法来设计抗癌药物和治疗癌症。分子机制研究显示,与阳性对照药氨奈菲特相比,8c能上调p53(Ser-15)磷酸化水平,但p53 mRNA水平无明显变化。而阳性药氨奈菲特对p53磷酸化水平没有影响,因此,8c可能是通过磷酸化p53 Ser-15位点激活p53,从而诱导细胞凋亡;同时,8c剂量依赖性地上调Bax的表达,下调Bcl-2的蛋白表达,使得Bax/Bcl-2比例增加,导致细胞色素c的释放,提示8c能激活凋亡通路。
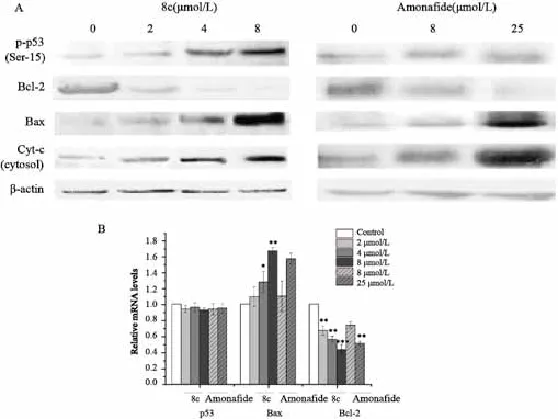
图5 8c及氨奈菲特对HCT116/L-OHP细胞凋亡相关蛋白及mRNA表达的影响Fig. 5 Effect of 8c and amonafide on the protein and mRNA expressions of apoptotic-related proteins
本研究发现新型萘酰亚胺类衍生物8c抗肿瘤作用具有抑制结肠癌耐药细胞多药耐药的能力,主要表现为8c诱导结肠癌耐药细胞凋亡,作用机制主要通过激活抑癌因子p53激活凋亡通路,从而抑制结肠癌耐药细胞HCT116/L-OHP的增殖。目前,萘酰亚胺类化合物抗肿瘤细胞多药耐药的药效药理学研究报道较少,本研究通过将一般抗肿瘤药物的研究方法用于衍生物8c,为其开发抗癌新药作理论积累和技术支持。此外,本研究阐明8c抗肿瘤的作用机制,以期发现8c抗肿瘤的作用靶点,为开发其他抗癌新药奠定理论基础。以该实验结果为基础,开发以新型萘酰亚胺类新药治疗耐药结肠癌,具有不可估量的经济和社会效益,可进一步设计相关临床课题,开展双盲、随机、对照研究及临床应用,以期更好的将基础研究结论转化为医学实践手段。
[1] SØRENSEN M, AUTRUP H, OLSEN A, et al. Raaschou-Nielsen O. Prospective study of NAT1 and NAT2 polymorphisms, tobacco smoking and meat consumption and risk of colorectal cancer[J]. Cancer Lett, 2008, 266 (2): 186-193.
[2] WANG G, ZHAO J, LIU J, et al. Enhancement of IL-2 and IFN-gamma expression and NK cells activity involved in the anti-tumor effect of ganoderic acid Me in vivo[J]. Int Immunopharmacol, 2007, 7(6): 864-870.
[3] XU K, LIANG X, GAO F, et al. Antimetastatic effect of ganoderic acid T in vitro through inhibition of cancer cell invasion[J]. Process Biochem, 2010, 45(8): 1261-1267.
[4] CHEN N H, ZHONG J J. Ganoderic acid Me induces G1 arrest in wild-type p53 human tumor cells while G1/S transition arrest in p53-null cells[J]. Process Biochem, 2009, 44(8): 928-933.
[5] RINDER H K, MIESKES T, LOSCHER T. Heteroresistance in mycobacterium tuberculosis[J]. Int J Tuberc Lung Dis, 2001, 5(4): 339-345.
[6] CHEN Z, LIANG X, ZHANG H, et al. A new class of naphthalimide-based antitumor agents that inhibit topoisomerase Ⅱ and induce lysosomal membrane permeabilization and apoptosis[J]. J Med Chem, 2010, 53(6): 2589-2600.
[7] GEORGE F, JOHN A. Timbrell. In vitro cytotoxicity assays: Comparison of LDH, neutral red, MTT and protein assay in hepatoma cell lines following exposure to cadmium chloride[J]. Toxicol Lett, 2006, 160(1): 171-177.
[8] PAULA M C, HAROLD F. The genetics of CRC[J]. Ann Intern Med, 2002, 137: 603-612.
[9] BERMAN H M, YOUNG P R. The interaction of intercalating drugs with nucleic acids[J]. Annu Rev Biophys Bioeng, 1981, 10: 87-114.
[10] WILSON W D, JONES R L. Intercalating drugs: DNA binding and molecular pharmacology[J]. Adv Pharmacol Chemother, 1981, 18: 177-222.
[11] FISHER D E. Apoptosis in cancer therapy: crossing the threshold[J]. Cell, 1994, 78(4): 539-542.
[12] HICKMAN J A. Apoptosis induced by anticancer drugs[J]. Cancer Metastasis Rev, 1992, 11(2): 121-139.
[13] HSU P C, HUNG H C, LIAO Y F, et al. Ornithine decarboxylase attenuates leukemic chemotherapy drugsinduced cell apoptosis and arrest in human promyelocytic HL-60 cells[J]. Leuk Res, 2008, 32(10): 1530-1540.
Research on the molecular mechanism of a novel naphthalimide derivative 8c inducing apoptosis in multidrug resistant colon cancer cells
WANG Ziyuan, YIN Peihao, XU Jianhua, JI Qing, NI Zhenhua, SUN Jian, MA Yanchun (Central Laboratory, Putuo Hospital, Shanghai University of Traditional Chinese Medicine; Interventional Cancer Institute of Chinese Integrative Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200062, China)
WANG Ziyuan E-mail: cjwzymerck@sina.com
Background and purpose:Suppression of apoptotic signaling pathways is an important factor in tumor cell resistance. Research on cell apoptosis will open up a new way of reversing drug resistance and tumor treatment. This study examined the effects of a novel naphthalimide derivative 8c on multidrug resistant colon cancer HCT116/L-OHP cells and explored the molecular mechanisms underlying the apoptosis induction.Methods:The anti-proliferative effects of 8c were detected by CCK-8 assays and the effects on apoptosis induction were examined by flow cytometry. The mRNA expression levels of p53, Bax and Bcl-2 were measured by real-time PCR; The protein expressions of p-p53, Bax, Bcl-2 and Cyt-c were detected by Western blot.Results:8c (IC50=8.16 µmol/L) seemed to be more potent than amonafide (IC50=28.37 µmol/L) against HCT116/L-OHP cells. 8c induced apoptosis on HCT116/ L-OHP cell lines through intrinsic or mitochondria dependent pathway. The protein expression of phosphorylation of p53 at Ser-15 was increased, but the mRNA level of p53 did not increase in HCT116/L-OHP cells. Bax protein and mRNA levels were significantly increased, and Bcl-2 protein and mRNA levels were decreased, suggesting an increase of Bax/Bcl-2 ratios. Meanwhile, 8c induced a substantial release of cytochrome c from the mitochondria into the cytosol in HCT116/L-OHP cells.Conclusion:8c induced cell death signal by inducing the activation p53 phosphorylation which subsequently activated related protein expressions of apoptotic pathway, which may be an important mechanism of 8c on inhibiting proliferation of HCT116/L-OHP resistant cells. All the results suggested that 8c was a potent compound to be developed as an anti-tumor and anti-resistance agent for clinic application in the future.
Naphthalimide derivative; Colon cancer; Apoptosis
10.3969/j.issn.1007-3969.2015.05.005
R735.3+5
A
1007-3639(2015)05-0345-07
2014-04-28
2014-11-30)
国家自然科学基金青年科学基金项目(81303102)。
王子元 E-mail:cjwzymerck@sina.com
