预照射联合siRNA抑制小鼠肺癌Survivin基因表达的研究
2015-01-04王利华阎超李烿烿路伟
王利华,阎超,李烿烿,路伟
1.青岛大学附属医院肿瘤科,山东 青岛 266003;
2.山东大学齐鲁医院(青岛)放疗科,山东 青岛 266035;
3.上海交通大学医学院附属第九人民医院放疗科,上海 200011;
4.上海市第六人民医院血液科,上海 200233
预照射联合siRNA抑制小鼠肺癌Survivin基因表达的研究
王利华1,阎超2,李烿烿3,路伟4
1.青岛大学附属医院肿瘤科,山东 青岛 266003;
2.山东大学齐鲁医院(青岛)放疗科,山东 青岛 266035;
3.上海交通大学医学院附属第九人民医院放疗科,上海 200011;
4.上海市第六人民医院血液科,上海 200233
背景与目的:肿瘤放化疗的效果与肿瘤细胞凋亡成正相关。Survivin是凋亡抑制基因,在肺癌中过度表达,降低其表达可增加肺癌细胞凋亡。RNA干扰可以特异、高效地封闭该基因的表达。肿瘤组织接受一定剂量的照射后,也可以提高基因转导率。本研究旨在探讨预照射联合瘤内注射siRNA对小鼠肺癌Survivin基因表达的影响。方法:将皮下移植瘤小鼠随机分为4组:未处理组(A组)、单纯siRNA瘤内注射组(B组)、单纯放射组(C组)和4 Gy预照射+siRNA瘤内注射组(D组)。小鼠经上述不同处理2 d后用颈椎脱臼法处死,剥离皮下移植瘤,采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)和蛋白[质]印迹法(Western blot)检测Survivin基因在mRNA和蛋白水平的表达情况;采用流式细胞术检测细胞周期及细胞凋亡。结果:B组、C组、D组Survivin基因在mRNA和蛋白水平的表达均较A组减少,且D组与A组Survivin基因在mRNA和蛋白水平的差异有统计学意义(P=0.036);D组处于S期的细胞比例为(2.70±0.34)%,较B组[(8.93±0.75)%]和C组[(6.71±0.51)%]明显减少,且与A组S期细胞的比例相比,差异有统计学意义(P=0.034);D组肿瘤组织的细胞凋亡率为(25.6±0.65)%,较其他3组肿瘤组织的细胞凋亡率明显增多,差异有统计学意义(F=78.82,P<0.05)。结论:预照射可增强siRNA的转导率,使肺癌组织中Survivin基因表达水平降低,促进细胞凋亡,进而增加放疗敏感性。
肺癌;Survivin基因;细胞凋亡;RNA干扰
目前,肺癌是世界上发生率和死亡率最高的恶性肿瘤[1],并且呈现上升趋势。由于其早期症状体征并不典型,约50%发现时已属晚期,确诊时3/4的患者已失去手术机会。目前肺癌的主要治疗手段包括手术、放疗和化疗,然而随着分子生物学技术的迅速发展,肺癌的生物治疗已成为继手术、放疗和化疗后的第4种肿瘤治疗模式。小干扰RNA技术是目前常用的比较成熟的基因敲除的方法[2]。肿瘤的形成是细胞增殖及细胞凋亡失控的共同结果,Survivin基因是目前发现的最强的凋亡蛋白抑制因子,具有抑制细胞凋亡和调节细胞增殖的双重作用,可以通过诱导细胞凋亡来消除肿瘤[3]。本研究将人肺腺癌细胞系A549接种于昆明小鼠的腋下构建肺癌的皮下移植瘤模型[4],然后采用预照射、小干扰RNA技术对移植瘤给予不同处理,进而观察预照射联合小干扰RNA对肺癌移植瘤的影响。
1 材料和方法
1.1 主要实验材料
肺癌A549细胞株由青岛大学中心实验室提供,DMEM培养基及TRIZOL(总RNA抽提试剂)购自美国Gibco公司,实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒购自宝生物工程(大连)有限公司,EntransterTM(动物体内转染试剂)由北京英格恩生物科技有限公司提供,蛋白裂解液(RIPA)购自碧云天生物技术研究所,硝酸纤维素膜购自德国Qiagen公司,BCA(蛋白质定量试剂盒)法蛋白浓度测定液购自美国Pierce公司,蛋白显影液购自美国Thermo公司;β-Actin抗体和Survivin抗体均为单克隆抗体,均购自上海素尔生物科技有限公司,Survivin siRNA由上海吉玛制药技术有限公司合成,Survivin siRNA的表达载体由山东赛恩斯科技有限公司合成,NucleoBond Xtra Midi Plus质粒提取试剂盒购自上海浩然生物技术有限公司。昆明小鼠20只,雄性,8周龄,体质量20~40 g,由青岛派特福德白鼠养殖专业合作社提供。
1.2 实验方法
1.2.1 体外细胞培养
肺癌A549细胞用含10%胎牛血清、青霉素(100 μ/mL)、链霉素(100 μ/mL)的DMEM培养液在37 ℃、CO2体积分数为5%及饱和湿度的条件下培养[5]。
1.2.2 荷瘤鼠模型制作及处理
收集处于对数生长期的A549细胞,用PBS配成细胞密度为5.0×107/mL的单细胞悬液。随机分为4组:未处理组(A组)、单纯siRNA瘤内注射组(B组)、4 Gy单纯放射组(C组)、4 Gy预照射+siRNA瘤内注射组(D组),每组5只,每只小鼠左侧腋窝处皮下注射0.2 mL细胞悬液,2周后观察到小鼠腋下有结节长出。
1.2.3 Survivin siRNA质粒的体内转染
按照NucleoBond Xtra Midi Plus质粒提取试剂盒的说明从菌液中抽提出质粒载体。检测抽出的质粒浓度,然后用纯水将质粒浓度稀释至0.5 μg/μL。具体转染步骤如下:
①核酸的稀释:取100 μL的质粒,加入10%葡萄糖溶液(w/v)150 μL,用纯水50 μL补足至300 μL,得到葡萄糖终浓度为5%,充分混匀;②转染试剂的稀释:取75 μL的EntransterTM体内试剂[6-7]用150 μL的10%葡萄糖溶液稀释,并用纯水75 μL补足至300 μL,得到葡萄糖终浓度为5%,充分混匀;③转染复合物形成:立即将稀释后的转染试剂加入到稀释后的核酸溶液中,充分振荡混匀;④室温静置15 min后,将配制好的转染复合物一次性多点注射到移植瘤中[8],转染24 h后剥离肿块提取RNA,转染48 h后从肿块中提取蛋白。
1.2.4 肿瘤组织总RNA的提取及qRT-PCR检测mRNA含量
将小鼠麻醉然后剥离出皮下移植瘤,将组织放在液氮中保存。取少量肿瘤组织在液氮中用消毒好的研钵磨碎,每个组织中加入1 mL TRIzol试剂,常温静置5 min,然后转移到1.5 mL EP管中;加入200 μL氯仿,剧烈振荡15 s,静置2~3 min,4 ℃离心机500×g离心15 min;取上清液,加入等体积异丙醇,轻轻混匀,静置10 min,4 ℃离心机500×g离心10 min;弃上清液,加入1 mL 75%冰乙醇,轻轻混匀,4 ℃离心机500×g离心5 min;弃上清液,加入10 μL DEPC水。测定总RNA浓度。按TaKaRa公司反转录试剂盒说明书合成cDNA,使用qRT-PCR试剂盒配成20 μL所需要的反应体系,采用2-ΔΔct方法计算Survivin基因mRNA水平的表达。逆转录条件:42 ℃ 60 min,70 ℃10 min,反应终止后,冰上冷却,于-20 ℃保存。PCR条件:95 ℃ 1 min预变性;95 ℃ 30 s,60 ℃ 30 s,68 ℃ 90 s,循环30次;68 ℃延伸10 min。逆转录所用的引物,Survivin上游引物:5’-A G G G G G A T G T G G AGGTGTGAG-3’,下游引物:5’-CCTGT AACCCTAGAGCGGAG-3’。GAPDH上游引物:5’-CTAGAGGCACCGATGATGTTC-3’,下游引物:5’-GAGTTAGCTCACTCATTAGGC-3’。
1.2.5 总蛋白的提取以及蛋白[质]印迹法(Western blot)检测蛋白含量
取出肿瘤组织,先用液氮在研钵中把组织研碎,用蛋白裂解液(RIPA)于冰上裂解20 min,然后将细胞碎片和裂解液移至1.5 mL预冷的离心管中,4 ℃离心机500×g离心15 min,上清液用BCA法测定蛋白浓度,根据浓度计算蛋白样本的上样量,将其加入SDS凝胶加样缓冲液中,在100 ℃加热3~5 min使蛋白变性。将处理后的样品加入SDS-PAGE凝胶中开始电泳分离,80 V电泳30 min使染料进入分离胶后,将电压加至130 V电泳80 min,溴酚蓝到达胶的底端处附近即可停止电泳,然后将蛋白质从凝胶电转移至PVDF膜,于200 mA转膜1 h,此过程中把转膜槽放置在冰浴中进行。转膜完成后,立即把蛋白膜放置到预先准备好的Western blot洗涤液(P0023C)中,漂洗1~2 min,洗去膜上的转膜液。再将膜放入由脱脂奶粉、PBS和Tween-20配成的封闭液中室温下封闭2 h,PBST洗膜3次,5 min/次,然后将膜放入稀释好的Survivin单抗(Survivin单抗:一抗稀释液=1∶1 000)中于4 ℃温育过夜,PBST洗涤3次;二抗于室温温育2 h,PBST洗涤3次;最后加蛋白显影液进行扫膜,结果与参考蛋白β-actin表达做对照。
1.2.6 流式细胞术检测细胞周期
将肿瘤组织用眼科剪剪切成1~2 mm大小,然后加入胰酶,37 ℃消化8 min,最后用约5 mL含血清的培养液终止消化,100×g离心10 min,PBS洗涤1次,用PBS配成单细胞悬液,显微镜下计数,100×g离心5 min后弃上清液,加入1 mL 70%预冷乙醇中,吹打均匀,4 ℃固定12 h以上,PBS洗涤去乙醇,100×g离心5 min,洗涤2遍,0.5 mL PBS重悬细胞,加入以PBS配成的1 mg/mL PI和10 mg/mL RNaseA至终浓度50 g/mL,37 ℃温浴30 min,用流式细胞仪测定周期。
1.2.7 流式细胞术检测细胞凋亡
将肿瘤组织用眼科剪剪切成1~2 mm大小,然后加入胰酶,37 ℃消化8 min,最后用约5 mL含血清的培养液终止消化,100×g离心10 min,PBS洗涤1次,用PBS配成单细胞悬液,显微镜下计数,100×g离心5 min,加入400 μL 1×Binding Buffer重悬,加入5 μL Annexin V混匀,避光室温温育15 min,加入10 μL PI染色液,混匀,冰上避光温育30 min,采用流式细胞仪检测细胞凋亡率。
1.3 统计学处理
2 结 果
2.1 qRT-PCR检测肿瘤组织中Survivin基因mRNA的表达
对4组不同处理的小鼠的肿瘤组织提取RNA做qRT-PCR检测,结果显示,B、C、D组不同处理组的肿瘤组织中Survivin基因mRNA表达水平较未处理组减少,将3组分别与A组进行比较得出D组肿瘤组织中Survivin基因mRNA表达降低的程度差异有统计学意义(P=0.036);B组和C组中Survivin基因mRNA表达降低的程度差异无统计学意义(P>0.05,图1)。
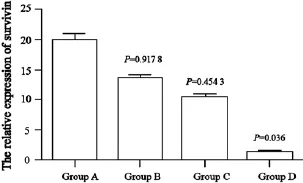
图1 各组Survivin基因在mRNA水平的相对表达量Fig. 1 The relative expression of Survivin gene in mRNA level of each group
2.2 Western blot检测肺癌组织中蛋白的表达
用Western blot检测以上4组的肿瘤组织提取蛋白,结果显示,B、C、D组肿瘤组织中Survivin蛋白表达较A组较少;C组较B组Survivin蛋白表达水平低;D组Survivin蛋白的条带最淡,说明该组蛋白表达水平最低(图2)。对各组条带进行灰度值分析:B组/A组=0.8,C组/A组=0.4,D组/A组=0.3,说明4 Gy放疗后再进行转染可以提高siRNA的转染效率,进而增强对Survivin基因的干扰。
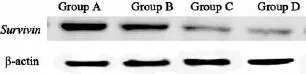
图2 各组Survivin基因在蛋白水平的相对表达量Fig. 2 The relative expression of Survivin gene in protein level of each group
2.3 流式细胞术检测细胞周期
从不同处理的4组肿瘤组织中提取细胞做流式细胞术检测细胞周期,结果显示,处理组(B组、C组、D组)的细胞在G2期和S期的比例较未处理组(A组)减少,说明siRNA转染或者放疗后肿瘤组织中处于分裂期的细胞比例较少(图3)。D组与A组细胞在G2期和S期的比例差异有统计学意义(P=0.015 1,P=0.034),其余两组与A组的差异无统计学意义(P>0.05)。
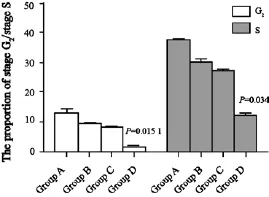
图3 各组中G2期和S期细胞占该组所有细胞的比例Fig. 3 The proportion of G2and S stage in each group
2.4 流式细胞术检测细胞凋亡
采用流式细胞术检测各组肿瘤组织中细胞凋亡情况,结果显示,B、C、D组的肿瘤组织中细胞凋亡率较A组中的细胞凋亡率增加,说明siRNA转染或者放疗能增加肿瘤组织中细胞的凋亡,且两者联合处理的肿瘤组织中细胞凋亡率最高(表1)。

表1 各组肿瘤组织中细胞的凋亡率比较Tab. 1 The comparison of apoptosis rate among different tumor tissues
3 讨 论
Survivin基因是目前发现的最强的凋亡蛋白抑制因子[9-10],该基因多在肿瘤组织和胚胎发育组织中表达,在正常组织中不表达。目前有报道显示,Survivin蛋白在肺鳞癌、腺癌及小细胞癌组织中的表达水平显著高于肺癌癌旁组织[11],通过qRT-PCR和Western blot检测未处理组Survivin基因mRNA和蛋白水平的表达,我们也证实了Survivin基因在肺癌中的阳性表达。RNA干扰是由双链RNA引发的转录后基因沉默,这一新技术可以特异、高效地封闭Survivin基因表达[12],本研究也采用此技术阻断肺癌中Survivin基因的高表达。RNA干扰技术较反义核酸技术更为高效,而且siRNA质粒能够使siRNA在细胞内较稳定表达,更好地满足临床治疗需要。根据文献报道和siRNA的设计原则[13-14],本研究构建了Survivin siRNA干扰质粒。目前将siRNA注入动物移植瘤内的技术已有较多报道[15-16],我们构建了小鼠肺癌皮下移植瘤模型,然后按照文献报道的方法将siRNA注入瘤内。从Survivin基因mRNA的表达水平可以看出,单纯siRNA转染或者单纯放射处理后Survivin基因mRNA表达水平降低,但与未处理组比较差异无统计学意义(P分别为0.917 8和0.454 3),放射联合siRNA转染组的Survivin表达水平明显降低,与未处理组相比,差异有统计学意义(P=0.036)。故放射可以抑制Survivin的表达但作用不明显,采用放射联合siRNA干扰技术可以提高siRNA的转导率,进而增强siRNA对Survivin基因的干扰作用,降低Survivin基因的表达。Zheng等[17]采用腺病毒载体AdCMVluc的研究发现,小鼠肺癌细胞照射2~40 Gy的γ线后,再感染AdCMVluc,可造成细胞内luc基因编码产物呈剂量依赖性扩增,扩大率可达24倍,有效抑制了肿瘤生长。Olie等[18]研究发现,应用Survivin反义寡核苷酸抑制肺癌Survivin基因的表达,可促进肿瘤细胞的凋亡。我们对各实验组的细胞周期和细胞凋亡检测的结果也发现经4 Gy放射线处理后再转染siRNA的细胞凋亡率[(25.67±0.65%)]最高。与其他3组的凋亡率[(8.37±1.35)%、(16.39±2.29)%和(21.31±0.93)%]比较,差异有统计学意义(P<0.05)。故放疗联合siRNA技术更能促进细胞凋亡。根据放射线对细胞的影响,我们考虑肺癌细胞经放射后细胞出现间接作用,出现氧自由基,细胞膜的通透性增加,导致siRNA转染率增加。目前关于放射增强siRNA的转染率的机制尚不明确,有待进一步研究。
Survivin基因可成为肺癌基因治疗新的研究靶点,RNA干扰技术可以成为肺癌治疗的潜在性新技术[19],鉴于放射治疗在肺癌治疗中的应用逐步扩大[20],价值越来越突显,放疗联合靶向基因的RNA技术有望为肺癌的治疗开辟新的前景。
[1] BUGIANTELLA W, CAVAZZONI E, GRAZIOSI L, et al. Small bowel metastasis from lung cancer: a possible cause of acute abdomen. Case report and literature review [J]. G Chir, 2011, 32(3): 120-122.
[2] 李亚荣, 郝杰, 夏大文, 等. 小分子Survivin干扰RNA逆转肺癌细胞耐药的研究[J]. 中国实验诊断学, 2011, 15(3): 407-410.
[3] 叶因涛, 王晨, 宋晓坤, 等. 隐丹参酮对肝癌H22荷瘤小鼠放射增敏作用的影响[J]. 中国癌症杂志, 2014, 24(1): 29-34.
[4] 历风元, 蒋智敏, 朱涟敏, 等. 昆明小鼠肺癌模型建立的初步研究[J]. 南昌大学学报, 2012, 52(1): 17-19.
[5] 周丽薇. 细胞培养技术与防止细胞污染的方法[J]. 医学信息, 2010, 23(11): 4387-4388.
[6] LI X R, LI R, YAO X L, et al. Hepatitis B virus can be inhibited by DNA methyltransferase 3a via specific zincfinger-induced methylation of the X promoter [J]. Biochemistry, 2014, 79(2): 111-123.
[7] ZHANG Y, ZHANG L, WU J, et al. Heme Oxygenase-1 exerts a protective role in ovalbumin-induced neutrophilic airway inflammation by inhibiting response in the immune cells Th17 cell-mediated immune response [J]. Biol Chem, 2013, 288(48): 34612-34626.
[8] 杨捷, 徐兴祥, 黄谦. AdH1-siRNA/VEGF联合化疗对小鼠Lewis肺癌的治疗作用[J]. 江苏医药, 2013, 39(23): 2814-2817.
[9] HOSSAIN Z, HOSOKAWA M, TAKAHASHI K. Growth inhibition and induction of apoptosis of colon cancer cell lines by applying marine phospholipids [J]. Nutr Cancer, 2009, 61: 123-130.
[10] 尹虹, 刘玥, 郑文岭, 等. miRNA-196b过表达对K562细胞增殖、凋亡及Survivin、Cox-2表达的影响[J]. 中国癌症杂志, 2013, 23(5): 341-346.
[11] 李姝君, 杨志雄, 田鲜艳, 等. Survivin在肺癌中表达意义及其与Fas/FasL表达的关系[J]. 中国医药导报, 2011, 8(20): 17-19.
[12] CHEN X, QIAN Y, YAN F, et al. 5'-triphosphate-siRNA activates RIG-I-dependent type I interferon production and enhances inhibition of hepatitis B virus replication in HepG2.2.15 cells[J]. Eur J Pharmacol, 2013, 721(1-3): 86-95.
[13] LATRONICO M V, CONDORELLI G. RNA silencing: small RNA- mediated Posttranscriptional regulation of mRNA and the implication s for heart electropathophysiology [J]. J Cardiovasc Electrophysio, 2009, 20(2): 230-237.
[14] LAGANA A, SHASHA D, CROCE C M. Synthetic RNAs for Gene Regulation: Design Principles and Computational Tools[J]. Front Bioeng Biotechnol, 2014, 2 (65): 1-7.
[15] WANG F, ZHANG P, MA Y, et al. NIRF is frequently upregulated in colorectal cancer and its oncogenicity can be suppressed by let-7a microRNA [J]. Cancer Lett, 2012, 314(2): 223-231.
[16] ZHAO R, YAN Q, HUANG H, et al. Transdermal siRNATGFβ1-337 patch for hypertrophic scar treatment [J]. Matrix Biol, 2013, 32(5): 265-276.
[17] ZHENG W, MA X, WEI D, et al. Molecular cloning and bioinformatics analysis of a novel spliced variant of Survivin from human breast cancer cells [J]. DNA Seq, 2005, 16(5): 321-328.
[18] OLIE R A, SIMONES-WUST A P, BAUMANN B, et al. A novel antisense oligonucleotide targeting Survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy[J]. Cancer Res, 2000, 60 (11): 2805-2809.
[19] CHEN Y, HUANG L. Tumor-targeted delivery of siRNA by non-viral vector: safe and effective cancer therapy [J]. Expert Opin Drug Deliv, 2008, 5(12): 1301-1311.
[20] 冯雯, 傅小龙. 放射治疗在非小细胞肺癌治疗中地位[J]. 中国癌症杂志, 2013, 23(1): 75-80.
Research on the expression of Survivin gene suppressed by pre-irradiation and intratumor injection siRNA in lung cancer of mouse
WANG Lihua1, YAN Chao2, LI Rongrong3, LU Wei4(1.Department of Oncology, Qingdao University Affiliated Hospital, Qingdao Shandong 266003, China; 2.Department of Radiotherapy, Qilu Hospital of ShanDong University (Qingdao), Qingdao Shandong 266035, China; 3. Department of Radiotherapy, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China; 4.Department of Hematology, Shanghai Sixth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200233, China)
YAN Chao E-mail: qdyanchao@aliyun.com
Background and purpose:The effects of tumor after radiotherapy and chemotherapy with tumor cell apoptosis have positive correlation. Survivin is an apoptosis suppressor gene, which is overexpressed in lung cancer. The reduction of its expression can increase lung cancer cell apoptosis. RNA interference can specifically and effectively blocked the expression of this gene. After accepting a dose of radiation, tumor tissues can raise the rate of gene transduction. The purpose of this study was to investigate the effects of the expression of Survivin gene suppressed by intratumor injection siRNA and radiation in lung cancer.Methods:Mouse subcutaneous transplanted with tumors were randomly divided into four groups: untreated group (group A), group with intratumor injection siRNA (group B), group with radiation (group C), group 4 Gy pre-irradiation combination with intratumor injection siRNA(group D). Two days later, mouse with different treatments were executed by cervical dislocation and stripped the subcutaneous tumors. mRNA and protein levels of Survivin gene were detected by quantitative real-time PCR (qRTPCR) and Western blot; Cell cycle and cell apoptosis were assayed by flow cytometry (FCM).Results:The expression of Survivin gene in mRNA and protein levels in group B, C, and D were significantly reduced compared with group A. The differences of Survivin expression in mRNA level between group A and group D were statistically significant. Compared with the other 3 groups, the expression of Survivin gene in group D was significantly reduced, the differences were statistically significant (P=0.036);The proportion of cells in S-phase of group D was (2.70±0.34)%, compared with group B [(8.93±0.75)%] and group C [(6.71±0.51)%], that was significantly reduced. The differences of the proportion of S-phase cells in group A and group D were statistically significant (P=0.034);The rate of cell apoptosis in group D was (25.67 ± 0.65)%, which was significantly increased compared with the rate of cell apoptosis in the other 3 groups, the differences were statistically significant (F=78.82, P<0.05).Conclusion:Pre-irradiation can enhance the transduction rate of siRNA, reduce the expression of Survivin gene in lung cancer, promote cell apoptosis, and increase the sensitivity of the radiotherapy.
Lung cancer; Survivin gene; Cell apoptosis; RNA interference
10.3969/j.issn.1007-3969.2015.05.004
R734.2
A
1007-3639(2015)05-0339-06
2015-01-22
2015-04-01)
山东省中青年科学家科研奖励基金(BS2010YY014)。
阎超 E-mail:qdyanchao@aliyun.com
