乙肝病毒X蛋白上调肝癌细胞缺氧诱导因子-1α的作用和机制研究
2015-01-04刘利平杨盛力何婉孙枫林鲍世韵
刘利平,杨盛力,何婉,孙枫林,鲍世韵
1.暨南大学第二临床医学院/深圳市人民医院肝胆外科,广东 深圳 518020;
2. 华中科技大学同济医学院附属梨园医院普通外科,湖北 武汉 430077;
3.暨南大学第二临床医学院/深圳市人民医院肿瘤科,广东 深圳 518020
乙肝病毒X蛋白上调肝癌细胞缺氧诱导因子-1α的作用和机制研究
刘利平1,杨盛力2,何婉3,孙枫林1,鲍世韵1
1.暨南大学第二临床医学院/深圳市人民医院肝胆外科,广东 深圳 518020;
2. 华中科技大学同济医学院附属梨园医院普通外科,湖北 武汉 430077;
3.暨南大学第二临床医学院/深圳市人民医院肿瘤科,广东 深圳 518020
背景与目的:乙肝病毒X蛋白(hepatitis B virus X protein,HBx)和缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在肝癌发生、发展过程中起重要作用。有研究显示,两者在肝癌组织中的表达呈正相关,但相关机制尚不明确。本研究拟进一步在细胞水平上探讨HBx对HIF-1α的调控作用及机制。方法:用LipofectemineTM2000包裹HBx表达质粒转染到肝癌Huh7细胞。蛋白[质]印迹法(Western blot)检测Huh7细胞中HIF-1α和HIF-1β蛋白的表达;特异性试剂盒检测HIF-1α转录活性;实时定量PCR(quantitative real-time PCR,qRT-PCR)检测HIF-1α及其靶基因血管内皮生长因子(vascular endothelial growth factor,VEGF)和多药耐药基因1(multi-drug resistance gene 1,MDR1)mRNA表达变化;免疫共沉淀法检测HIF-1α、HBx和希佩尔林道病肿瘤抑制蛋白(protein von Hippel-Lindau,pVHL)间的相互作用。结果:转染HBx质粒后,Huh7细胞中HIF-1α蛋白表达、转录活性及其靶基因VEGF和MDR1的mRNA表达水平明显上调(P<0.05),然而HBx对HIF-1α mRNA表达水平没有明显影响(P>0.05)。同时,HBx显著削弱pVHL介导的泛素化水解蛋白酶降解HIF-1α的活性。免疫共沉淀法检测进一步提示,HBx可直接结合pVHL,而对HIF-1α没有结合作用。结论:HBx可能通过直接结合pVHL,抑制其与HIF-1α的相互作用,从而增强HIF-1α蛋白的稳定性及转录活性。
肝细胞癌;缺氧诱导因子-lα;乙肝病毒X蛋白;希佩尔林道病肿瘤抑制蛋白
肝细胞性肝癌是我国最常见的恶性肿瘤之一,与慢性乙型肝炎病毒(hepatitis B virus,HBV)感染密切相关[1]。乙肝病毒X蛋白(hepatitis B virus X protein,HBx)是HBV开放读码框编码的一种多功能蛋白,通过与细胞内多种与转录、基因调控有关的因子结合,广泛激活病毒与细胞的启动子,参与基因和信号通路调控,与肝癌的发生、发展密切相关[2-3]。肝脏虽然血供丰富,但肿瘤内由于新生血管功能缺陷和细胞代谢旺盛,常常导致局部组织严重缺氧。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是肿瘤细胞调节适应缺氧微环境最重要的因子,对维持肿瘤细胞的能量代谢、新血管生成、促进肿瘤侵袭和转移、介导肿瘤化疗耐药起着重要作用[4-5]。作为肝癌发生、发展两个最重要的调节蛋白,HBx和HIF-1α的相互作用越来越受到关注,虽有研究显示两者在肝癌组织中的表达呈正相关,但相关机制尚未完全阐明[6]。本研究拟进一步在细胞水平上探讨HBx的HIF-1α的调控作用及相关机制。
1 材料和方法
1.1 材料
HBx质粒(FLAG-154X)由美国德雷塞尔大学医学院M. J. Bouchard博士赠送,经PCR扩增HBx序列并插入pcDNA3.1载体,构建HBx表达质粒(pc3.1-HBx),HIF-1α质粒(HA-HIF-1α)和带有FLAG标签的希佩尔林道病肿瘤抑制蛋白(protein von Hippel-Lindau,pVHL)质粒(FLAG-pVHL)由美国国立癌症研究所的J. S Issaacs博士赠送。PCR引物由生工生物工程(上海)股份有限公司合成,逆转录试剂盒、SYBR Green Supermix和脂质体转染剂LipofectamineTM2000购自美国Invitrogen公司,鼠抗人单克隆抗体HIF-1α、HIF-1β、HBx和β-actin、HRP标记的兔抗鼠IgG、蛋白A/G磁珠购自美国Santa Cruz公司,鼠抗人单克隆抗体FLAG购自美国Sigma公司。HIF-1α特异性转录活性检测试剂盒购自美国Cayman公司。细胞培养液DMEM和胎牛血清购自美国Hyclone公司。
1.2 方法
1.2.1 细胞培养和质粒转染
肝癌细胞Huh7由含10%胎牛血清的DMEM培养液在37 ℃、CO2体积分数为5%的恒温培养箱中培养。质粒转染时,将Huh7细胞(5×105个/孔)接种于6孔板中,在含10%胎牛血清的DMEM培养液中生长至80%左右汇度。采用脂质体转染法转染,按照脂质体说明书操作,24 h后收集细胞检测。
1.2.2 实时定量RCR(quantitative real-time PCR,qRT-PCR)检测细胞mRNA的表达
收获各组Huh7细胞,加入TRIzol液1 mL提取细胞总RNA,测RNA的浓度和纯度,取1 μg的总RNA逆转录为cDNA。各基因需要的PCR引物见表1。cDNA被稀释10倍后每个PCR反应孔中加入1 μL,并加入10 nmol的上、下游引物各0.5 μL,无核酸酶的超净水8 μL和SYBR Green Supermix 10 μL。PCR反应在ABI 7900HT qRT-PCR检测系统上运行,程序设置为:95 ℃2 min;95 ℃ 10 s,60 ℃ 60 s,40个循环;72 ℃10 min。采用2−ΔΔCt法计算相对mRNA表达。

表1 qRT-PCR引物Tab. 1 The primers for qRT-PCR
1.2.3 蛋白[质]印迹法(Western blot)检测蛋白的表达
用RIPA液提取细胞内总蛋白,采用SDSPAGE 凝胶电泳分离蛋白,采用恒压100 V,90 min将蛋白电转移至PVDF膜上,5%脱脂奶粉封闭2 h,加入1∶1 000稀释的HIF-1α、HIF-1β、HBx、FLAG和β-actin抗体,于4 ℃温育过夜。TBST洗膜后加入1︰3 000稀释的过氧化物酶标二抗,室温温育60 min,TBST洗膜,ECL化学发光显影。
1.2.4 免疫共沉淀检测蛋白间相互作用
用RIPA液提取细胞内总蛋白,取500 μg总蛋白加入HBx抗体10 μg振荡温育12 h,然后加入20 μL蛋白A/G琼脂糖磁珠沉淀免疫复合物,RIPA液洗涤3遍后,加入SDS缓冲液30 μL,置于水中煮沸10 min,然后行Western blot检测:用HBx、HIF-1α和FLAG抗体检测目的蛋白表达。
1.2.5 HIF-1α转录活性检测
采用美国Cayman公司的试剂盒检测HIF-1α转录活性[7]。首先提取细胞核蛋白,取20 μg核蛋白加入到预先包被含有HIF-1α反应原件的特异性双链DNA的96孔板中,然后4 ℃温育16 h,PBS洗板3遍后加入特异性HIF-1α抗体,再用PBS洗板3遍并加入HRP标记的特异性二抗,然后加入显色剂在用分光光度计在450 nm波长下检测吸光度(D)值,根据标准曲线计算出相对HIF-1α转录活性。
1.3 统计学处理
2 结 果
2.1 HBx对HIF-1α的表达调节和转录活性作用
在常氧条件下,Huh7细胞中HIF-1α被pVHL介导的泛素化水解酶降解,通常Western blot检测表达很低。为了更好地显示HBx对HIF-1α的调节作用,本研究共转染了HIF-1α表达质粒以提高HIF-1α的基础表达水平。HBx显著上调HIF-1α的表达,然而对HIF-1β的表达没有明显影响(图1A)。HIF-1α转移到细胞核与HIF-1β形成二聚体,并与下游靶基因启动子结合进而促进其转录。HBx显著上调HIF-1α的转录活性(P<0.05,图1B)。进一步qRT-PCR检测发现,转染HBx后HIF-1α靶基因血管内皮生长因子(vascular endothelial growth factor,VEGF)和多药耐药基因1(multi-drug resistance gene 1,MDR1) mRNA表达明显升高(P<0.05,图1C)。因此,HBx对肝癌细胞HIF-1α的表达和转录活性有明显的上调作用。
2.2 HBx增强HIF-1α表达和转录活性作用机制
为了明确HBx上调HIF-1α表达作用机制,本研究首先检测HBx对HIF-1α mRNA的影响。HBx对HIF-1α mRNA表达水平没有明显影响(P>0.05,图2A)。pVHL可以促进泛素化水解酶介导的HIF-1α降解,因而Huh7细胞在转染pVHL质粒后HIF-1α表达明显降低。然而,同时转染HBx质粒的Huh7细胞HIF-1α表达没有明显改变,提示HBx可能通过抑制pVHL的作用上调HIF-1α的表达(图2B)。免疫共沉淀实验结果显示,HBx可以结合pVHL从而干扰pVHL介导的HIF-1α泛素化水解酶降解途径,但HBx对HIF-1α没有结合作用(图2C)。因此,HBx可能通过结合pVHL,阻止其与HIF-1α相互作用,从而增强HIF-1α的稳定性。
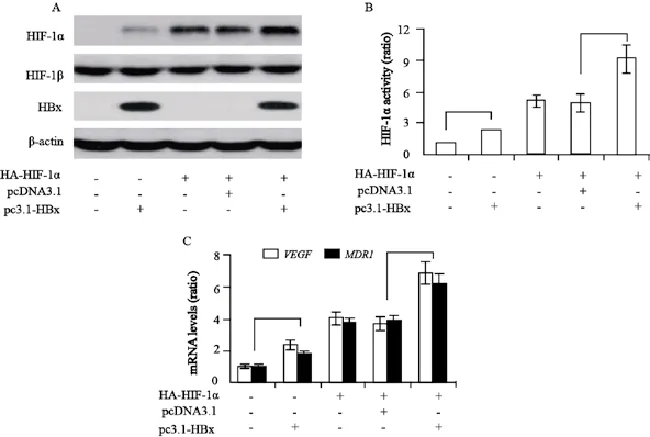
图1 HBx对HIF-1α的表达调节和转录活性作用Fig. 1 The roles of HBx in regulating the expression and transcriptional activation of HIF-1α
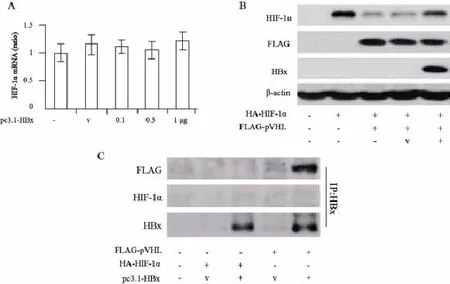
图2 HBx增强HIF-1α表达和转录活性作用机制Fig. 2 Mechanisms of HBx in up-regulating the expression and transcriptional activation of HIF-1α
3 讨 论
肝癌是全世界第三大恶性肿瘤,在每年新增的约50万肝癌病例中,其中有一半发生在我国[1]。早期的小肝癌手术切除预后较好,5年生存率可达75%,但大部分患者临床确诊时即为中晚期,从而失去手术机会或术后转移复发率较高[8]。因此,深入探索肝癌发生、发展机制,对肝癌的防治有着重要意义。我们前期研究发现,HIF-1α在肝癌组织中高表达,且与肝癌包膜不完整、门脉侵犯、术后转移复发和总生存时间降低关系密切[9]。同时,HIF-1α在肝癌组织中的表达与HBx呈正相关[10]。在前期研究的基础上,本研究进一步在细胞水平阐明HBx上调HIF-1α蛋白的表达和转录激活作用。HIF-1α在细胞核内与HIF-1β结合形成二聚体,成为有活性的HIF-1复合物,与受其调节的下游靶基因的缺氧反应元件结合,形成转录起始复合物启动下游靶基因VEGF和MDR1等的转录[11]。VEGF是肿瘤新生血管形成最关键的生子因子,与肝癌侵袭转移密切相关[12-13]。MDR1是一种最典型的多药耐药基因,其编码的P-糖蛋白是一种ATP依赖性膜转运体,作用类似于排出泵,可通过将化疗药物从癌细胞中外排而使细胞内药物浓度降低,从而降低药效,是导致肝癌化疗耐药的重要因子[14-15]。因此,HBx可以通过增强HIF-1α的表达和转录活性,促进肝癌的发生、发展,并导致预后不良。
研究表明,HIF-1α蛋白表达的调控最重要的是在转录后水平[16]。本研究也发现,HBx对HIF-1α mRNA表达水平没有明显影响。在常氧条件下,HIF-1α蛋白脯氨酸残端发生羟基化,从而被pVHL识别并结合,启动E3泛素化水解酶介导的蛋白降解途径[17-18]。作为一个抑癌基因,pVHL通常因为基因突变而失活,从而导致一系列肿瘤的发生,如肾癌、血管母细胞瘤和嗜铬细胞瘤[19]。我们研究发现,HBx可以直接结合pVHL,进而可能抑制pVHL与HIF-1α的结合,导致E3泛素化水解酶介导的HIF-1α蛋白降解受阻,从而上调HIF-1α的表达。因此,本研究结果可能揭示了一个新的HBx致癌机制,即通过直接结合pVHL导致其失去活性,从而阻断HIF-1α蛋白的降解过程而使其表达升高。HBx蛋白为一种非结构蛋白,可以通过折叠变形获得二级结构,从而与目的蛋白结合[20]。需要特别指出的是,本研究用的HBx质粒序列为野生型,近年来在肝癌组织中检测到的HBx序列通常含有各种突变,是否HBx突变体具有同样或者更强的结合pVHL的活性,值得进一步研究[21]。
综上所述,本研究在肝癌细胞水平上研究发现HBx可以通过直接结合pVHL,抑制HIF-1α蛋白的降解,从而增强HIF-1α的表达和转录活性,促进肝癌的发生、发展,并导致预后不良。因此,本研究揭示一个新的HBx致癌机制,丰富和完善HBx的功能,进一步推动肝癌发生、发展的可能机制的研究。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics[J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[2] NEUVEUT C, WEI Y, BUENDIA M A. Mechanisms of HBV-related hepatocarcinogenesis [J]. J Hepatol, 2010, 52(4): 594-604.
[3] 金涛, 刘平, 黄早早, 等. 乙肝病毒X 蛋白对正常肝细胞生物钟基因表达的影响 [J]. 中国普通外科杂志, 2014, 23(7): 915-920.
[4] SEMENZA G L. Targeting HIF-1 for cancer therapy [J]. Nat Rev Cancer, 2003, 3(10): 721-732.
[5] 金炜东, 马丹丹, 蔡逊, 等. 缺氧诱导因子1α 在肝癌细胞上皮- 间充质化中的作用 [J]. 中国普通外科杂志, 2013, 22(7): 885-889.
[6] XIE H, SONG J, LIU K, et al. The expression of hypoxiainducible factor-1alpha in hepatitis B virus-related hepatocellular carcinoma: correlation with patients' prognosis and hepatitis B virus X protein [J]. Dig Dis Sci, 2008, 53(12): 3225-3233.
[7] MATSUMURA A, KUBOTA T, TAIYOH H, et al. HGF regulates VEGF expression via the c-Met receptor downstream pathways, PI3K/Akt, MAPK and STAT3, in CT26 murine cells[J]. Int J Oncol, 2013, 42(2): 535-542.
[8] RAHBARI N N, MEHRABI A, MOLLBERG N M, et al. Hepatocellular carcinoma: current management and perspectives for the future [J]. Ann Surg, 2011, 253(3): 453-469.
[9] YANG S L, LIU L P, JIANG J X, et al. The correlation of expression levels of HIF-1α and HIF-2α in hepatocellular carcinoma with capsular invasion, portal vein tumor thrombi and patients' clinical outcome [J]. Jpn J Clin Oncol, 2014, 44(2): 159-167.
[10] LIU L P, HU B G, YE C, et al. HBx mutants differentially affect the activation of hypoxia-inducible factor-1α in hepatocellular carcinoma [J]. Br J Cancer, 2014, 110(4): 1066-1073.
[11] SEMENZA G L. Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics [J]. Oncogene, 2010, 29(5): 625-634.
[12] 曹世姣, 张广亮, 喻芳, 等. 子宫内膜癌中elF4E与VEGF的表达及其临床意义[J]. 中国癌症杂志, 2012, 22(2): 120-124.
[13] LI Y, ZHAI Z, LIU D, et al. CD105 promotes hepatocarcinoma cell invasion and metastasis through VEGF [J]. Tumour Biol, 2015, 36(2): 737-745.
[14] CHEN J, DING Z, PENG Y, et al. HIF-1alpha inhibition reverses multidrug resistance in colon cancer cells via downregulation of MDR1/P-glycoprotein [J]. PLoS One, 2014, 9(6): e98882.
[15] 隋华, 付晓伶, 潘树芳, 等. PI3K/Akt/NF-κB通路调控ABCB1/P-gp介导的人结肠癌细胞多药耐药的研究[J].中国癌症杂志, 2014, 24(2): 106-111.
[16] 何前进, 刘利平, 岑红兵, 等. 缺氧诱导因子与肝癌关系的研究进展 [J]. 中华临床医师杂志(电子版), 2013, 7(20): 9312-9314.
[17] IVAN M, KONDO K, YANG H, et al. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing [J]. Science 2001, 292(5516): 464-468.
[18] VAN MOLLE I, THOMANN A, BUCKLEY D L, et al. Dissecting fragment-based lead discovery at the von Hippel-Lindau protein: hypoxia inducible factor 1alpha proteinprotein interface [J]. Chem Biol, 2012, 19(10): 1300-1312.
[19] KIM W Y, KAELIN W G. Role of VHL gene mutation in human cancer [J]. J Clin Oncol, 2004, 22(24): 4991-5004.
The role of hepatitis B virus X protein in regulation of hypoxia inducible factor-1α and the underlying mechanisms in hepatocellular carcinoma
LIU Liping1, YANG Shengli2, HE Wan3, SUN Fenglin1, BAO Shiyun1(1.Department of Hepatobiliary and Pancreatic Surgery, Shenzhen People’s Hospital, the Second Clinical Medical College of Jinan University, Shenzhen Guangdong 518020, China; 2.Department of General Surgery, Liyuan Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei 430077, China; 3.Department of Medical Oncology, Shenzhen People’s Hospital, the Second Clinical Medical College of Jinan University, Shenzhen Guangdong 518020, China)
BAO Shiyun E-mail: baomi94@163.com
Background and purpose:Hepatitis B virus X protein (HBx) and hypoxia inducible factor-1α (HIF-1α) play key roles in hepatocarcinogenesis and the development of hepatocellular carcinoma. Positive correlation on the expression of these 2 proteins in hepatocellular carcinoma tissues has been found, whereas the underlying mechanisms have not been fully elucidated. This study focused on the role of HBx in regulating HIF-1α and the underlying mechanisms in hepatocellular carcinoma cells.Methods:The expression plasmids were transfected into Huh7 cells with LipofectemineTM2000. Western blot analysis was applied to detect the expressions of HIF-1α and HIF-1β protein. The transcriptional activity of HIF-1α was detected by the commercial analysis kits. The mRNA levels of HIF-1α and its target genes, including vascular endothelial growth factor (VEGF) and multi-drug resistance gene1 (MDR1), were detected by quantitative real-time PCR (qRT-PCR). Immunoprecipitation analysis was applied to detect the interaction of HIF-1α, HBx and protein von Hippel-Lindau (pVHL).Results:Huh7 cells transfected with HBx plasmid led to sharp increase of HIF-1α protein and transcriptional activity, as well as the mRNA of VEGF and MDR1 (P<0.05). However, the mRNA level of HIF-1α was not obviously changed after HBx transfection (P>0.05). Meanwhile, HBx also significantly impaired the function of pVHL in mediating the degradation of HIF-1α by ubiquitin hydrolase. This finding was further confirmed by the immunoprecipitation analysis, which showed that HBx could directly bind to pVHL, but not to HIF-1α.Conclusion:HBx may inhibit the inter-activation between pVHL and HIF-1α through directly binding to pVHL, and thus enhance the stability and transcriptional activity of HIF-1α.
Hepatocellular carcinoma; Hypoxia inducible factor-lα; Hepatitis B virus X protein; Protein von Hippel-Lindau
10.3969/j.issn.1007-3969.2015.05.003
R735.7
A
1007-3639(2015)05-0333-06
2014-12-19
2015-02-16)
国家自然科学青年基金(81402041)。
鲍世韵 E-mail:baomi94@163.com
