云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用
2015-01-03岳田利袁亚宏王虎玄
岑 涛,岳田利*,袁亚宏,丁 旭,王虎玄,宋 靓
云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用
岑 涛,岳田利*,袁亚宏,丁 旭,王虎玄,宋 靓
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
本实验以从云南省采集的4个品种的芒果果皮作为分离源,经分离、纯化及三级筛选得到6株在芒果汁基质中具有良好发酵力的酵母菌。利用WL营养培养基对所筛得酵母菌进行初步分类,结合26S rDN A测序鉴定,除1株为Hanseniaspora opuntiae,另外5株均为Wickerhamomyces anomalus。其中DTM9(W. anomalu)和DKT11(H. opuntiae)发酵芒果酒的气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析结果表明,与芒果清汁相比,DTM9发酵的芒果酒中,酯类物质含量增加了51.63%,种类增加了400%;醇类物质含量增加28.37%,种类增加了27.27%;DKT11发酵的芒果酒中酯类物质含量增加了44.27%,种类增加了433%;醇类物质含量增加了34.17%。综合比较理化指标和感官分析结果,DTM9具有更高的糖利用率,且发酵的芒果酒感官品质更优良,对提高芒果酒的香气质量有重要意义。
芒果;酵母菌;分离鉴定;26S rDNA;挥发性成分
芒果被世界卫生组织称为十大最佳水果之一[1]。由于其含有丰富的营养成分,受到人们的广泛喜爱,在世界80多个国家地区生产[2-3]。在我国,仅2011年芒果产量就达到100.34万t,总产值达38.9亿元[4]。然而,我国芒果的销售主要集中在中、低档市场,以鲜食为主[5],并且在采摘、运输与贮藏过程中极易因机械损伤和微生物浸染等造成其腐烂变质,影响其品质,极大地限制了芒果的流通性[6]。另外,在芒果的主产区,随着芒果种植面积的不断扩大,种植区域无法消耗大量的鲜芒果,导致大量的芒果腐烂变质而被废弃,不仅造成了资源的浪费和环境的污染,同时给广大果农带来巨大的经济损失[7-9]。由于芒果中可溶性固形物含量为16%~20%,含糖量高达17%~20%,适合进行果酒发酵[10-12],因此,改善日益严重的芒果资源浪费现状的途径之一就是利用成熟的果酒酿造技术进行芒果酒发酵,提高芒果的经济价值和利用率,维护果农利益,促进芒果产业健康发展。国内关于芒果酒酿造的报道都是利用商业酵母作为发酵菌株,而利用来源于芒果的酵母菌进行芒果酒酿造还未见报道。
本研究以芒果的果皮作为分离源进行酵母菌的分离与纯化,经过三级筛选得到适合酿造芒果酒的酵母。通过WL营养培养基对菌株的形态进行观察及初步分类,结合26S rDNA测序和系统发育树的构建对筛选菌株进行种属鉴定。然后,分别将其用于芒果酒发酵,通过对不同菌株发酵的芒果酒香气分析与感官评定筛选出性能优良的菌株并对其产香特性进行研究。
1 材料与方法
1.1材料与培养基
于2013年7—9月从云南省丽江市华坪县采摘成熟度良好的凯特、热农、海顿、汤米4个品种的芒果,装入无菌袋中迅速带回实验室20℃控温保藏一周后熟。
YPD培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L(固体培养基加入琼脂粉20 g/L)。2,3,5-氯化三苯四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)培养基[13]:由上层培养基与下层培养基组成。其中TTC上层培养基:TTC 0.5 g/L、葡萄糖5 g/L、琼脂15 g/L、现配现用;TTC下层培养基:葡萄糖10 g/L、蛋白胨2 g/L、酵母膏1.5 g/L、磷酸氢二钾1 g/L、硫酸镁0.4 g/L、柠檬酸0.3 g/L、琼脂30 g/L。芒果汁培养基:以芒果为原料制备的清汁,糖度为16 °Brix,100℃灭菌30 min。
1.2仪器与设备
DPX-9002B-1恒温培养箱上海福玛实验设备有限公司;pHS-3C酸度计上海虹益仪器厂;WYT阿贝折光仪泉州中友光学仪器有限公司;JA2003电子天平上海精密科学仪器有限公司;HC-3018R高速冷冻离心机安徽中科中佳科学仪器有限公司;PTC0200聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;Trace DSQ相色谱-质谱联用仪美国热电公司。
1.3方法
1.3.1酵母菌的分离与纯化
在无菌条件下,分别取后熟完全的4个不同品种芒果果皮各10 g至盛有90 mL YPD液体培养基的250 mL三角瓶中,28℃、150 r/min摇床培养2~3 d。取1 mL培养液至9 mL无菌生理盐水中摇匀,依次梯度稀释,分别取合适梯度稀释培养液100μL涂布于添加0.5%硫酸链霉素的YPD培养基平板上,28℃恒温培养2~4 d。挑取具有典型酵母菌落特征的单菌落进行多次平板划线,直至完全纯化。将纯化后的酵母菌种转接到YPD斜面培养基上,28℃培养2~4 d后,置于4℃冰箱保存。
1.3.2酵母菌的筛选
1.3.2.1酵母菌的初筛
将分离纯化的菌株活化后以6%的接种量接入YPD液体培养基中,于28℃、150 r/min摇床培养2 d。由8位有品评经验的品评员(男性4名,女性4名)组成的感官评定小组对各菌株发酵液的气味效果进行评价,淘汰发酵液气味不愉悦和明显异于正常酿酒酵母发酵液气味(有明显的酸味、臭味、刺鼻性气味)的发酵菌株。
1.3.2.2酵母菌的三级筛选
一级筛选为利用TTC显色法对初筛所得酵母菌株的产酒精能力进行测定[14]。挑取红色菌落进入二级筛选。
二级筛选为利用杜氏管法通过观察并记录杜氏小管内菌株的产气量对酵母菌株的起酵速度与发酵能力进行筛分。将一级筛选得到的菌株进行活化,以10%的接种量接入附有杜氏小管的芒果汁培养基中,在28℃恒温箱中静置培养2 d。每隔12 h观察并记录杜氏小管内的气体高度。选取起酵速度快且发酵能力强的菌株进入三级筛选[15]。
三级筛选为利用杜氏管对酵母菌株在特定酒精度、糖度、SO2质量浓度芒果汁中的耐受性进行筛分。将自然糖度为16 °Brix的芒果汁培养基分别进行如下处理:1)加入无水乙醇使芒果汁中无水乙醇体积分数分别为5%、8%、10%;2)加入偏重亚硫酸氢钾使芒果汁中SO2质量浓度为100 mg/L;3)加入蔗糖使芒果汁中糖度为20 °Brix。将二级筛选得到的菌株进行活化后以10%的接种量分别接入上述处理的芒果汁培养基中,以未做处理的16 °Brix芒果汁培养基为对照,于28℃恒温箱中静置培养2 d。每隔2 h观察并记录杜氏小管内的气体高度。挑选对乙醇、糖、SO2耐受性好的菌株作为入选菌株。
1.3.3菌落形态初分[16]
将筛选得到的菌株接入YPD液体培养基中,28℃摇床活化24 h后,划线转接于WL营养培养基。28℃恒温培养数天,观察记录各个菌落的形态与颜色。根据平板内菌落的形态和颜色对所得菌株进行形态初分。
1.3.4筛选菌株的分子生物学鉴定
采用26S rDNA D1/D2区序列分析对三级筛选得到的酵母菌株进行分子生物学鉴定[17]。
1.3.4.1测序菌株的DNA提取
采用OMEGA公司的E.Z.N.A.酵母DNA提取试剂盒,按其说明书方法进行测序菌株的DNA提取。
1.3.4.2菌株26S rDNA D1/D2区域的PCR扩增
PCR扩增引物为:通用引物NL1(5’-GCATATCAAT AAGCGGAGGAAAAG-3’)与NL4(5’-GGTCCGTG TTTCAAGACGG-3’)。
PCR反应体系(50μL):DNA模板2μL,引物(NL-1/NL-2)各1μL,Premix Taq酶25μL,二甲基亚砜2.5μL,灭菌超纯水18.5μL。
PCR循环程序为:94℃预变性5 min;94℃变性1 min;52℃退火1 min;72℃延伸1 min,35个循环;72℃延伸5 min。
1.3.4.3 DNA测序
用1.0%的琼脂糖凝胶电泳确定PCR产物,将PCR所得产物送至北京华大基因科技股份有限公司测序。26S rDNA D1/D2区扩增产物的测序引物为NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和NL4(5’-GGTCCGTGTTTCAAGACGG-3’)。
1.3.5 26S rDNA序列比对及系统发育树构建
将测序所得26S rDNA片段的基因序列与GenBank在线数据库中区域序列进行BLASET比对,并利用Mega 5.1软件构建系统发育树[18]。
1.3.6芒果酒的发酵和果酒感官及香气成分分析
芒果酒加工工艺:芒果打浆→0.14%果胶酶,40℃水浴3 h→ 4 000×g离心5 min→芒果清汁调糖→28℃主发酵7 d→后发酵和陈酿→低温放置→芒果酒[19]。
感官评定采用百分制法,感官评定小组由有品评经验的品评员共17人(男性9名,女性8名)组成,参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[20]与GB/T 10220—2012《感观分析方法学总论》[21]相关内容,进行独立品评,分别从色泽(10分)、透明度(10分)、香气(30分)、滋味(30分)、典型性(20分)5个方向评分。酒样的评定分数为各感官评定人员的各项评分均值之和,并以芒果清汁作为对照。同时,根据GB/T 15038—2006对芒果酒基本理化指标进行检测,利用顶空固相微萃取-气相色谱-质谱联用(solid-phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)进行芒果酒香气成分的分析[22]。
色谱条件:色谱柱为DB-Wax弹性石英毛细管柱(30 m×0.52 mm,1μm),程序升温40℃,保持2.5 min,以6℃/min升温至230℃,保持7 min;进样口温度250℃,传输线温度230℃,载气为He,流速1.0 nL/min,采用不分流进样。
质谱条件:电离方式EI,70 eV;离子源温度200℃,质量扫描范围为35~400 amu;发射电流100μA,检测电压1.4 kV。
1.4数据统计分析
GC-MS测定出的总离子流图谱利用随机Xcalibur工作站NIST2008标准谱库自动检索各组分质谱数据,同时与NIST Library和Wiley Library相匹配,仅当匹配度和纯度大于800的结果才进行报道。以2-辛醇为内标物质,按峰面积归一化法计算各组分相对含量[23]。本研究中每组实验进行3次平行实验,实验数据以±s表示。
2 结果与分析
2.1酵母菌的分离与纯化结果
从芒果果皮中分离得到具有典型酵母菌落特征的菌株共60株。对菌株进行编号,其中凯特芒果中分离得到13株,分别编号为DKT1~DKT13;热农芒果中分离得到18株,分别编号为DRN1~DRN18;海顿芒果中分离得到15株,分别编号为DHD1~DHD15;汤米芒果中分离得到14株,分别编号为DTM1~DTM14。
2.2酵母菌的筛选结果与分析
2.2.1初筛结果
通过初筛,排除发酵液气味明显异于正常酿酒酵母发酵液气味的22株酵母菌,保留38株菌株。通过TTC显色反应筛选出18株菌落颜色为红色或深红色的菌株。部分菌株的显色分类结果见图1。
图1 酵母菌株在TTC培养基中的显色结果Fig.1 Yeast strains cultured in TTC chromogenic medium
2.2.2酵母菌的二级筛选结果
将18株初筛得到的菌株在附有杜氏小管的芒果汁培养基中培养,观察产气情况,结果见表1。发酵12 h后,有3株菌株没有明显的产气情况,分别为DTM3、DRN9及DRN12,而DTM9的产气量为杜氏小管体积的1/2,DTM1、DTM2的产气量已达到杜氏小管体积的3/4,其余菌株也均已开始产气。24 h后,有11株菌株的产气量充满或近似充满杜氏小管;48 h后,共有13株菌株的产气量完全充满杜氏小管。筛除12 h还未开始明显发酵以及48 h后产气还未充满杜氏小管的酵母菌株共5株,得到13株菌株进行后续筛选。

表1 酵母菌株在芒果汁培养基中的产气情况Table 1 Gas production situation of yeast strains in mango juice medium
2.2.3酵母菌的三级筛选结果

表2 不同条件下酵母菌株的起酵时间Table 2 Fermentation starting time of yeast strains in different conditions
菌株在不同条件芒果汁培养基中培养的起酵时间如表2所示,培养48 h后的产气情况如表3所示。由表2可知,与对照组相比,100 mg/L的SO2质量浓度条件下,除DKT11、DTM1、DTM7、DHD14这4株菌株的起酵时间不变外,其余菌株的起酵时间均推迟2 h或4 h;在20 °Brix的糖度条件下,有4株菌株起酵时间推迟了2 h,DRN10菌株推迟了4 h,DTM7菌株推迟了8 h,其余菌株没变化。酒精度变化使大部分菌株起酵时间受到影响,尤其在酒精度10%条件下,所有菌株的起酵时间均受到了影响,DTM7、DKT6、DKT8、DKT11菌株的起酵时间推迟12 h以上,而DTM1、DRN10、DKT7不能耐受8%以上酒精含量。

表3 不同条件下酵母菌株的产气情况Table 3 Gas production situation of yeast strains in different conditions
由表3可知,与对照组相比,20 °Brix糖度和100 mg/L SO2质量浓度条件下,各菌株产气量未受影响或受到的影响不大。而5%酒精度条件下,DHD6、DHD14、DRN10、DKT7、DKT8只有微弱的产气现象。酒精度8%与10%条件下,大部分菌株的产气受到明显的抑制。
综合起酵时间与产气量结果考虑,各菌株在不同条件下的耐受性差别较大。随着酒精度的增加,各菌株的起酵时间与产气量均受到了很大的影响。对20 °Brix糖度耐受性较差的菌株为DTM7,对100 mg/L SO2耐受性较差的菌株为DHD14,对5%酒精度耐受性较差的菌株为DTM7、DKT8、DHD6、DHD14、DRN10、DKT7,对8%酒精度耐受性较差的菌株为DTM7、DRN10、DKT8、DTM1、DKT7。绝大部分菌株不能耐受10%酒精度。综合考虑,通过三级筛优选的菌株为DHD8、DRN6、DTM2、DTM9、DKT6与DKT11共6株菌株。
2.3酵母菌株菌落形态

表4 WL营养培养基鉴别结果Table 4 Identification of yeasts in WL culture medium
对筛选所得6株酵母菌株进行WL营养培养基培养,所得结果如表4所示。通过菌落形态和颜色观察,初步判定DRN6、DKT6、DHD8这3株菌亲缘关系较近,菌株DTM2和DTM9的亲缘关系较近。而DKT11菌株的菌落形态及颜色与其余5株菌株完全不同,判断其亲缘关系较远。
2.4 26S rDNA序列同源性分析及系统发育树的建立
利用BLAST工具,将所筛选菌株测序结果与GenBank中已知标准菌株的26S rDNA序列进行比对,比对结果见表5。运用Neighbor-Joining法构建的系统发育树如图2所示。结果表明,菌株DKT11与H. opuntiae的亲缘关系最近(100%)。其余菌株与W. anomalus的亲缘关系最近(99%)。确定菌株DKT11是H. opuntiae,其余菌株均为W. anomalus。

表5 分离菌株与GenBank参考菌株的比对结果Table 5 Similarity of isolates with the reference strains from GenBank

图2 芒果果皮酵母分离株26S rDNA序列系统发育树Fig.2 Phylogenic tree based on the 26S rDNA sequences of yeasts from mango peel
2.5芒果酒酿造
由各菌株26S rDNA序列测序结果可知,DHD8、DRN6、DTM2、DKT6、DTM9亲缘关系一致,都属于W. anomalus,而DKT11为H. opuntiae。因此,从5株W. anomalus中随机挑选DTM9菌株与汉逊酵母DKT11菌株作为出发菌株酿造芒果酒。分别测得两株菌株发酵芒果酒的各项理化指标及感官得分,结果如表6所示。并进一步通过GC-MS对芒果原汁及DTM9、DKT11菌株所酿造的芒果酒中挥发性香气成分进行检测。总离子流谱图分别如图3~5所示。按照1.4节数据分析方法得出3种样液中各挥发性香气成分的相对含量,其中主要挥发性香气物质含量的比较结果如表7所示。

表6 芒果酒的理化指标及感官评分结果Table 6 Chemical and sensory analysis of mango wine
由表6可知,两种芒果酒样中可溶性固形物及总糖含量与芒果原汁相比均有明显的减少,说明DKT11和DTM9酵母都适合利用芒果汁进行发酵,DTM9发酵的芒果酒样酒精度为4.5%左右,但是DTM9菌株具有更高的糖利用率,并且感官评分更高,说明DTM9菌株酿造的芒果酒具有更好的风味与口感。

图3 芒果原汁SPME-GC-MS总离子流图Fig.3 SPME-GC-MS total ion current of aroma components in mango juice
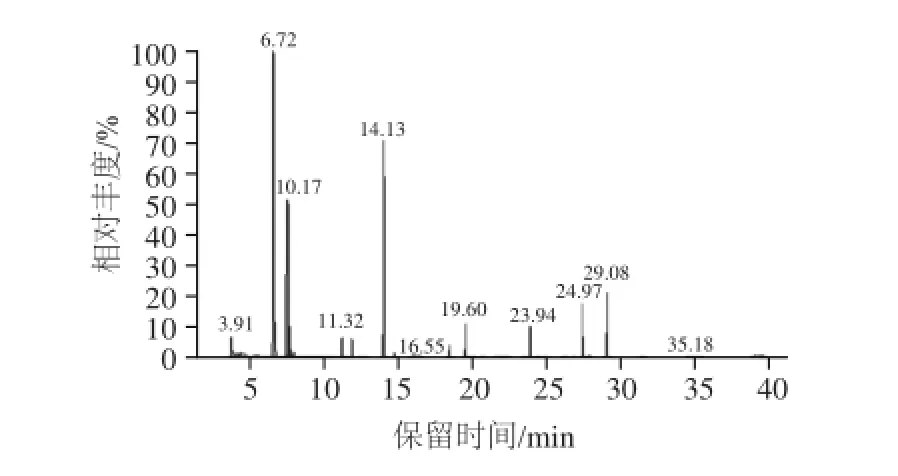
图4 DKT11芒果酒SPME-GC-MS总离子流图Fig.4 SPME-GC-MS total ion current chromatogram of aroma components in mango wine fermented by DKT11

图5 DTM9芒果酒SPME-GC-MS总离子流图Fig.5 SPME-GC-MS total ion current chromatogram of aroma components in mango wine fermented by DTM9

表7 各样液中主要挥发性香气物质含量的比较Table 7 Major volatile compounds of mango wine
果酒中对香味贡献最大的成分是醇类物质、酯类物质以及酸类物质[24],根据GC-MS检测结果,从芒果酒发酵前后主要挥发性香气成分种类及含量的变化(表7)可知,相较于发酵前,两种不同种酵母发酵后的芒果酒中,酯类物质、醇类物质的种类及含量都有很大提高。其中DTM9酵母酿造的芒果酒中酯类物质从3种增加到15种,种类增加了400%,含量增加了51.63%;醇类物质含量增加了28.37%,种类增加了27.27%。DKT11酵母酿造的芒果酒酯类物质含量增加了44.27%,种类增加了433%;醇类物质含量增加了34.17%。此外,DTM9菌株发酵芒果酒香味成分中的桃金娘烯醇、金合欢醇、香叶醇赋予了芒果酒独特的风味和口感[25]。结合两种酵母发酵芒果汁的理化指标及感官评价可知,DTM9菌株有望开发成适合酿造低醇芒果甜酒的新型专用酵母。
3 结 论
从芒果果皮中共分离得到6株适合芒果汁发酵的酵母菌,通过26S rDNA序列的同源性分析和系统发育树的构建,确定其中1株为H. opuntiae,其余5株均为W. anomalus。目前国内关于芒果酒酿造的报道主要集中于工艺的研究[6-7],而以芒果为分离源得到适合酿造芒果酒的本土酵母的研究还未见报道。本研究以芒果作为来源分离酵母菌株,并将其应用于芒果酒发酵,得到口感及风味良好的低醇果酒。
利用分离得到的DTM9(W. anomalu)和DKT11(H. opuntiae)进行发酵,对发酵液的理化指标、感官品质及GC-MS的检测结果表明,DTM9发酵的芒果酒中酯类物质含量增加了51.63%,种类增加了400%;醇类物质含量增加了28.37%,种类增加了27.27%。DKT11发酵的芒果酒中酯类物质含量增加了44.27%,种类增加了433%;醇类物质含量增加了34.17%。相较之下,DTM9比DKT11具有更高的糖利用率,且发酵所得芒果酒感官品质更优良。
本实验筛选所得酵母菌的糖利用率虽略低于普通酿酒酵母,但发酵所得芒果酒的香气成分丰富,感官品质优良,有望开发成为低醇甜型芒果酒发酵的新型专用酵母。此外,也为与酿酒酵母混菌发酵获得醇、香兼备的芒果酒提供了理论依据,为芒果酒产业的发展提供了新的思路。
[1]李日旺,黄国弟,苏美花.我国芒果产业现状与发展策略[J].南方农业学报, 2013, 44(5): 875-878.
[2]罗学兵.芒果的营养价值、保健功能及食用方法[J].中国食物与营养, 2011, 17(7): 77-79.
[3]李华丽,魏仲珊,邓萍.芒果及其加工制品研究进展[J].农产品加工:学刊, 2012(10): 113-116.
[4]张正科,高兆银,李敏,等.食品添加剂对芒果采后病原菌及保鲜效果的影响[J].热带作物学报, 2013, 34(11): 2289-2294.
[5]尼章光,解德宏,俞艳春,等.云南芒果产业现状及对策[J].热带农业科学, 2009, 29(6): 52-56.
[6]李家洲.风味芒果果酒生产工艺研究[J].中国酿造, 2007, 26(2): 67-69.
[7]罗小杰,韦虎.芒果酒的研制[J].中国酿造, 2007, 26(5): 89-90.
[8]李丽,盛金凤,孙健,等.芒果加工新技术及综合利用研究进展[J].食品工业, 2014, 35(6): 223-226.
[9]赖必辉,毕金峰,庞杰.芒果加工技术研究进展[J].食品与机械, 2011, 27(3): 152-155.
[10] LI Xiao, YU Bin, CURRAN P, et al. Impact of twoWilliopsisyeast strains on the volatile composition of mango wine[J]. International Journal of Food Science and Technology, 2012, 47(4): 808-815.
[11] KUMAR Y S, PRAKASAM R S, REDDY O V S. Optimisation of fermentation conditions for mango (Mangifera indica L.) wine production by employing response surface methodology[J]. International Journal of Food Science and Technology, 2009, 44(11): 2320-2327.
[12] REDDY L V A, REDDY O V S. Production and characterization of wine from mango fruit (Mangifera indicaL.)[J]. World Journal of Microbiology & Biotechnology, 2005, 21(8): 1345-1350.
[13]赵祥杰,杨荣玲,肖更生.桑椹果酒专用酵母的筛选及鉴定[J].中国食品学报, 2008, 8(1): 60-66.
[14]王梅,张澎湃,帅桂兰,等. TTC在黄酒酵母选育中的应用[J].酿酒, 2001, 28(5): 62-64.
[15]金磊,董文宾,张丹,等.梨酒酵母的筛选及鉴定[J].食品工业科技, 2012, 33(10): 231-249.
[16]杨雪峰,苏龙,刘树文.利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J].中外葡萄与葡萄酒, 2006(4): 4-7.
[17]叶萌祺,袁亚宏,岳田利,等.产香酵母分离鉴定与苹果酒发酵中的应用[J].农业机械学报, 2013, 44(12): 187-192.
[18] TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[19]曾少敏,刘雁然,翁明辉.芒果酒的研制[J].食品与机械, 2000, 16(5): 22-23.
[20]中国食品发酵工业研究所,烟台张裕葡萄酿酒股份有限公司,中国长城葡萄酒有限公司,等. GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社, 2006.
[21]中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量监督检验测试中心. GB/T 10220—2012感观分析方法学总论[S].北京:中国标准出版社, 2012.
[22] REDDY L V A, KUMAR Y S, REDDY O V S. Analysis of volatile aroma constituents of wine produced from Indian mango (Mangifera indica L.) by GC-MS[J]. Indian Journal of Microbiology, 2010, 50(2): 183-191.
[23]徐亚男,刘秋萍,李琦. GC-MS对非酿酒酵母菌发酵赤霞珠葡萄酒香气成分的检测[J].中国酿造, 2014, 33(6): 135-139.
[24] PINO J A, QUERIS O. Analysis of volatile compounds of mango wine[J]. Food Chemistry, 2011, 125(4): 1141-1146.
[25]商敬敏,牟京霞,刘建民. GC-MS法分析不同产地酿酒葡萄的香气成分[J].食品与机械, 2011, 27(5): 52-57.
Isolation and Identification of Yeasts in Mango from Yunnan and Their Application in Mango Wine Fermentation
CEN Tao, YUE Tianli*, YUAN Yahong, DING Xu, WANG Huxuan, SONG Jing
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
This experiment collected the peels of 4 mango varieties from Yunnan province of China as sources of yeasts. After separation, purificationand tertiary screening, 6 yeasts suitable for mango juice fermentation were obtained. The phylogenetic tree based on 26S rDNA sequence analysis was constructed for determining the genetic location. The isolate DKT11 was identified asHanseniaspora opuntiae, whereas 5 other isolates were identified asWickerhamomyces anomalus. DKT11 and DTM9 were subjected to further analysis. Physicochemical indexes and sensory evaluation showed that the two strains had good fermentation performance in mango juice to produce high-quality mango wines. The volatile aroma composition of the mango wines was analyzed by GC-MS. The results showed that the kinds and amounts of volatile aroma compounds in the wines were significantly improved when compared with those in mango juice. Specifically, the numbers of ester and alcohols in the wine fermented by DTM9 were increased by 400%and 27.27%, respectively, and the amounts of the two groups of compounds were elevated by 51.63%and 28.37%, respectively. The amount of ester and alcohols in the wine fermented by DKT11 was increased by 44.27%and 34.17%, respectively, and the number of esters was raised by 433%. Overall, these findings showed DTM9 had a higher sugar utilization rate and yielded a mango wine with better sensory quality, emphasizing its significance for improving the aroma quality of mango wine.
mango; yeast; isolation and identification; 26S rDNA; volatile compounds
TS261. 1
1002-6630(2015)11-0119-06
10.7506/spkx1002-6630-201511023
2014-08-14
“十二五”国家科技支撑计划项目(2012BAD31B01)
岑涛(1989—),女,硕士研究生,主要从事发酵工程研究。E-mail:centv1215@163.com
*通信作者:岳田利(1965—),男,教授,博士,主要从事食品生物技术及食品安全控制研究。E-mail:yuetl@nwsuaf.edu.cn
