植物乳杆菌分子伴侣蛋白基因在盐胁迫下的表达分析
2015-01-03乌日娜宋雪飞刘倩颖王茜茜武俊瑞
乌日娜,宋雪飞,刘倩颖,徐 鑫,王茜茜,武俊瑞,*
植物乳杆菌分子伴侣蛋白基因在盐胁迫下的表达分析
乌日娜1,2,宋雪飞1,刘倩颖1,徐 鑫1,王茜茜1,武俊瑞1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
以一株分离筛选自东北自然发酵大酱中的耐盐植物乳杆菌FS5-5为实验对象,通过实时荧光定量聚合酶链式反应技术,在转录水平上对其分子伴侣蛋白的相应基因在盐胁迫下的表达进行研究。结果表明:在菌体对数生长期,分子伴侣蛋白调控系统中,基因groEL、groES、dnaK、dnaJ、hsp1、hsp2、usp均受MRS培养基中NaCl的诱导而表达上调,并且NaCl的质量浓度越高,基因受诱导表达上调越显著,而hsp3虽受MRS培养基中NaCl的诱导表达有所上调,但其受诱导表达上调显著程度与NaCl质量浓度不呈正相关。
植物乳杆菌;实时荧光定量聚合酶链式反应;盐胁迫;基因表达
植物乳杆菌是乳酸杆菌的一种短杆菌,菌体成对或成链状排列分布,不产芽孢,厌氧或兼性厌氧,革兰氏阳性菌,最适pH值为6.5左右[1]。植物乳杆菌是公认的益生菌,植物乳杆菌代谢产物中,除氨基酸、短肽、乳酸外,还有多种有机酸、过氧化氢、细菌素、双乙 酰等诸多天然抑菌物质[2]。植物乳杆菌具有诸多生理功能,包括:营养作用、改善胃肠道功能、抗肿瘤作用、增强机体免疫力、降低胆固醇、平衡泌尿生殖系统菌群[3-4]。
在乳酸菌制品生产加工过程中,会经历高温杀菌、喷雾干燥等高温处理环节,这些处理会对菌体本身产生不同程度的迫害作用。热应激反应所涉及的主要蛋白质是分子伴侣蛋白(molecular chaperon),例如GroEL/GroES、DnaK、DnaJ,以及蛋白酶(如HtrA、FtsH、Clp)。这类蛋白质的基因在菌体处于正常生长环境中时不表达或表达受抑制,但当菌体受到热或外界环境变化时,则会被激活而表达以保护菌体细胞[5]。盐胁迫对菌体有很大的影响,例如盐胁迫所引起的环境渗透压的突然增加,使细胞内的水分外流,引起细胞膨压的损失,改变胞内溶质的浓度和细胞体积[6]。
盐胁迫对益生嗜酸乳杆菌、德氏乳杆菌保加利亚亚种菌体、益生乳酸杆菌都有一定的影响[7-9]。目前,很多关于渗透压胁迫的研究主要关注的是渗透压上升后,立即通过积累相容性溶质的方式来恢复膨压。然而,关于盐胁迫下蛋白基因的表达情况的信息是有限的。热应激蛋白是普遍存在于所有种类生物中的分子伴侣蛋白,为了保护菌体细胞,热应激蛋白很有可能会对盐胁迫造成的高渗透压环境做出应激反应。在研究这些蛋白质在盐胁迫中的重要性时,实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,real time-PCR)技术成为重要的技术工具[10]。
植物乳杆菌是在食品及其他领域应用最为广泛的发酵微生物,研究其发酵机理并对其发酵条件进行优化具有重要的实践意义。本实验以一株分离自东北自然发酵大酱样品中的具有耐盐特性的植物乳杆菌FS5-5[11]为实验菌株,并对其在NaCl质量浓度分别为0、3、6、9 g/100 mL 4 个梯度下,生长至对数生长期的分子伴侣蛋白相关基因的表达进行了研究,以期为进一步开发耐盐性发酵菌种提供依据。
1 材料与方法
1.1 材料与试剂
菌种:从东北自然发酵大酱中分离筛选出一株耐盐的植物乳杆菌FS5-5。
液体Man, Rogosa and Sharp(MRS)培养基(100 mL):牛肉浸膏0.8 g、蛋白胨1 g、酵母粉0.4 g、无水乙酸钠0.3 g、葡萄糖2 g、吐温-80 0.1 g、K2HPO40.2 g、MgSO4·7H2O 0.058 g、柠檬酸钠0.2 g、MnSO4·H2O 0.019 g、蒸馏水100 mL。
RNAprep Pure培养细胞/细菌总RNA提取试剂盒、TIANScript cDNA第一链合成试剂盒、Real Master Mix(SYBR Green)荧光定量PCR试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
DNP-9080型生化培养箱 上海振宇化工科技有限公司;CR-21G型高速冷冻离心机 日本日立公司;5418R小型台式冷冻离心机 上海研谨生物科技有限公司;NANODROP 8000浓度仪 美国热电集团;ABI 7500 Fast实时荧光定量PCR仪 美国应用生物系统公司;LDZX-50KBS型立式压力蒸汽灭菌锅 河南兄弟仪器设备有限公司。
1.3 方法
1.3.1 菌体收集
MRS培养基中NaCl的质量浓度分别为0、3、6、9 g/100 mL,分别取5 mL于若干试管中,盖上试管塞,121 ℃灭菌20 min。待试管中培养基冷却到室温后,在无菌操作台上,于无菌条件下用移液枪分别吸取100 ☒L活化二代的菌液于上述各盐质量浓度试管中。于37 ℃恒温箱中培养,分别于接种后第8、10、10、12小时收集对数期菌体。
1.3.2 提取总RNA
按照天根生化科技(北京)有限公司RNAprep Pure培养细胞/细菌总RNA提取试剂盒说明书提取菌体总RNA。
1.3.3 合成cDNA第一链
按照天根公司TIANScript cDNA第一链合成试剂盒说明书合成cDNA第一链。
1.3.4 引物设计与合成方法
本实验确定管家基因为16S rRNA,目的基因为热激蛋白调控系统(groEL、groES、dnaK、dnaJ、hsp1、hsp2、hsp3、usp)。在GenBank网站查询全部管家基因和目的基因的序列,引物设计软件为Primer 5。引物送上海百力格生物技术有限公司合成。管家基因和目的基因的引物见表1。

表1 实时荧光定量PCR引物Table 1 Primers for quantitative PCR
1.3.5 real time-PCR扩增实验
按照天根生化科技(北京)有限公司Real Master Mix(SYBR Green)荧光定量PCR试剂盒进行荧光定量PCR实验。
PCR反应体系(20 μL):荧光染料混合液9 μL、cDNA模板2 μL、正向引物2 μL、反向引物2 μL、超纯水5 μL。
PCR扩增条件:变性:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 33 s,68℃ 34 s,循环40 次;熔解曲线:95 ℃ 30 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。
1.4数据分析
作图软件为Excel,用软件SPSS 19.0进行单因素方差分析。
2 结果与分析
2.1 MRS培养基中的NaCl对基因groEL、groES、dnaK、dnaJ表达的影响
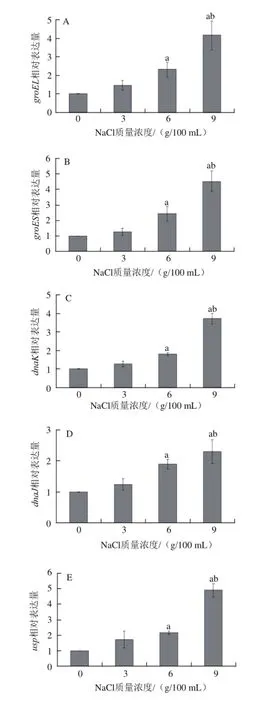
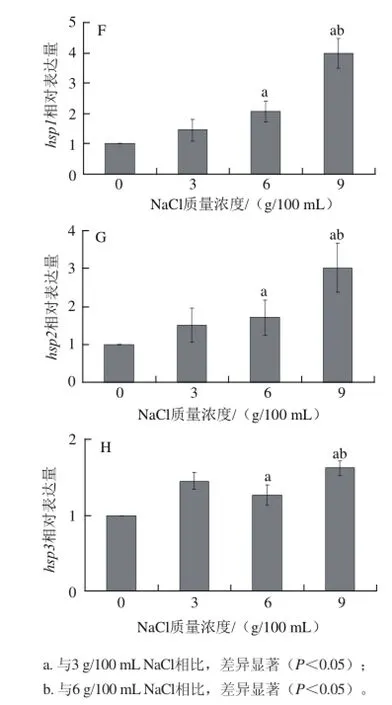
图1 1基因ggrrooEELL、groES、dnaK、dnaJ、uusspp、hsp1、hsp2、hsp3受NaCl诱导表达情况Fig.1 Expression of genes induced by NaCl
由图1A~1D可以看出,随着NaCl质量浓度的增加,基因groEL、groES、dnaK、dnaJ受诱导程度也随之增加。与NaCl质量浓度为0 g/100 mL比较,在含有3 g/100 mL NaCl MRS培养基中受到诱导,表达上调;与NaCl质量浓度为0 g/100 mL比较,在含有6 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3 g/100 mL比较,表达差异显著(P<0.05);与NaCl质量浓度为0 g/100 mL比较,在含有9 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3、6 g/100 mL比较,表达差异显著(P<0.05)。
Kilstrup等[12]的研究表明,对于乳酸乳球菌,大多数盐胁迫诱导蛋白也被热胁迫所诱导。分子伴侣蛋白DnaK、GroEL和GroES受2.5 g/100 mL NaCl的诱导,表达上调了5~9 倍。Meury等[13]对大肠杆菌的研究表明,30 ℃添加NaCl条件下,K+吸收和去质壁分离过程中,DnaK蛋白质水平大幅度增加。他们从一株野生型大肠杆菌分离出蛋白,利用免疫印迹法对DnaK蛋白质水平进行分析,发现在添加NaCl后1~5 min时间里,DnaK蛋白质水平上升了2~3 倍。蛋白质的稳定增长反映了合成速率的大幅度增长。根据以上研究,乳酸乳球菌和大肠杆菌的分子伴侣蛋白基因在盐胁迫下将会表达上调,使分子伴侣蛋白的合成量增加。本实验中,对于植物乳杆菌,分子伴侣蛋白基因groEL、groES、dnaK、dnaJ也受NaCl的诱导而表达上调,并且NaCl的质量浓度越高,基因受诱导表达上调越显著,可见这些基因的诱导表达程度与NaCl质量浓度呈正相关。
2.2 MRS培养基中的NaCl对基因usp表达的影响
由图1E可知,随着NaCl质量浓度的增加,基因usp受诱导程度也随之增加。与NaCl质量浓度为0 g/100 mL比较,在含有3 g/100 mL NaCl MRS培养基中受到诱导,表达上调;与NaCl质量浓度为0 g/100 mL比较,在含有6 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3 g/100 mL比较,表达差异显著(P<0.05);与NaCl质量浓度为0 g/100 mL比较,在含有9 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3、6 g/100 mL比较,表达差异显著(P<0.05)。
Usp为通用应激蛋白(universal stress protein),通常被好几种胁迫诱导,参与DNA或蛋白质修复[14]。在不利的环境压力下,Usps的产量增加,并且通过一系列的机制来帮助微生物生存[15]。黄桂东[16]应用蛋白质组学技术,对乳酸菌Lactobacillus brevis NCL912在酸胁迫下菌体蛋白质的变化进行了研究,结果表明:酸胁迫诱导通用应激蛋白UspA表达上调。宋维志等[17]的研究表明,当培养基盐度高于最适盐度时,无论温度高低,南极适冷菌Psychrobacter sp.G的一个通用应激蛋白(USP)基因usp1141的表达均会提高。本实验中,对于植物乳杆菌,分子伴侣蛋白基因usp也受NaCl的诱导而表达上调,因此蛋白Usp的产量增加,以便更好地起到修复蛋白的作用。并且NaCl的质量浓度越高,基因受诱导表达上调越显著,可见基因usp的诱导表达程度与NaCl质量浓度呈正相关。
2.3 MRS培养基中的NaCl对基因hsp1、hsp2、hsp3表达的影响
由图1F、1G可知,随着NaCl质量浓度的增加,基因hsp1、hsp2受诱导程度也随之增加。与NaCl质量浓度为0 g/100 mL比较,在含有3 g/100 mL NaCl MRS培养基中受到诱导,表达上调;与NaCl质量浓度为0 g/100 mL比较,在含有6 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3 g/100 mL比较,表达差异显著(P<0.05);与NaCl质量浓度为 0 g/100 mL比较,在含有9 g/100 mL NaCl MRS培养基中受到诱导,表达上调,且与NaCl质量浓度为3、6 g/100 mL比较,表达差异显著(P<0.05)。
由图1H可知,随着NaCl质量浓度的增加,基因hsp3受诱导程度并没有呈规律性变化。与NaCl质量浓度为0 g/100 mL比较,基因hsp3在含有3 g/100 mL NaCl MRS培养基中受到诱导,表达上调;与NaCl质量浓度为0 g/100 mL比较,基因hsp3在含有6 g/100 mL NaCl MRS培养基中受到诱导,表达上调;与NaCl质量浓度为0 g/100 mL比较,基因hsp3在含有9 g/100 mL NaCl MRS培养基中受到诱导,表达上调。
Hsp1、Hsp2、Hsp3为小热激蛋白sHsp。小热激蛋白以动态低聚物的复合物形式存在,并且有多种生物学功能[18]。小热激蛋白与大分子质量热激蛋白,都具有分子伴侣作用,能修复蛋白质、阻止蛋白质错误折叠[19-21],但仍然缺乏对其统一分子机制的理解[22]。Yeh等[23]的研究表明,重组的大肠杆菌细胞表达了一种大小为16.9 kD的小热激蛋白Oshsp16.9后,耐热性增强。本实验中,对于植物乳杆菌,分子伴侣蛋白基因hsp1、hsp2也受NaCl的诱导而表达上调,因此蛋白Hsp1、Hsp2的产量增加,以便更好地起到修复蛋白的作用。并且NaCl的质量浓度越高,基因受诱导表达上调越显著,可见基因hsp1、hsp2的诱导表达程度与NaCl质量浓度呈正相关。然而基因hsp3虽受NaCl诱导表达上调,但诱导表达程度与NaCl质量浓度的关系不呈正相关。环境渗透压的升高,影响蛋白质的生物活性、结构和功能[24-25],基因hsp3结构本身及其表达的蛋白Hsp3可能也受渗透压的影响,但具体机理有待进一步的研究。
3 结 论
分子伴侣蛋白基因groEL、groES、dnaK、dnaJ、hsp1、hsp2、usp、hsp3受到NaCl胁迫时均受到诱导表达上调,分子伴侣蛋白的量提高。环境渗透压的升高,影响蛋白质的生物活性、结构和功能,分子伴侣蛋白通过调节蛋白质修复和折叠作用,从而保护蛋白质的形态、功能特性,这便是分子伴侣蛋白的作用机理。基因groEL、groES、dnaK、dnaJ、hsp1、hsp2、usp的诱导表达程度与NaCl质量浓度呈正相关,即NaCl的质量浓度越高,基因受诱导表达上调越显著。说明这些基因本身及合成的蛋白都能耐受盐胁迫。而基因hsp3面对不同强度的渗透压胁迫时,虽表达均有上调,但变化趋势与NaCl质量浓度不呈正相关。面对高质量浓度NaCl带来的渗透压胁迫,基因hsp3结构本身或其表达的蛋白Hsp3受到了破坏,不能全面发挥其修复蛋白的作用;或者是Hsp3的功能与植物乳杆菌的耐盐性相关性不是很高,但具体机理还有待进一步的研究。
[1] 王水泉, 包艳, 董喜梅, 等. 植物乳杆菌的生理功能及应用[J]. 中国农业科技导报, 2010, 12(4): 49-55.
[2] 靳志强, 王延样. 植物乳杆菌在人体肠道的益生特性[J]. 中国乳品工业, 2007, 35(9): 30-34.
[3] PIEPER R, JANCZYK P, URUBSCHUROV V, et al. Effect of Lactobacillus plantarum on intestinal microbial community composition and response to enterotoxigenic Escherichia coli challenge in weaning piglets[J]. Livestock Science, 2010, 133(1): 98-100.
[4] 张佳程, 骆承庠. 乳酸菌对食品中胆固醇脱除作用的研究[J]. 食品科学, 1998, 19(3): 20-22.
[5] GUCHTE M V D, SERROR P, CHERVAUX C, et al. Stress responses in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 2002, 82(1/4): 187-216.
[6] ANGELIS M D, GOBBETTI M. Environmental stress responses in Lactobacillus: a review[J]. Proteomics, 2004, 4(1): 106-122.
[7] KIM W S, PERL L, PARK J H, et al. Assessment of stress response of the probiotic Lactobacillus acidophilus[J]. Current Microbiology, 2001, 43: 346-350.
[8] GOUESBET G, JAN G, BOYAVAL P. Lactobacillus delbrueckii ssp. bulgaricus thermotolerance[J]. Dairy Science and Technology, 2001, 81: 301-309.
[9] DESMOND C, STANTON C, FITZGERALD G F, et al. Environmental adaptation of probiotic lactobacilli towards improvement of performance during spray drying[J]. International Dairy Journal, 2002, 12(2/3): 183-190.
[10] 张立国, 张琚. 实时定量PCR技术的介绍[J]. 生物技术, 2003, 13(2): 39-40.
[11] 徐鑫, 王茜茜, 王晓蕊, 等. 传统农家大酱中耐盐性乳酸菌的分离与鉴定[J]. 食品与发酵工业, 2014, 40(11): 33-40.
[12] KILSTRUP M, JACOBSEN S, HAMMER K, et al. Induction of heat shock proteins DnaK, GroEL and GroES by salt stress in Lactococcus lactis[J]. Applied and Environmental Microbiology, 1997, 63(5): 1826-1837.
[13] MEURY J, KOHIYAMA M. Role of heat shock protein Dnak in osmotic adaption of Escherichia coli[J]. Journal of Bacteriology, 1991, 173(14): 4404-4410.
[14] VERGES M C, MAGUIN E, MISTOU M Y, et al. Lactic acid bacteria and proteomics: current knowledge and perspectives[J]. Journal of Chromatography B, 2002, 771(1/2): 329-342.
[15] TKACZUK K L, SHUMILIN I A, CHRUSZCZ M, et al. Structural and functional insight into the universal stress protein family[J]. Evolutionary Applications, 2013, 6(3): 434-449.
[16] 黄桂东. Lactobacillus brevis NCL912的耐酸特性及其酸胁迫下差异表达蛋白的研究[D]. 南昌: 南昌大学, 2011.
[17] 宋维志, 林学政, 车帅. 南极适冷菌 Psychrobacter sp. G普遍胁迫蛋白(USP)基因的克隆及其胁迫条件下的应答特征分析[J]. 海洋科学进展, 2013, 31(1): 145-152.
[18] VERTII A, HAKIM C, KOTLYAROV A, et al. Analysis of properties of small heat shock protein Hsp25 in MAPK-activated protein kinase2(MK2)-defi cient cells[J]. The Journal of Biological Chemistry, 2006, 281(37): 26966-26975.
[19] ELLIS R J. Molecular chaperones: the plant connection[J]. Science, 1990, 250: 954-959.
[20] YEH C H, CHEN Y M, LIN C Y. Functional regions of rice heat shock protein, Oshsp16.9, required for conferring thermotolerance in Escherichia coli[J]. Plant Physiology, 2002, 128(2): 661-668.
[21] JINN T L, CHIU C C, SONG W W, et al. Azetidine-induced accumulation of class I small heat shock proteins in the souble fraction provides thermotolerance in soybean seedlings[J]. Plant and Cell Physiology, 2004, 45(12): 1759-1767.
[22] HASLBECK M, FRANZMANN T, WEINFURTNER D, et al. Some like it hot: the structure and function of small heat-shock proteins[J]. Nature Structural and Molecular Biology, 2005, 12(10): 842-846.
[23] YEH C H, CHANG P F, YEH K W, et al. Expression of a gene encoding a 16.9-kDa heat-shock protein, Oshsp16.9, in Escherichia coli enhances thermotolerance[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(2 0): 10967-10972.
[24] TRAN K, MAY B K, SMOOKER, et al. Distribution and genetic diversity of lactic acid bacteria fr om traditional fermented sausage[J]. Food Research International, 2011, 44(1): 338-344.
[25] PADAN E, BIBI E, ITO M, et al. Alkaline pH homeostasis in bacteria: new insights[J]. Biochimica et Biophysica Act a(BBA)-Biomembranes, 2005, 1717(2): 67-88.
Expression of Chaperone Protein Genes in Lactobacillus plantarum under Salt Stress
WU Rina1,2, SONG Xuefei1, LIU Qianying1, XU Xin1, WANG Qianqian1, WU Junrui1,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
The objective of this study was to isolate a salt-tolerant Lactobacillus plantarum (FS5-5) from naturally fermented miso in northeastern China. The expression of chaperone protein genes under salt stress at the transcriptional level was evaluated by real-time fluorescence quantitative polymerase chain reaction (real time-PCR). Results showed that in the exponential growth phase, the chaperone protein genes such as groEL, groES, dnaK, dnaJ, hsp1, hsp2, and usp were induced by NaCl in MRS medium and their expressions were up-regulated. The higher NaCl concentration was, the more significant the up-regulation was. Similarly, the heat shock protein gene hsp3 was induced by NaCl in MRS medium and its expression was up-regulated, but the induced up-regulation was not positively correlated with NaCl concentration.
Lactobacillus plantarum; real-time fl uorescence quantitative polymerase chain reaction (real time-PCR); salt stress; gene expression
Q93
A
10.7506/spkx1002-6630-201511019
2014-11-25
国家自然科学基金青年科学基金项目(31000805);国家自然科学基金面上项目(31471713);
中国博士后科学基金资助项目(2014M560395);辽宁省农业领域青年科技创新人才培养资助计划项目(2014048);
沈阳农业大学“天柱山英才支持计划”项目
乌日娜(1979—),女,副教授,博士,研究方向为食品生物技术。E-mail:wrn6956@163.com
*通信作者:武俊瑞(1977—),男,副教授,博士,研究方向为食品生物技术。E-mail:junruiwu@126.com
