高选择性的菜籽蛋白含量测定方法
2015-01-03沈娜娜刘大川钟启新
沈娜娜 刘 晔 刘大川 钟启新
(武汉轻工大学食品科学与工程学院1,武汉 430023)
(武汉轻工大学化学与环境工程学院2,武汉 430023)
高选择性的菜籽蛋白含量测定方法
沈娜娜1刘 晔2刘大川1钟启新1
(武汉轻工大学食品科学与工程学院1,武汉 430023)
(武汉轻工大学化学与环境工程学院2,武汉 430023)
为解决菜籽蛋白原料及制品中真蛋白含量难以测定的问题,建立了一种基于分级和定量2步完成的高选择性菜籽蛋白含量测定方法。通过酸化丙酮溶液和沸水萃取实施分级处理,可将样品中的非蛋白氮分离;结合应用可溶性蛋白的染色法测定和不溶性蛋白的凯氏定氮法测定,可获得样品的真蛋白含量。该方法变异系数不大于2.83%,回收率95%~96%,并可排除本源性非蛋白氮(包括芥子碱和硫甙)及外源性非蛋白氮(包括硝酸盐、铵盐、三聚氰胺和尿素)的干扰。该方法具备良好的抗干扰能力且不受蛋白质溶解性的影响,可推广到更多的植物蛋白制品及原料的真蛋白含量测定中,并可为相关行业的掺杂辨识或品质评价提供可靠手段。
菜籽蛋白 真蛋白 非蛋白氮 抗干扰
我国是世界上最大的油菜籽生产国,已建成较为成熟的菜籽油加工产业,但对于菜籽蛋白的商业化开发和利用则十分欠缺[1-2]。为保障菜籽蛋白加工产业的健康发展,需建立可靠的真蛋白含量定量方法,以使相关企业获得原料掺杂辨识及产品价值评价的手段。作为相关行业仲裁标准的凯氏定氮法只能检测粗蛋白含量,无法剔除样本中非蛋白氮的干扰[3]。菜籽饼粕及其蛋白制品中的非蛋白氮通常有两个来源,其一是油菜籽中天然存在的非蛋白含氮化合物,代表性成分是硫甙和芥子碱[4],属本源性非蛋白氮;其二是在油菜籽种植、菜籽饼粕脱毒及深加工中引入的含氮物质,如尿素、铵盐和硝酸盐等[5],属外源性非蛋白氮。非蛋白氮的存在通常令样本中的蛋白质含量被高估,可导致相关企业遭受经济损失或技术风险。因此,发展高选择性的菜籽蛋白测定方法以确定样本中的真蛋白含量是十分必要的。
基于比色法,包括双缩脲法、lowry法、Bradford法、BCA法等[6],或者基于蛋白酶水解动态参数等均可快速确定可溶性蛋白质含量[7],但无法测定不溶性菜籽蛋白;全氮测定方法不受蛋白质溶解性的影响,但无法区分非蛋白氮的存在[3,8];近红外法也可用于农产品中蛋白质的快速定量,但仍需可靠的化学分析方法作为建模基础[9]。针对现有方法的缺陷,提出先对菜籽蛋白样品分级处理,再结合应用高选择性的染色法和高通用性的全氮测定法,以实现对菜籽真蛋白的高选择性测定。
1 材料与方法
1.1 材料与试剂
菜籽预榨-浸出粕(分别简称黄冈粕、宜城粕、武汉粕):湖北维普生物科技股份有限公司、湖北宜城市天鑫油脂公司、益海嘉里(武汉)粮油工业有限公司;大豆分离蛋白:湖北云梦龙云植物蛋白有限公司;油菜籽:青海西宁塘古风商贸有限公司;白芥子:湖北中医院;Bradford蛋白浓度试剂盒:江苏海门碧云天生物研究所;3,5-二甲氧基-4-羟基肉桂酸(纯度98%):阿法埃莎(天津)化学有限公司;复合多糖水解酶 Viscozyme L(酶活100 FBG/g):广州诺维信(中国)生物技术有限公司;HP-20型大孔吸附树脂:沧州宝恩吸附材料科技有限公司;再生纤维素透析袋(截留相对分子质量8 000~14 000):北京索莱宝科技有限公司,其他化学试剂均为分析纯。
1.2 仪器和设备
FJ-200高速分散均质机:上海标本模型厂;DF-1集热式磁力恒温搅拌器:金坛市江南仪器厂;HYP-1008消化炉:上海纤检仪器有限公司;Bench-Top Pro K4冷冻干燥机:美国VIRTIS公司。
1.3 试验方法
1.3.1 菜籽蛋白含量的两步法测定
1.3.1.1 样品的预处理
对待测菜籽粕样品实施分级处理,见图1。

图1 菜籽粕样品的分级处理流程
精确称取1 g粉碎并过60目筛的待测样品置于50 mL离心管中,加入以三氯乙酸调至pH 3的70%(体积比)的丙酮水溶液15 mL,室温下18 000 r/min均质90 s,所得悬液3 500 r/min离心10 min,分别收集上清液及残渣。对残渣重复上述萃取操作3次,合并上清液并在40℃真空(-0.1 MPa)旋转蒸发脱除丙酮后以pH 7.4的0.1 mol/L磷酸盐缓冲液定容至25 mL,记为脱酚液。然后向残渣中加入15 mL煮沸的去离子水,再于沸水浴中磁力搅拌30 min,待冷却至室温后3 500 r/min离心10 min,所得上清液定容至25 mL,记为脱硫苷液;所得残渣为不溶物。
为考察多酚对脱酚液蛋白质测定的影响,采用上述相同条件萃取黄冈粕,合并上清液真空脱除丙酮后定容至10 mL。取其中5 mL在4℃下透析36 h,转出并定容至10 mL,记为透析液;剩余5 mL稀释并定容于10mL,记为对照液。分别测定透析液和对照液中的总酚浓度和蛋白质浓度。
1.3.1.2 蛋白质含量的计算
分别测定上述分级产物,即脱酚液、脱硫甙液和不溶物的蛋白质质量,并按照下式计算蛋白质含量:
蛋白质含量/%=(不溶物蛋白质量+脱酚液蛋白质量+脱硫苷液蛋白质量)/样本质量×100
1.3.2 菜籽蛋白标准液的制备
参考并修改文献[10]的方法制备菜籽蛋白标准液。其中,采用树脂吸附法脱酚和酶水解法脱多糖。即将蛋白粗提液按1.5 mg/mL的比例加入HP-20树脂,在25℃的水浴中以150 r/min的转速振荡1.5 h。然后12 000 r/min离心 5 min,吸出上清液并用0.5 mol/L的磷酸调节至 pH 4.8,然后按0.2 g/L的比例加入Viscozyme L,在40℃水浴中以150 r/min振荡水解48 h。将所得水解液以1 mol/L调节至pH 4.0后4℃静置12 h,再以3 500 r/min离心10 min收集酸沉蛋白,将所得酸沉蛋白以1 mmol/L NaOH溶液重溶后再于4℃下透析36 h,最后经冷冻干燥得菜籽蛋白。所得菜籽蛋白中未检出硫甙和酚,且在纯化操作中未引入含氮物质,基于凯氏定氮法测得纯度为91.24%(干基)。将该菜籽蛋白溶于0.1 mol/L的pH 7.4磷酸盐缓冲液,制得菜籽蛋白标准液。
1.3.3 菜籽粗酚提取液的制备
根据文献[11]的方法提取菜籽粗酚。
1.3.4 化学分析及数据处理
固体蛋白质含量采用GB/T 6432—1994测定;液体蛋白含量测定采用Bradford法测定;水分含量的测定采用GB/T 6435—2006测定;总酚及酚酸测定依据文献[11-12];硫代葡萄糖甙采用硫脲紫外法测定[13]。对所有样本的蛋白质含量做6平行测定,对其他化学成分报道数值为3次平行测定的平均值,显著性分析采用Microsoft Office Excel 2003做t-检验及F-检验。
2 结果与讨论
2.1 分级处理对本源性非蛋白氮的影响
两步法测定菜籽蛋白的方法包括分级和测定2个步骤。其中分级处理的目的在于将样本中的非蛋白氮萃取出来,并使样本分级为不溶物和可溶物(包括脱酚液和脱硫甙液两部分)两类馏分。从而可在测定步骤中利用全氮测定法(本研究使用凯氏定氮法)测定不溶性菜籽蛋白的含量;再利用高选择性的染色法测定可溶性蛋白质,进而累加两个部分蛋白质含量得到样本的真蛋白含量。
菜籽饼粕及其制品中的本源性非蛋白氮主要是芥子碱和硫苷[4]。其中芥子碱是芥子酸和胆碱的酯化物,占油菜籽中各类酯化态酚酸的99%左右[5]。Xu等[12]建立了一种菜籽酚酸的快速测定方法,利用三氯乙酸酸化的70%丙酮经多轮提取可完全提取菜籽粕中的游离态和酯化态酚酸。据此,以黄冈粕样本中的总酚酸为基准,考察了提取轮次对于样本中酚酸去除率的影响,结果如图2所示。
从图2可见,利用酸化丙酮水溶液可高效提取粕中的酚酸,萃取3次即可实现98%以上的脱除率,增加萃取次数只能微弱增加脱除率,而残留部分主要为难以脱除的结合态酚酸(不含胆碱)。因此,选择提取3次。

图2 萃取次数对菜籽酚酸去除率的影响
硫甙是油菜籽中另一类不可忽视的天然含氮化合物,其含量受油菜品种和加工工艺的影响,而呈现巨大差异[5]。水在高温下对菜籽粕中的硫甙具有高溶出能力[15],故在本研究中采用沸水脱除样品中的硫甙。从试验结果看,虽然原粕中的恶唑烷硫酮(OZT)和异硫氰酸酯(ITC)分别达到(18.81±0.01)mg/g粕和(4.24±0.02)mg/g粕,但经沸水浸提后粕中的这2类物质含量都未检出,意味着这一操作可较为彻底的去除原粕中的硫甙成分。
2.2 菜籽多酚对液相蛋白测定的影响
分级操作可较为彻底地脱除菜籽粕样品中的内源性非蛋白氮,也产生了2种液体分级馏分,即脱酚液和脱硫甙液。其中均可能含有一定量的可溶性菜籽蛋白,需加以测定以计入总真蛋白量。由于考马斯亮蓝G250染色法对于非蛋白氮具有优异的抗干扰能力且能快速灵敏的测定可溶性蛋白质,因此被用于本研究。然而,植物多酚的存在往往导致染料或蛋白质的沉淀而造成该方法的失效[16]。此外,所测蛋白质的氨基酸组成不同也会导致染色法的测定出现较大偏差[6]。因此,在本研究中采用自制的高纯菜籽蛋白为标准物测绘标准曲线,并考察了不同浓度的菜籽多酚对该标准曲线的影响,结果如图3所示。

图3 总酚浓度对菜籽蛋白标准曲线的影响
从图3可见,菜籽蛋白标准曲线线性关系良好。而当标准液中添加菜籽多酚后,吸光度值开始出现偏离,且这一趋势随多酚浓度的增加而趋于明显,表明酚对蛋白质的沉淀作用开始显现[14]。然而,当蛋白质质量浓度低于0.4 mg/mL时,菜籽多酚的存在并未对测定值产生显著影响。为进一步证实该判断的可靠性,采用染色法测定对照液(未作脱酚处理)和透析液(采用透析法脱酚质量)的蛋白质浓度。结果表明,透析前总酚和蛋白质质量浓度值分别为(0.793±0.011)mg/mL和(0.266±0.015)mg/mL;透析后总酚和蛋白质浓度值分别为(0.015±0.001)mg/mL和(0.250±0.022)mg/mL,二者的蛋白质测定值无显著性差异(P>0.05)。在本研究中,所有脱酚液蛋白质浓度不大于0.26mg/mL且总酚含量不大于0.80 mg/mL,而所有脱硫甙液酚含量不大于0.2 mg/mL,因此均可采用G250染色法及上述标准曲线进行蛋白质定量。
2.3 两步法测定的有效性
在含菜籽蛋白的样本中,菜籽预榨-浸出粕是物理-化学结构最为复杂且受非蛋白氮影响最大的样本类型[5],故选为典型样本用以考察两步法测定的精密度。此外,由于目前尚无商品化的菜籽分离蛋白,故选择大豆分离蛋白作为不含非蛋白氮的样本,用以考察所测数据的有效性。凯氏定氮法作为一种标准方法,也用于样本蛋白含量测定以提供参照数据,结果见表1。
从表1可见,对于菜籽粕样本而言,两步法所测蛋白含量均显著低于凯氏定氮法所得数据;而对于大豆分离蛋白而言,2种测定却并无显著差异,显示样本中本源性非蛋白氮对全氮测定方法的干扰不可忽视,而两步法测定则可实现对真蛋白的选择性测定。在对上述样本中加入自制菜籽蛋白标准物以评价方法的可靠性时,两步法测定的回收率在95%~96%之间。据此可知,两步法测定能够客观地反映样本中的真蛋白含量,具有更高的可靠性。
从精密度分析看,两步法与凯氏定氮法相比其变异系数在总体上并无显著差异且不大于2.83%,故可认为具有较好的精度。而从3种分级馏分中蛋白含量对两步法测定总蛋白含量数据的贡献上看,脱酚液中蛋白质含量微乎其微,这是因为三氯乙酸酸化的丙酮溶液对蛋白质的溶解度极低。因此,可考虑忽略这个部分的可溶性蛋白质测定以简化操作。在脱硫甙液中,菜籽蛋白含量也非常低,但大豆蛋白的含量则高得多,显示了二者在沸水中溶解度的巨大差异。虽然在测定水溶性蛋白含量时,仍然使用了菜籽蛋白做标准物,但是对于大豆蛋白的测定并未出现较大偏差。
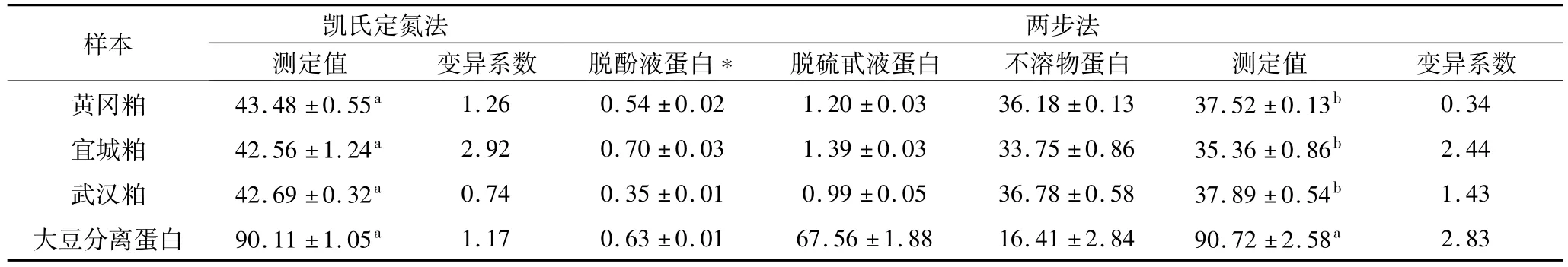
表1 凯氏定氮法和两步法测定蛋白含量的比较/%

表2 凯氏定氮法和两步法对外源性非蛋白氮污染样本的测定比较
2.4 方法的抗干扰能力
菜籽蛋白制品及其原料中往往因各种原因而被引入某些含非蛋白氮的物质,对于客观评价样品价值造成严重困扰,甚至有可能成为相关行业的信用风险。为此,在菜籽粕中添加多种非蛋白氮以模拟被外源性非蛋白氮污染的情况,并分别采用凯氏定氮法和两步法测定其蛋白质含量,以对比二者的抗干扰能力,试验结果及数据分析如表2所示。
由表2可见,采用凯氏定氮法测定菜籽蛋白含量时,会受到尿素、三聚氰胺以及铵盐的严重影响,即使添加量不到3%(质量百分比),即可导致粗蛋白含量出现显著的增大;硝酸盐则因不能被转化为氨气而不对总氮测定产生影响。而在采用两步法测定时,上述任何添加物都不会对样本的真蛋白含量产生显著影响,意味着该方法对外源性非蛋白氮不敏感,显示出对于真蛋白的高选择性。应该指出,在两步法中采用了酸化丙酮溶液和沸水两类萃取剂,故无论对于水溶性的铵盐还是非水溶性的三聚氰胺均能较为彻底的分离,从而使该方法具有较为全面的抗干扰能力。综上所述,将两步法和凯氏定氮法在应用于菜籽蛋白含量测定时的主要差异列于表3。
出于对营养价值及供需矛盾的考虑,人们越来越重视利用植物蛋白替代或补充动物蛋白的消费[17]。而植物蛋白的标准含量测定方法仍然基于全氮测定,导致对于非蛋白氮的残留或掺杂几乎没有辨别能力。本研究虽然只对两步法测定菜籽蛋白和大豆分离蛋白的有效性进行了考证,但其技术原理可兼顾不溶性及可溶性蛋白的定量,故有望推广至各类植物蛋白制品及其原料的测定中,进而发展为一种植物蛋白样本的通用真蛋白含量测定方法。

表3 凯氏定氮法和两步法的比较
3 结论
建立了一种菜籽蛋白样品中真蛋白含量的两步测定方法。通过酸化丙酮溶液萃取和沸水萃取实施分级处理,可将样品中的非蛋白氮分离;结合应用可溶性蛋白的染色法测定和不溶性蛋白的凯氏定氮法测定,可获得样品的真蛋白含量。该方法变异系数不大于2.83%,回收率95%~96%,并可排除本源性非蛋白氮(包括芥子碱和硫苷)及外源性非蛋白氮(包括硝酸盐、铵盐、三聚氰胺和尿素)的干扰,相对于无抗干扰能力的全氮测定法,这是一种高选择性的菜籽蛋白测定方法。该方法不受蛋白质溶解性的影响且具备广谱抗干扰能力,有望推广到多种植物蛋白制品及原料的真蛋白定量中,从而为相关行业的掺杂辨识或品质评价提供可靠手段。
[1]陆胜民,郑美瑜,陈剑兵.食用菜籽蛋白的提取和纯化研究进展[J].中国粮油学报,2008,23(6):234-238
[2]吴谋成.油菜籽加工与综合利用[M].北京:中国轻工业出版社,2010
[3]Lindeboom N,Wanasundara PK JPD.Interference of phenolic compounds in Brassica napus,Brassica rapa and Sinapis alba seed extracts with the Lowry portein assay[J].Food Chemistry,2007,104(1):30-38
[4]Muzquiz M,Hill GD,Cuadrado C,et al.Proceedings of the fourth international workshop on antinutritional factors in legume seeds and oilseeds[M].Toledo:Wageningen Academic Publishers,2004
[5]Shahidi F.Canola and Rapeseed:Production,Chemistry,Nutrition and Processing Technology[M].New York:Van Nostrand Reinhold Company Inc,1990
[6]Antharavally B S,Mallia K A,Rangaraj P,et al.Quantitation of proteins using a dye-metal-based colormetric protein assay[J].Analytical Biochemistry,2009,385(4):342-345
[7]陈亚锋,徐斐,曹慧,等.酶催化水解法快速测定牛奶中的蛋白质含量[J].分析科学学报,2011,27(2):191-194
[8]田培,马飞,姜俊,等.杜马斯燃烧法测定油料粗蛋白含量[J].中国油料作物学报,2012,34(6):650-654
[9]Petisco C,Garcia-Criado B,Vazquez-de-Aldana B R,et al.Measurement of quality parameters in intact seeds of Brassica species using visible and near-infrared spectroscopy[J].Industrial Crops and Products,2010,32(2):139-146
[10]Berot S,Compoint JP,Larre C,et al.Large scale purification of rapeseed proteins(Brassica napus L.)[J].Journal of Chromatography B,2005,818(1):35-42
[11]Naczk M,Towsend M,Zadernowski R,et al.Proteinbinding and antioxidant potential of phenolics of mangosteen fruit(Gracinia mangostana)[J].Food Chemistry,2011,128(3):292-298
[12]Xu L,Diosady L L.Rapid method for total phenolic acid determination in rapeseed/canola meals[J].Food Research International,1997,30(8):571-574
[13]佘珠花,兰燕丽,吴幼青,等.用硫脲紫外法测定菜籽饼粕中硫代葡萄糖甙的检测分析及讨论[J].中国油脂,2003,28(10):40-42
[14]Naczk M,Amarowicz R,Sullivan A,et al.Current research developments on polyphenolis of rapeseed/canola:A review[J].Food Chemistry,1998,62(4):489-502
[15]Fauduet H,Coic JP,Lessire M,et al.Rapeseed meal upgrading—pilot scale preparation of rapeseed meal materials with high or low glucosinolate contents[J].Animal Feed Science Technology,1995,56(2):99-109
[16]Mattoo R L,Ishaq M,Saleemuddin M.Protein assay by coomassie brilliant blue G-250-binding method is unsuitable for plant tissues rich in phenols and phenolases[J].Analytical Biochemistry,1987,163(4):376-384
[17]Aider M,Barbana C.Canola proteins:composition,extraction,functional properties,bioactivity,applications as a food ingredient and allergenicity-A practical and critical review[J].Trends in Food Science and Technology,2011,22(1):21-39.
Highly Selective Method for Rapeseed Protein Content Determination
Shen Nana1Liu Ye2Liu Dachuan1Zhong Qixin1
(College of Food Science and Engineering,Wuhan Polytechnic University1,Wuhan 430023)
(College of Chemical and Environmental Engineering,Wuhan Polytechnic University2,Wuhan 430023)
To achieve reliable assessment on the true protein content in rapeseed protein materials or products,a highly selective determination method involving steps of sample fraction and protein quantification was established.Samples were extracted with acidified aqua acetone and subsequently with boiling water to remove the non-protein nitrogen(NPN),and then the soluble protein in liquid fractions was determined by Bradford method while the insol-
uble protein in solid fraction was determined by Kjeldahl method,thus the combination of protein in both fractions represents the true protein in sample.The method has shown desirable capability of anti-interference on both endogenous NPN(including glucosinolates and sinapine)and exogenous NPN(including nitrate,ammonium salt,melamine and urea).In addition,the coefficient of variation was less than 2.83%and the recovery rate was within the range of 95%~96%.Due to the anti-interference capability on various NPN and compatibility on protein solubility,this method could be applied widely in determining various types of plant true protein and as reliable tool for adulteration identification or quality evaluation.
rapeseed protein,true protein,non-protein nitrogen,anti-interference
TS229
A
1003-0174(2015)02-0107-06
国家科技支撑(2010BAD01B07),湖北省教育厅科学研究(Q20081808)
2013-11-11
沈娜娜,女,1987年出生,硕士,油脂与植物蛋白工程
刘晔,男,1974年出生,副教授,农产生物质资源的开发和利用
