水酶法提取大豆油的扩大试验研究
2015-01-03韩宗元江连洲齐宝坤王胜男
韩宗元 江连洲 李 杨 齐宝坤 王胜男 王 晓 陈 勇
(东北农业大学食品学院1,哈尔滨 150030)
(沈阳工学院生命工程学院2,抚顺 113122)
水酶法提取大豆油的扩大试验研究
韩宗元1,2江连洲1李 杨1齐宝坤1王胜男1王 晓1陈 勇1
(东北农业大学食品学院1,哈尔滨 150030)
(沈阳工学院生命工程学院2,抚顺 113122)
水酶法提取大豆油的研究已经取得了很大的进步,因此在实验室规模基础上,进行了水酶法提取大豆油的扩大试验。在10 L反应釜中,每次试验需要1.2 kg的挤压膨化大豆片。通过单因素和响应面试验对加酶量、pH、酶解温度、酶解时间和料液比进行参数优化,得出最优结果:加酶量1.92%,pH 9.15,酶解时间3.09 h,酶解温度56.15℃,料液比1∶5.04,油脂提取率(69.02±0.55)%。并且,通过透射电镜和光学显微镜观察、研究,揭示出水酶法提取大豆油的释放机理,以便于提高水酶法的油脂提取率和油的品质。最后,通过比较水酶法和溶剂浸提法,结果表明:水酶法提出的大豆油品质更好,过氧化值更低。
大豆油 水酶法 扩大试验 油脂提取率
有机溶剂浸提中使用的正己烷是由多种同分异构体组成,易燃易爆,且利用不可再生资源生产的有机溶剂。由于正己烷能够破坏环境,因此人们渴望找到可以替代有机溶剂提取的方法,逐渐对水代法产生了浓厚的兴趣,因为水代法不仅没有有机溶剂,还能同时获得油脂和蛋白[1-3]。
虽然水代法可以替代溶剂萃取法,但是水代法有许多难题要解决,包括提取率低和产生大量乳状液等。在实验室规模试验中,水代法提取率低,所以酶[5-6]和机械处理可以应用到水代法中提高提取率。机械处理包括压片和挤压膨化[4,7]。酶能够起到破坏细胞壁和磷脂膜结构的作用,因此加入各种酶的水代法应用于大豆[8],油菜籽[10],椰子[11],葵花籽[12]等油的浸提中。所以,水酶法可以很好地解决水代法的困难,而且达到较高地提取率和破乳率。水酶法提取大豆油可以通过破乳来提高油脂的提取率,破乳方法包括酶法破乳和化学法破乳等[4]。
在实验室规模基础上,通过水酶法提取大豆油的扩大试验,尽可能提高油脂提取率并且简单易行、以期为工业化生产提供借鉴。
1 材料与方法
1.1 材料与仪器
全脂大豆压片:吉林丰正大豆食品有限公司;Protex6L碱性蛋白酶:诺维信公司;氢氧化钠、盐酸、乙醚、石油醚、氢氧化铵、95%乙醇、酚酞 分析纯:天津迪博化工股份有限公司。
10 L真空反应釜、低速离心机、高速冷冻离心机:郑州长城科工贸有限公司;pHS-3C型酸度计:上海雷磁仪器厂;大功率粉碎机:东北农业大学;振荡过筛机:新乡市大汉振动机械有限公司;挤压膨化机:黑龙江省农业科学院。
1.2 试验方法
1.2.1 水酶法扩大试验提取大豆油方法
挤压膨化机将全脂大豆片挤压膨化,再经过粉碎机粉碎,过60目筛后,取1.2 kg物料加入到真空反应釜中,加水调节使料液比达到1∶6。用2 mol/L氢氧化钠调节混合液pH到9.5,然后加物料质量2.5%的Protex 6L,使温度保持在55℃,反应进行3 h[4,9]。酶解后,混合液在超高速低温离心机离心 20 min,转速14 400 r/min。离心后,将最上层的游离油萃取出来,再将乳状液收集,放入4℃冰箱内保存,然后再进行破乳,将破乳油和游离油收集到一起。
1.2.2 单因素试验
通过研究酶解参数,即酶解时间、酶解温度、料水比、pH、加酶量,确定4个因素不变,只改变1个因素,来确定各因素对油脂提取率的影响。各因素的范围如下:pH 8~10,加酶量0.5%~3.0%,酶解时间2~4 h,酶解温度45~65℃,料液比3~7。
1.2.3 响应面试验
响应面试验在单因素研究的基础上,选取pH、加酶量、酶解时间、酶解温度、液料比5个因素为自变量,以油脂提取率为响应值,根据中心组合设计原理,设计响应面分析试验,其因素水平编码表见表1。
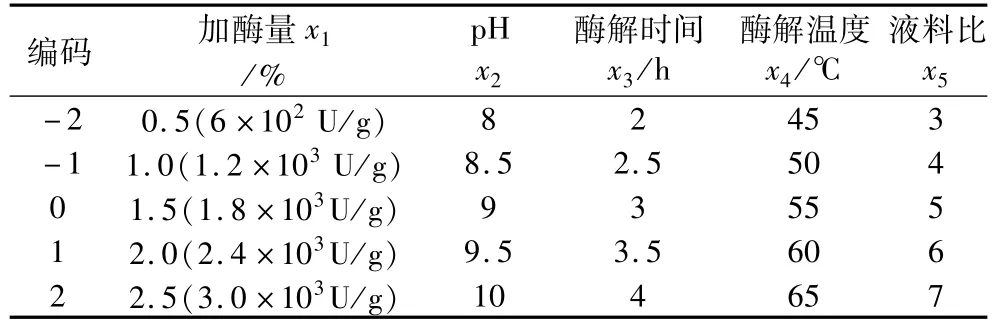
表1 因素水平编码表
1.2.4 油脂提取率测定
物料的含油率通过AOAC 922.06方法测定,乳状液含油率也通过AOAC 995.19法测定[13]。

1.2.5 透射电镜和光学显微镜测定
通过透射电镜和光学显微镜可以观察到细胞内部结构,利用东北农业大学DX-201透射电镜和Zeiss LSM710光学显微镜进行试验,观察乳状液中蛋白和脂肪变化情况[14-15]。
透射电镜:前固定→漂洗→后固定→漂洗→50%乙醇脱水→70%乙醇脱水→90%乙醇脱水→100%乙醇脱水→100%乙醇和100%丙酮(1∶1)脱水→100%丙酮脱水→纯丙酮和包埋液浸透→包埋→聚合→修快→超薄切片机切片→染色→观察、拍片。
光学显微镜:0.2%考马斯亮蓝(R250)和苏丹III染液分别对蛋白和油脂切片进行染色,染色后,通过光学显微镜观察。
1.2.6 油脂的品质分析
2 kg全脂大豆片用正己烷浸提8 h,再用旋转蒸发仪去除正己烷,得到大豆油[18]。根据水分及挥发物、折光指数、色泽、酸值、游离脂肪酸含量、过氧化值、p-茴香值、不皂化物、磷含量等指标比较正己烷浸提法和水酶法提取的大豆油的品质[17-19]。
1.2.7 脂肪酸分布测定
通过哈尔滨工程大学的HITZB-638气相色谱质谱联用仪进行检测[18]。
1.3 数据处理
所有试验数据均为“平均值±标准差”,n=3。采用SAS9.13统计分析软件对试验数据进行分析;差异显著性采用SPSS19 Duncan检验法,显著水平为P<0.05。
2 结果与讨论
2.1 扩大试验的酶解条件对水酶法油脂提取率的影响
Rosenthal等[5]对酶解参数进行了研究,它能对油脂提取率起到巨大的影响。因为他们能影响细胞壁结构的破坏,并使酶达到最大的活性。研究指出挤压膨化大豆片通过水酶法提取大豆油,油脂提取率达到 50%~70%[8]。
图1a表示不同pH对油脂提取率的影响。随着pH值增大,提取率先增大再减小,当pH达到9.5时,油脂提取率达到最大。图1b表明加酶量对提取率的变化趋势和pH相同,在加酶量为2.5%时,提取率达到最大。图1c表示酶解时间对提取率的变化趋势是先快速增加,再缓慢降低,在3 h附近达到最大值。图1d表明酶解温度对提取率的趋势变化极大,提取率从30%到65%,在55℃时达到最大。图1e表明料液比的变化趋势不同于其他因素,因为它在1∶3和1∶4时快速增加,然后从 1∶4到 1∶5,提取率几乎不变,最终在1∶6达到最大值。
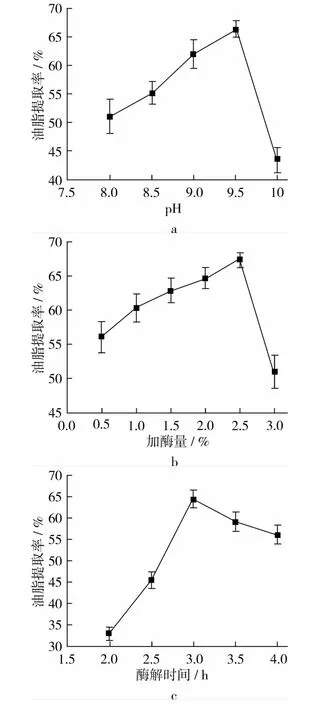
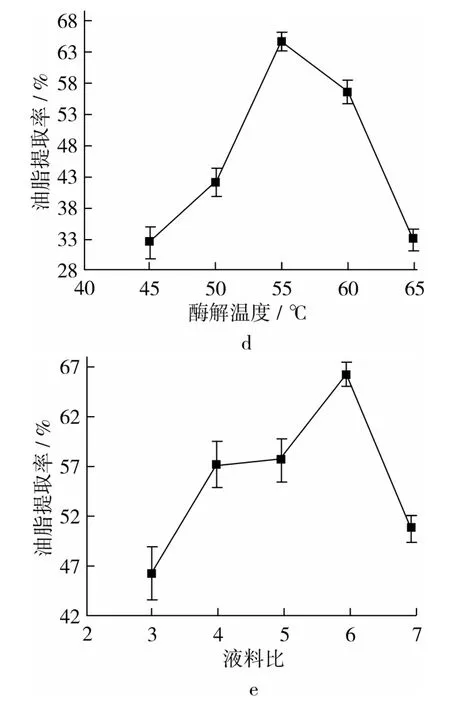
图1 酶解条件对油脂提取率的影响
2.2 响应面分析
根据单因素试验,采用响应面法优化酶解参数。以加酶量 x1,pH x2,酶解时间 x3,酶解温度 x4,液料比x5为自变量,油脂提取率y为响应值,响应面试验方案及结果见表2。试验号1~24为析因试验,25~36为中心试验,用以估计试验误差。
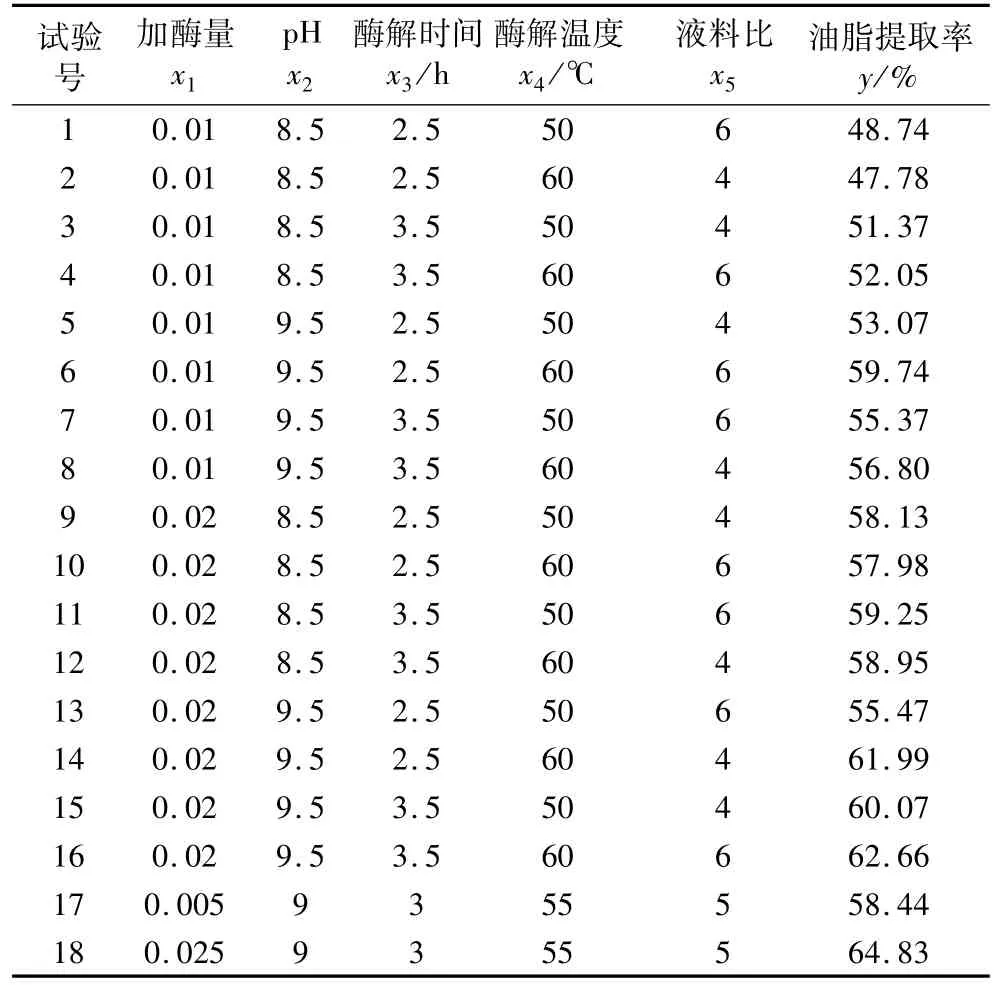
表2 响应面试验方案和试验结果
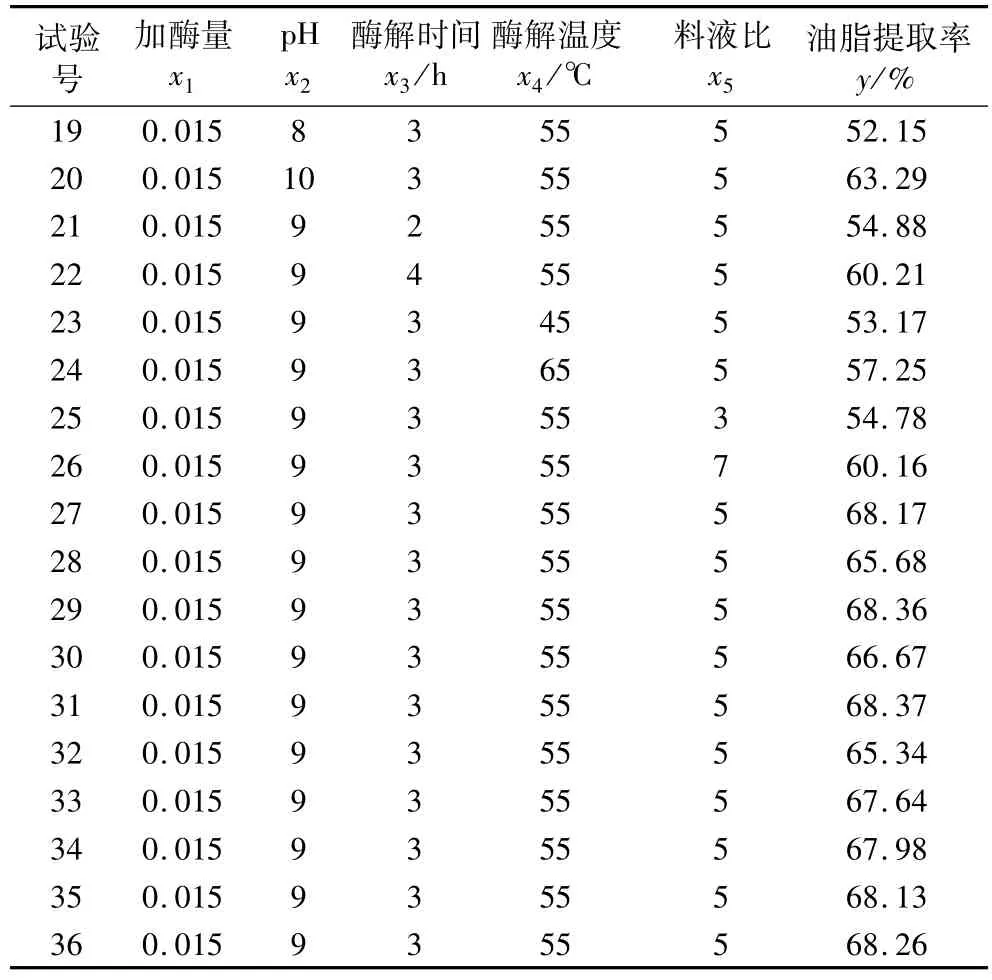
表2 (续)
通过SAS9.13得到响应面回归方程式,如下:
Y=-11.40+69.12x1+1.58x2+0.78x3+0.09x4+0.19x5-536.88x12-4.79x1x2+0.28x1x3+0.02x1x4-1.33x1x5-0.09x22-0.01x2x3+0.004x2x4-0.001x2x5-0.09x32-0.002x3x4+0.001x3x5-0.001x42+0.001-0.02
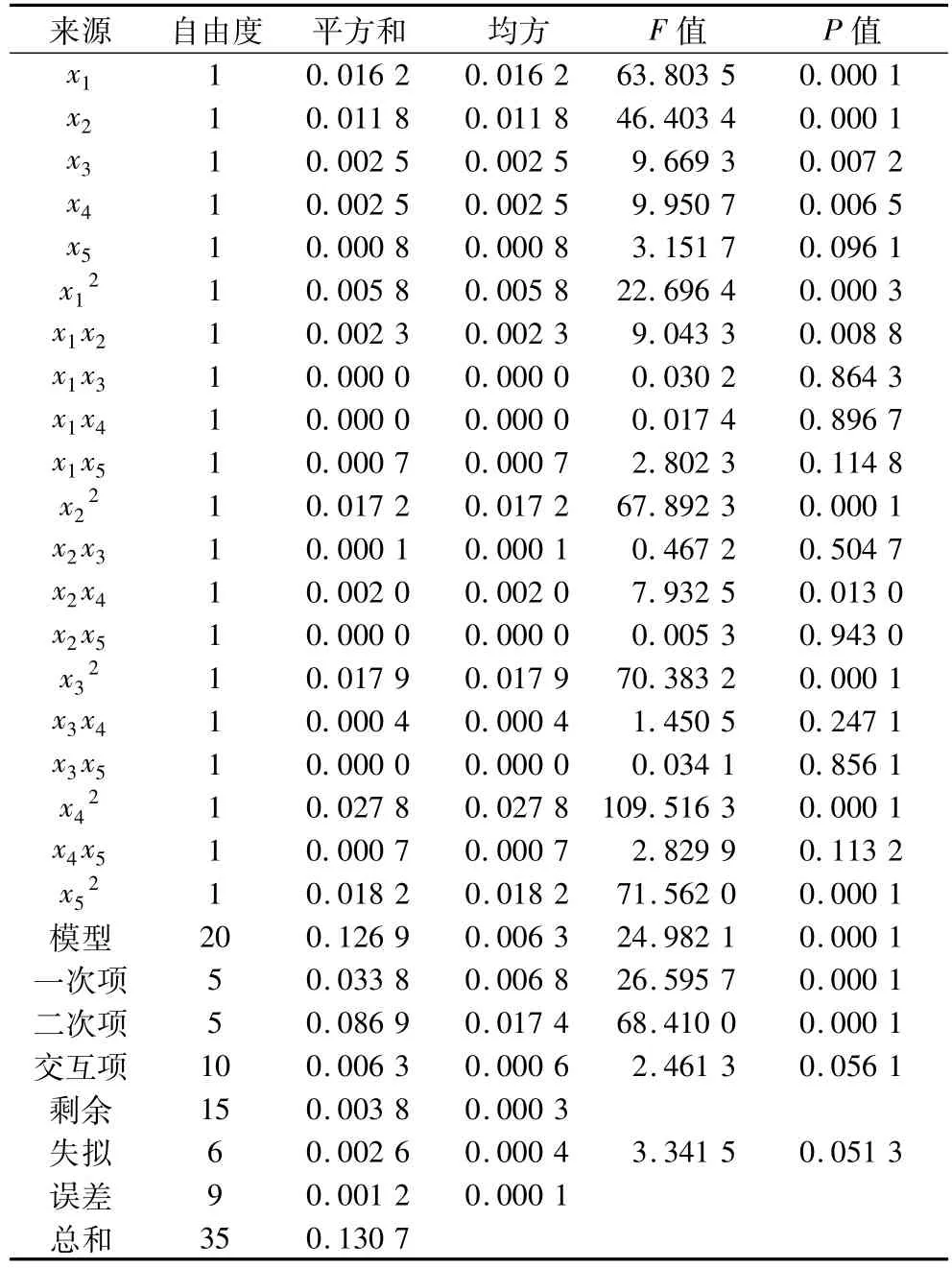
表3 回归与方差分析结果
表3表明独立和非独立变量的线性关系是显著的,此模型是显著的(P<0.000 1),失拟不显著。而且,模型的决定系数(R2=0.970 9>0.800 0)说明试验误差低,模型正确。结果证明此模型能很好地匹配和分析数据来预测试验结果。
按照显著性检验,含有 x1,x2,x3,x4,x1x2,x2x4,的一次项和二次项对油脂提取率有显著影响(P<0.05),并且其他因素不显著(P>0.05),这说明各因素的影响是复合的,因为存在交互项。图2和图3表示交互作用的响应面和等高线。表3反应通过F检验得到因素贡献率为:x1>x2>x4>x3>x5(加酶量>pH>酶解温度>酶解时间>料液比)。
当固定3个因素的零水平,图2和图3表示另外2个显著交互项的响应面和等高线。两对显著交互项可从表3获得,分别为:加酶量和pH,pH和酶解温度。图2表明:当把x3,x4和x5调节到零水平,在低水平pH下,加酶量对油脂提取率影响较小,在高水平pH下,加酶量对油脂提取率影响很大,随着加酶量增大,油脂提取率先增大后平缓趋势。pH对油脂提取率的趋势和加酶量的相同。图3表示当把x1,x3和x5调节到零水平,pH和酶解温度对油脂提取率的影响的变化趋势都是先上升后下降。

图2 显著交互项加酶量和pH的响应面分析
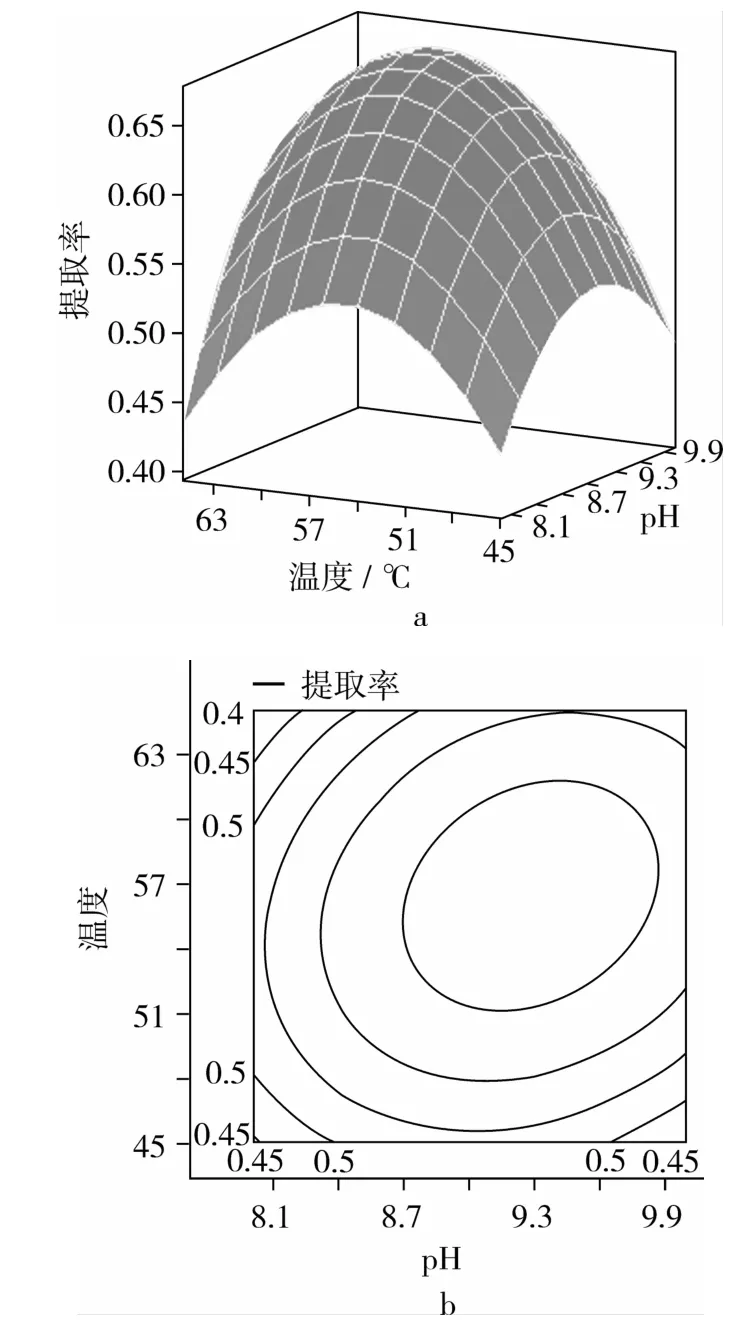
图3 显著交互项pH和酶解温度的响应面分析
2.3 最佳酶解条件的确定及验证
响应面分析法得到的最佳条件如下:加酶量1.92%,pH 9.15,酶解时间3.09 h,酶解温度56.15℃,料液比1∶5.04,油脂提取率预测值(69.02±0.55)%。
在最佳条件下进行3次平行试验,酶解条件为:加酶量1.92%,pH 9.15,酶解时间3.09 h,酶解温度56.15℃,料液比1∶5.04。3次试验结果分别为:68.67%,68.79%,68.51%。3次平行试验的平均值为68.66%,这说明响应值符合回归预测值,并且模型能预测产业化的实际条件。
2.4 水酶法的油脂释放机理的显微镜分析
在水酶法提取过程中,随着酶解进行,开始形成水包油型乳状液。虽然乳状液中含有超过50%的油,但是许多蛋白质包围乳状液中的油,阻止油脂释放[16]。因此,使油脂释放需要破坏蛋白质。蛋白体的变化范围为直径10到50μm。一般来说,直径大的蛋白体比小的更容易破坏其结构[16]。在图4a中,当酶解1 h,大量的蛋白体聚集在一起并且包围着油体。少量油体从蛋白体中分离出来,但是大量的油体与蛋白体结合,被称作油质体[16]。在图4b和图4c中,当酶解分别进行2 h和3 h,蛋白体的覆盖逐渐变少,油体开始聚集形成小油滴。最后,当包围油滴蛋白体完全被破坏,小油滴聚集形成大油滴。在pH 4.5条件下破乳后,蛋白体分离出来,然后变小分散如图4d。最后,越来越多的油体聚集形成油滴。

图4 乳状液的透射图像
通过光学显微镜观察,可知在水酶法过程中油脂释放情况,并了解其释放机理。首先,在水溶液中,乳状液开始形成,大量蛋白体包围油体并且油体非常小如图5a。然后,油体开始聚集结合形成小油滴如图5b和5c。最后,破乳后,在图5d中大量油滴聚集释放。
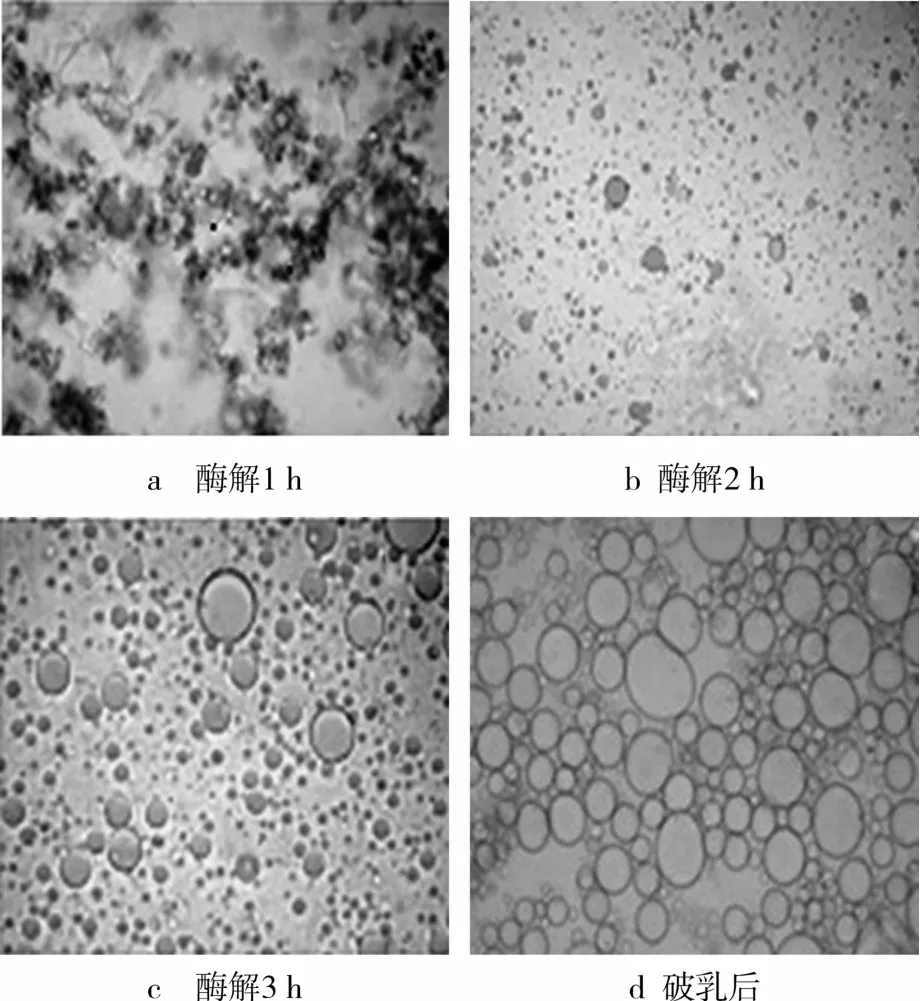
图5 乳状液的光学显微镜图片
2.5 水酶法和溶剂浸提法的大豆油品质分析
在表4中,通过比较水酶法和溶剂浸提法的大豆油的品质得到结果:水酶法提取的大豆油品质更好,并且其水分及挥发物、过氧化值、p-茴香值和磷的含量与溶剂浸提法的值有显著的不同(P<0.01)和Jung等[17]研究的结果相近。过氧化值和p-茴香值分别是检测初级氧化产物和次级氧化产物的指标。很显然,无论哪种提取方法,较低的过氧化值是令人期望的。表4表示2种提取方法的大豆油指标和脂肪酸组成分布。

表4 正己烷提取法和水酶法提取大豆油的特征值
3 结论
在水酶法提取大豆油的扩大试验中,以36组响应面试验优化酶解条件将油脂提取率从30%增加到69%。响应面优化的最佳条件为加酶量1.92%,pH 9.15,酶解时间3.09 h,酶解温度56.15℃,料液比1∶5.04,油脂提取率达到(69.02±0.55)%。通过透射电镜和光学显微镜观察,得到水酶法的油脂释放机理,并且进一步提高提取工艺和油的品质。
[1]Cater CM,Rhee K C,Hagenmaier R D,et al.Aqueous extraction—an alternative oilseed milling[J].J Am Oil Chem Soc,1973,51:137-141
[2]Johnson L A.Oil recovery from soybeans[M]//Johnson L A,White PJ,Galloway R.Soybeans:chemistry,production processing,and utilization.AOCS Press,Urbana,2008,pp:331-375
[3]Galvin J B.Toxicity data for commercial hexane and hexane isomers[M]//Wan PJ,Wakelyn PJ.Technology and solvents for extracting oilseeds and nonpetroleum oils.AOCS Press,Champaign,1997:75-85
[4]de Moura JM L N,Campbell K,Mahfuz A,et al.Enzyme-assisted aqueous extraction of oil and protein from soybeans and cream de-emulsification[J].J Am Oil Chem Soc,2008,85:985-995
[5]Rosenthal A,Pyle D L,Niranjan K,et al.Combined effect of operational variables and enzyme activity on aqueous enzymatic extraction of oil and protein from soybean[J].Enzyme Microb Technol,2001,28:499-509
[6]Dominguez H,Nunez M J,Lema JM.Oil extractability from enzymatically treated soybean and sunflower:range of operational variables[J].Food Chem,1993,46:277-284
[7]Lamsal B P,Murphy PA,Johnson L A.Flaking and extrusion as mechanical treatments for enzyme-assisted aqueous extraction of oil from soybeans[J].J Am Oil Chem Soc,2006,83:973-979
[8]Campbell K A,Glatz CE,Johnson L A,et al.Advances in aqueous extraction processing of soybeans[J].J Am Oil Chem Soc,2011,88:449-165
[9]de Moura J M L N,de Almeida N M,Johnson L A.Scaleup of enzyme-assisted aqueous extraction processing of soybeans[J].J Am Oil Chem Soc,2009,86:809-815
[10]Zhang SB,Wang Z,Xu SY.Optimization of the aqueous enzymatic extraction of rapeseed oil and protein hydrolysates[J].J Am Oil Chem Soc,2007,84:97-105
[11]Che Man Y B,Suhardiyono A B,Asbi Ab,et al.Aqueous enzymatic extraction of coconut oil[J].J Am Oil Chem Soc,2006,73:683-686
[12]Sineiro J,Dominguez H,Nunez M J,et al.Optimization of the enzymatic treatment during aqueous oil extraction from sunflower seeds[J].Food Chem,1998,61:467-474
[13]Lamsal B P,Johnson L A.Separating oil from aqueous extraction fractions of soybean[J].J Amer Oil Chem Soc,2007,84:785-792
[14]Campbell K A,Glatz C E.Mechanisms of aqueous extraction of soybean oil[J].J.Agric.Food Chem,2009,57:10904-10912
[15]Kurenai T,Eduardo B.Light microscopic methods to visualize mitochondria on tissue sections[J].Methods,2008,46:274-280
[16]Campbell K A,Glatz CE,Johnson L A,et al.Advances in aqueous extraction processing of soybeans[J].J Am Oil Chem Soc,2011,88:449-465
[17]Jung S,Maurer D,Johnson L A.Factors affecting emulsion stability and quality of oil recovered from enzyme-assisted aqueous extraction of soybeans[J].Bioresource Technology,2009,100:5340-5347
[18]de Moura Bell JM L N,Maurer D,Yao L,et al.Characteristics of oil and skim in enzyme-assisted aqueous extraction of soybeans[J].J Am Oil Chem Soc,2013,90:1079-1088
[19]Zhang SB,Liu X J,Lu QY,et al.Enzymatic demulsification of the oil-rich emulsion obtained by aqueous extraction of peanut seeds[J].J Am Oil Chem Soc,2013,90:1261-1270.
Scale-Up of Soybean Oil from Enzyme-Assisted Aqueous Extraction Processing
Han Zongyuan1,2Jiang Lianzhou1Li Yang1Qi Baokun1Wang Shengnan1Wang Xiao1Chen Yong1
(College of Food Science and Engineering,Northeast Agricultural University1,Haerbin 150030)
(College of Life Engineering,Shenyang Institute of Technology2,Fushun 113122)
Enzyme-assisted aqueous extraction processing(EAEP)has made great progress in extracting soy-
bean oil.On the basis of laboratory-scale,scale-up of the extraction of soybean oil has been carried out.There was a need of 1.2 kg extruded soybean flakes for every experiment in a 10 L jacketed reactor.The hydrolysis conditions which contains the amount of enzyme,pH,hydrolysis temperature,hydrolysis time and solids-to-liquid ratio were discussed to get the optimal parameters in single factor and response surface experiments.The results were as follows:the amount of enzyme 1.92%,pH 9.15,hydrolysis time 3.09 h,hydrolysis temperature 56.15℃,solids-to-liquid ratio 1∶5.04 and oil extraction efficiency(69.02±0.55)%.In conclusion,the mechanism of oil release from EAEP was revealed by transmission electron microscopy and light microscopy for further improvement of extraction efficiency and oil quality.Comparing with solvent extraction,oil quality from EAEPwas better and the peroxide value was lower.
soybean oil,enzyme-assisted aqueous extraction processing,scale-up,oil extraction efficiency
TS22
A
1003-0174(2015)02-0037-07
863计划(2013AA102104)
2013-10-23
韩宗元,男,1988年出生,硕士,粮食、油脂与植物蛋白工程
江连洲,男,1960年出生,教授,粮食、油脂与植物蛋白工程
