TIPE2在肾脏移植排斥反应患者中的表达及临床意义
2015-01-02贾利宁田普训马晓桃付荣国桂保松田李芳段朝阳卢家美西安交通大学第二附属医院肾病科西安70004西安交通大学医学院第一附属医院肾移植科通讯作者mailjldoctorcom
贾利宁,田普训,马晓桃,付荣国,桂保松,田李芳,陈 钊,段朝阳,韩 锦,卢家美(西安交通大学第二附属医院肾病科,西安 70004;西安交通大学医学院第一附属医院肾移植科;通讯作者,E-mail:jldoctor@6.com)
器官移植是20世纪具有里程碑标志的临床技术,拯救了众多的终末期器官功能衰竭患者生命,使其能正常生活。但移植排斥反应是影响器官移植预后的主要因素[1,2]。在临床实践中,同种异体肾移植术后,最常见的排斥反应类型是急性排斥反应(AR),占40%。慢性排斥反应(CR)为远期移植物失功能的主要原因,影响受者长期高质量生存的重要因素。目前对CR的研究一直没有实质性突破[3]。因此,在移植排斥反应的早期能发现一些预警分子或对移植排斥反应的机制有深入的认识,可能对器官移植的发展起着非常重要的作用[4-6]。
移植排斥反应是由多种细胞、多种分子参与的复杂免疫应答过程。在器官移植排斥反应中,T细胞起关键作用。T细胞活化需要三条途径:T细胞抗原受体复合物(TCR)细胞内信号、共刺激分子的调控以及免疫抑制性分子调节的一个复杂过程。其中,CD28和ICOS等共刺激分子是T细胞活化分子,而CTLA-4、PD-1和BTLA等抑制性共刺激分子抑制T细胞活化。可见,正、负免疫调节的平衡保证了宿主对移植器官的免疫应答,从而防止移植排斥反应的发生。
TIPE2(tumor necrosis factor-induced protein 8-like-2)由美国宾夕法尼亚大学孙宏宏在脑脊髓膜炎EAE动物模型中首先发现,将TIPE2基因敲除后导致炎症反应加剧,固有免疫反应和适应性免疫反应均上调,认为其在维持免疫平衡中发挥负性调节作用[7]。目前TIPE2在移植排斥中的作用尚无报道。本研究通过检测TIPE2在肾移植排斥反应患者中的表达及免疫抑制剂对 TIPE2表达的影响,探讨TIPE2在移植排斥中的作用。
1 研究对象和方法
1.1 研究对象
根据临床诊断标准,选取西安交通大学第一、第二附属医院住院和门诊就诊的肾移植术后患者96例,其中急性排斥32例,慢性排斥33例,肾移植后长期存活31例。另选取32例健康人作对照组。入选标准:急性排斥、慢性排斥诊断标准根据患者的临床表现、辅助检查结果、移植肾组织病理学Banff 05标准;长期存活组:存活时间5年以上、肾功能稳定、无蛋白尿)。排除患有恶性肿瘤、乙型、丙型肝炎、糖尿病和重症感染、自身免疫性疾病的患者。血样、组织样品采集均得到患者的知情同意和伦理委员会的批准。
1.2 主要试剂
DNA逆转录试剂盒、Trizol试剂盒,均购自Invitrogen公司;单克隆 TIPE2抗体,购自美国 Santa Cruz Biotechnology公司;TRITC标记的鼠抗山羊IgG抗体购自北京中山金桥公司;人的淋巴细胞分离液购自美国 Sigma公司;环孢素 CsA购自 Novartis Pharma,Nürnberg,Germany和雷帕霉素购自 Wyeth-Ayerst,Madison,N.J,USA。
1.3 人外周血来源PBMC
取新鲜的人肝素抗凝外周血5 ml,用 PBS以1∶1的比例稀释后沿离心管壁缓慢加到淋巴细胞分离液上,4℃,18 000×g,离心20 min后取白膜层细胞,用PBS以1 500×g,离心10 min,洗涤1次。
1.4 Western blot检测PBMC中TIPE2蛋白的表达
按照蛋白质浓度取20 μg TIPE2总蛋白,100℃变性10 min,12%-10%SDS-PAGE。以80 V电泳30 min,随后将总蛋白转移到PVDF膜上,5%脱脂牛奶封闭,加入兔抗人TIPE2抗体(1∶100),37℃水浴湿盒中振荡1 h。洗膜后加入HRP-羊抗兔IgG抗体(1∶2 000),然后取化学发光试剂A和B各500 μl混合,均匀加上发光试剂混合液约1 min后,压X胶片约1 min,取胶片放入显影液中约2 min,再用定影液定影,晾干保存。应用Gel-Pro软件分析目的蛋白与内参的灰度比值。
1.5 免疫组化染色观察移植肾组织中TIPE2表达
穿刺活检所得移植肾组织用10%中性甲醛(pH 7.2)固定过夜,常规石蜡包埋,制作4 μm石蜡组织切片,经脱蜡、复水后,3%H2O2的室温孵育10 min以消除内源性过氧化物酶,再在微波炉中与枸橼酸盐缓冲溶液孵育10 mim以修复抗原,PBS洗片5 min×3次,10%山羊血清封闭10 min,分别滴加山羊抗人TIPE2抗体(1∶400)4℃过夜。PBS洗片5 min×3次,滴加生物素标记的大鼠抗山羊二抗IgG,37℃孵育20 min,PBS洗片5 min×3次,再滴加辣根酶标记的链霉卵白素液,37℃孵育20 min,洗片后DAB显色,苏木素复染细胞核,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜观察并摄片。为排除非特异性染色,以PBS代替一抗作为阴性对照。用光密度法对移植肾组织中TIPE2的表达量化分析。
1.6 免疫抑制剂对TIPE2表达的影响
取外伤后脾切除患者脾脏,脾脏剪碎后用玻片研磨,用200目尼龙网过滤至15 ml离心管中,制成单细胞悬液。4℃,1 600 r/min,离心5 min,弃上清后沉淀混匀。室温加入2 ml红细胞裂解液,注意观察颜色,颜色呈现嫩粉色即可。加入PBS 10 ml终止反应,4℃,1 600 r/min,离心5 min,弃上清。加入 PBS 10 ml,4 ℃,1 600 r/min,离心5 min,弃上清。沉淀重悬于2 ml含10%FCS的RPMI 1640中,细胞计数后备用。在96孔板中分别加入1×105/ml的淋巴细胞,分别加入环孢素 CsA(cyclosporine A,CsA)和雷帕霉素(Sir),CsA 的浓度 10,100,1 000 ng/ml;Sir的浓度 10,100,1 000 nmol/L。培养 72 h收集细胞,提取总RNA,用RT-PCR检测各组PBMC中TIPE2基因的表达。TIPE2的引物F:5'-GGAACATCCAAGGCAAGACTG-3',R:5'-A GCACCT-CACTGCTTGTCTCATC-3',大小 185 bp。β-actin 作为内参,应用Gel-Pro软件分析目的片段与内参的灰度比值。
1.7 统计学分析
2 结果
2.1 一般资料
四组患者年龄、性别无统计学差异(P>0.05,见表1)。患者移植的其他基本情况见表1。
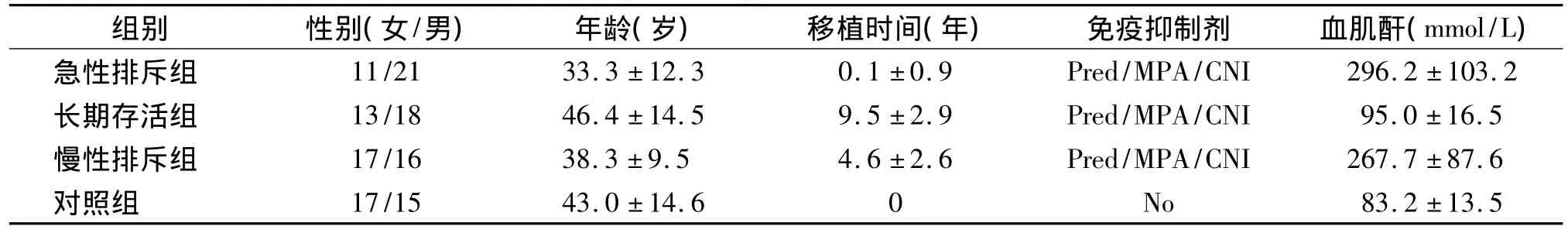
表1 肾移植受者的基本特征Table 1 General characteristics of renal transplant recipients and healthy controls
2.2 PBMCs中TIPE2蛋白的表达
Western blot检测各组PBMCs中TIPE2蛋白的表达,Gel-Pro软件分析目的蛋白与内参的灰度比值,研究结果表明:与对照组比较,急性排斥组PBMC中TIPE2表达下降(P<0.05),但慢性排斥组表达则明显增高(P<0.001),长期存活组TIPE2的表达轻度升高,差异无统计学意义(P>0.05,见图1)。
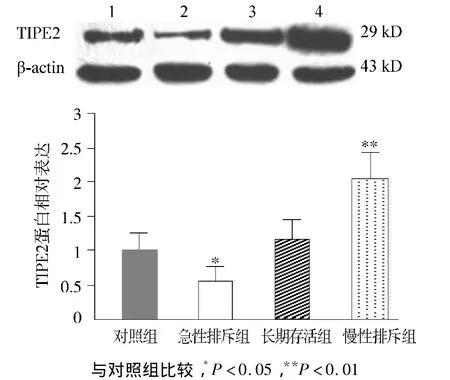
图1 Western blot检测各组PBMC中TIPE2蛋白的表达Figure 1 Western blot analysis for TIPE2 protein expression in PBMCs
2.3 移植肾组织中TIPE2表达
免疫组化染色观察各组移植肾组织TIPE2表达,结果发现正常肾组织有TIPE2的表达,主要表达在肾小管上皮细胞和浸润的淋巴细胞,肾小球没有表达(见图2)。与对照组(12.19 ±4.8)比较,TIPE2在急性排斥组移植肾组织中表达轻度下降(10.78±3.2,P >0.05),但在慢性排斥组移植肾组织中明显降低(3.29 ±1.32,P <0.05)。
2.4 免疫抑制剂对淋巴细胞TIPE2表达的影响
用RT-PCR检测免疫抑制剂对人的淋巴细胞TIPE2表达的影响,研究发现环孢素 A可抑制TIPE2表达,并呈现剂量依赖的关系(P<0.05,);但雷帕霉素对TIPE2的表达没有影响(P>0.05);环孢素A和雷帕霉素合用同样抑制TIPE2的表达(P <0.05,见图 3)。
3 讨论
本研究首次报道了在肾移植术后急、慢性排斥反应患者中TIPE2表达的差异及免疫抑制剂对其表达的影响,急性排斥反应组PBMC中TIPE2表达降低,但慢性排斥反应组TIPE2表达明显升高。肾移植术后长期存活的患者TIPE2的表达轻度升高。据此推断急性排斥的患者PBMCs中TIPE2表达降低,可能是通过调节T细胞的活化而促进移植物被排斥。Sun等[7]将TIPE2敲基因小鼠的T细胞和巨噬细胞分离后,发现 T细胞表面的活化性标志物CD25、CD69和CD44表达增高;分别用CD3单克隆抗体和LPS刺激培养,均具有高反应性,分泌高水平的 IL-6、IL-12和 TNF-α,体内的 CD4+和 CD8+T细胞的反应性明显增强,T细胞、B细胞和DC数量明显升高,可见机体的免疫状态活化,所以TIPE2在免疫负调控中起非常重要的作用[8]。文献报道IL-2、IL-6、IL-10、TNF-α、TGF-β 和 IFN-γ 的基因型和表达频率直接影响移植肾功能和排斥反应的发生率[9]。说明急性排斥患者表达TIPE2下调可能引起患者体内的CD4+和CD8+T细胞对供者抗原的高反应性,细胞因子分泌的增高,从而促进排斥反应的发生。慢性排斥的患者PBMC中TIPE2表达明显升高,认为慢性移植排斥的过程中,机体的处于免疫活化状态,TIPE2代偿性增高抑制机体过强的免疫反应。有学者认为,TIPE2含有DED或DED相似的结构域,结合 caspase-8,促进 Fas诱导的凋亡[7]。但国内ZHANG等[10]研究发现TIPE2结构域是以前没有报道过的新结构域,它含有一个位于蛋白中心的大疏水腔,认为这个疏水腔可能用于结合配体,当配体被释放后可以激活体内的免疫反应,从而达到维持免疫动态平衡的作用。所以对TIPE2进一步研究可能对器官移植排斥发生发展的分子机制和对移植排斥干预提供新策略。

图2 免疫组化和免疫荧光染色检测TIPE2移植肾组织中的表达(×400)Figure 2 HE and immunohistochemical staining of TIPE2 protein in kidney tissues(×400)
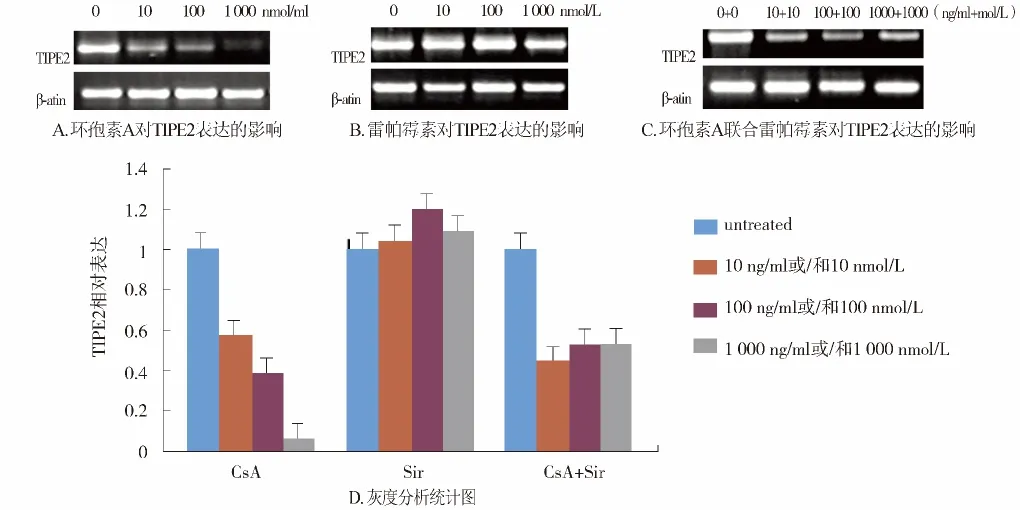
图3 RT-PCR检测免疫抑制剂对淋巴细胞TIPE2表达的影响Figure 3 Effect of immunosuppressive agents on TIPE2 expression in lymphocytes
本研究结果提示,TIPE2在正常肾组织有表达,急性排斥的移植肾组织中表达下降,但慢性排斥移植肾组织中明显降低,说明TIPE2在急性、慢性排斥中作为一个重要的调节分子。文献报道在移植肾微血管补体C4d片段是抗体介导移植物损伤的标志物,与移植物功能减退和移植物功能丧失有关[11]。我们认为,TIPE2在慢性排斥移植肾组织中降低,可能在移植物长期排斥的过程中抑制T细胞的活化和免疫损伤。此外,慢性排斥肾小管的萎缩可能使TIPE2的表达下降。总之,TIPE2与急性、慢性移植排斥反应密切相关,表明TIPE2参与器官移植排斥反应的过程,TIPE2可作为检测移植排斥反应的分子标志物。
本研究表明环孢素A可抑制TIPE2表达,并呈现剂量依赖的关系,但雷帕霉素对TIPE2的表达没有影响。环孢素A和雷帕霉素联合也抑制TIPE2的表达,但环孢素A抑制TIPE2表达的机制及通过何种信号通路,目前均不清楚。后期我们将会对其进行深入研究,可能对临床的诊断和治疗具有重要的参考价值。
[1]Dew MA,Switzer GE,Goycoolea JM,et al.Does transplantation produce quality of life benefits?A quantitative analysis of the literature[J].Transplantation,1997,64(9):1261-1273.
[2]Shoskes DA,Cecka JM.Effect of preservation and recipient immune factors on delayed graft function in cadaveric renal transplantation[J].Transplant Proc,2001,33(6):2967-2972.
[3]Opelz G,Dohler B.Influence of time of rejection on long-term graft survival in renal transplantation[J].Transplantation,2008,85(5):661-666.
[4]Desvaux D,Schwarzinger M,Pastural M,et al.Molecular diagnosis of renal-allograft rejection:correlation with histopathologic evaluation and antirejection-therapy resistance[J].Transplantation,2004,78(5):647-653.
[5]Sarwal M,Chua MS,Kambham N,et al.Molecular heterogeneity in acute renal allograft rejection identified by DNA microarray profiling[J].N Engl J Med,2003,349(2):125-138.
[6]Deng MC,Eisen HJ,Mehra MR,et al.Noninvasive discrimination of rejection in cardiac allograft recipients using gene expression profiling[J].Am J Transplant,2006,6(1):150-160.
[7]Sun H,Gong S,Carmody RJ,et al.TIPE2,a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415-426.
[8]Freundt EC,Bidere N,Lenardo MJ.A different TIPE of immune homeostasis[J].Cell,2008,133(3):401-402.
[9]Melk A,Henne T,Kollmar T,et al.Cytokine single nucleotide polymorphisms and intrarenal gene expression in chronic allograft nephropathy in children[J].Kidney Int,2003,64(1):31-35.
[10]Zhang X,Wang J,Fan C,et al.Crystal structure of TIPE2 provides insights into immune homeostasis[J].Nat Struct Mol Biol,2009,16(1):89-90.
[11]Bohmig GA,Exner M,Habicht A,et al.Capillary C4d deposition in kidney allografts:a specific marker of alloantibody-dependent graft injury[J].J Am Soc Nephrol,2002,13(4):1091-1099.
