他克莫司转换为环孢素对肾移植术后新发糖尿病的影响
2015-01-02张蓬杰张志明陕西省人民医院肾移植科西安70068西安市中心医院检验科通讯作者mail349549863com
张蓬杰,张志明,杜 鹏,段 斌,陈 瑞,丁 通(陕西省人民医院肾移植科,西安 70068;西安市中心医院检验科;通讯作者,E-mail:3495498@63.com)
肾移植后新发糖尿病(new-onset diabetes after kidney transplantation NODAT)是指移植前无糖尿病的患者在肾移植后出现持续性高血糖,并达到糖尿病的诊断标准,即空腹血糖≥7.0 mmol/L或伴有糖尿病症状,随机血糖≥11.1 mmol/L,或口服葡萄糖耐量试验检查,2 h 血糖≥11.1 mmol/L[1]。肾移植后糖尿病是器官移植的一种严重且常见并发症,是一种继发性疾病,可增加移植术后患者心血管疾病的发病率和致死率[2],诱发急、慢性排斥反应,进而增加慢性移植物功能损害及丧失功能的风险,降低患者的生存率[3,4]。研究发现肾移植后糖尿病的发生与多种因素有关,比如年龄、种族、体质量指数、遗传背景、肾移植前的血糖水平以及其他器官的功能状态等[5,6],其中主要风险因素仍然是免疫抑制剂的应用,尤其是大剂量糖皮质激素和钙神经抑制剂的应用[7]。目前绝大多数的报道认为他克莫司比环孢素A更易引起糖代谢异常,造成这一差别的原因可能由于他克莫司抑制胰岛素分泌的程度较环孢素A大。因此,有学者建议将他克莫司转换为环孢素,既有利于糖代谢异常的控制,又防止了急、慢性排斥反应的发生[8]。本文回顾性分析我院2008-06~2014-06规律随访的221例以他克莫司为基础免疫抑制剂方案的肾移植术后患者,51例诊断NODAT,按治疗方案将51例患者分为环孢素转换组、他克莫司药物减量组及口服降糖药物组并规律随访3年。比较1年内3组患者血糖的变化情况和3年内肾功改变情况以及人/肾存活率,以评估环孢素转换治疗人群NODAT的安全性及疗效。
1 资料与方法
1.1 一般资料
新发糖尿病的诊断标准:移植前无糖尿病的患者在移植后出现持续性高血糖,并达到世界卫生组织关于糖尿病的诊断标准[9],即空腹血糖≥7 mmol/L;或存在糖尿病症状,且随机血糖≥11.1 mmol/L;或口服葡糖糖耐量试验检查2 h血糖≥11.1 mmol/L;如果没有明确的高血糖病史却出现急性糖代谢失调者,应择日复查以明确诊断。
纳入标准:①首次同种异体肾移植;②移植后口服以他克莫司为基础的免疫抑制方案:他克莫司+吗替麦考酚酯(MMF)+泼尼松;③移植肾功能正常、稳定,血肌酐<120 μmol/L;④移植后发生新发糖尿病,符合诊断标准;⑤年龄>18岁;⑥肾移植时间超过3个月,少于1年。
排除标准:①患者术前3月内有包括空腹及随机血糖、糖耐量异常、糖化血红蛋白异常在内任何一项异常;②移植前有糖尿病史;③肾移植后发生严重感染;④移植后发生肾功能延迟恢复;⑤随访依从性差。
我院2008-06~2014-06间规律随访的同种异体肾移植术患者221例(尸体肾移植106例,活体肾移植115例),均采用标准剂量他克莫司+吗替麦考酚酯+泼尼松进行免疫抑制治疗。按纳入标准有51例诊断为NODAT,基本资料包括年龄、性别、体质量指数、丙肝感染、泼尼松剂量、空腹血糖、糖化血红蛋白、控制血糖方案。供受者的ABO血型相合,移植前群体反应性抗体(PRA)和淋巴细胞毒交叉配型试验(CDC)均<10%。51例患者按治疗方案不同分为三组:环孢素转换组(A组)23例、他克莫司减量组(B组)17例及口服降糖药物组(C组)11例,治疗方案符合伦理学研究要求且患者知情同意。三组患者基线资料差异无统计学意义(见表1),具有可比性。

表1 肾移植后新发糖尿病患者不同治疗方案的三组患者基线资料Table 1 Baseline data of patients with new-onset diabetes mellitus after transplantation in three groups
A组行他克莫司转换为环孢素的方案:即停用他克莫司,改成环孢素,根据体质量不同,起始4-5 mg/kg,环孢素物浓度检测在转换后第5天,并维持环孢素浓度在100-150 ng/ml;B组行标准他克莫司减量20%的方案:即他克莫司药物浓度维持在5-10 ng/ml;C组患者免疫抑制剂方案不变,根据对降糖药物(双胍类、磺脲类)的敏感性,行口服降糖药物治疗。三组吗替麦考酚酯用量及皮质激素剂量相同。入组的患者均辅助饮食治疗和运动疗法,当餐后血糖超过14.0 mmol/L时,均餐前皮下注射短效胰岛素治疗。
1.2 观察项目及指标
所有NODAT患者术前血糖、转换时血糖及转换后2,4,8,12月时的血糖血糖状况(包括空腹血糖、糖化血红蛋白HbA1c),胰岛素用量,同时监测患者体质量、体质量指数、血压等。观察3年内患者血清肌酐、尿素氮、胱抑素-C、免疫抑制剂用量及浓度范围、急性排斥反应发生率、感染发生率、人/肾存活率等直至随访终点。
1.3 统计学方法
应用统计软件SPSS13.0对所有数据进行分析,各相关参数以±s表示。两组间均数比较采用t检验,多组间均数比较应用单因素方差分析,率的比较应用卡方检验,所有数据进行方差齐性检验及正态性分布检验,非正态分布的数据应用非参数U检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
221例以他克莫司为基础的免疫方案患者中,有51例诊断为NODAT,发生率为23%,51例诊断NODAT 的时间为术后(8.0±4.2)月。
2.2 不同方法治疗后NODAT患者血糖、糖化血红蛋白变化及胰岛素应用情况
51例NODAT患者中A组23例、B组17例和C组11例,患者血糖平均为(13.35±1.59)mmol/L,糖化血红蛋白平均为(7.1±1.3)%,三组间差异无显著性(P>0.05)。经辅助治疗4月后,A、B、C组患者空腹血糖分别平均下降至 (7.45±2.45)mmol/L,(8.05 ± 2.44)mmol/L 和 (9.10 ± 3.89)mmol/L;治疗8个月后,A、B、C三组糖化血红蛋白分别平均下降至(6.1 ±1.3)%,(6.5 ±2.1)% 和(7.0±2.4)%。12月后,A组和B组的患者空腹血糖和糖化血红蛋白均降至理想范围(见表2,3),但B组患者日均胰岛素用量明显要多于A组患者(P<0.05,见表4)。C组患者在改善生活方式的同时,需要接受降糖药物治疗的患者例数逐渐增多,降糖药物剂量逐渐增加;12个月后,C组所有患者(11例)均需接受胰岛素治疗,而且空腹血糖及糖化血红蛋白控制情况均不如A组和B组(P<0.05)。
表2 肾移植后新发糖尿病不同治疗方案三组患者的空腹血糖变化(±s,mmol/L)Table 2 Fasting blood glucose level of patients with new-onset diabetes mellitus after transplantation in three groups of different treatment protocols(±s,mmol/L)

表2 肾移植后新发糖尿病不同治疗方案三组患者的空腹血糖变化(±s,mmol/L)Table 2 Fasting blood glucose level of patients with new-onset diabetes mellitus after transplantation in three groups of different treatment protocols(±s,mmol/L)
与 C 组比较,#P <0.05
组别 n 转换环孢素时(开始) 2月 4月 8月 12月环孢素转换组(A 组) 23 10.46 ±1.79 9.04 ±1.84 7.45 ±2.45 7.25 ±2.15 6.51 ±2.41#9 8.50 ±2.90他克莫司减量组(B 组) 17 10.12 ±1.55 9.20 ±2.68 8.05 ±2.44 7.45 ±2.44 6.55 ±2.25#口服降糖药物组(C 组) 11 11.00 ±1.77 10.24 ±2.13 9.10 ±3.89 9.20 ±3.5
表3 肾移植后新发糖尿病患者不同治疗方案三组患者的糖化血红蛋白变化(±s,%)Table 3 Changes of glycosylated hemoglobin level of patients with new-onset diabetes mellitus after transplantation in three groups(±s,%)
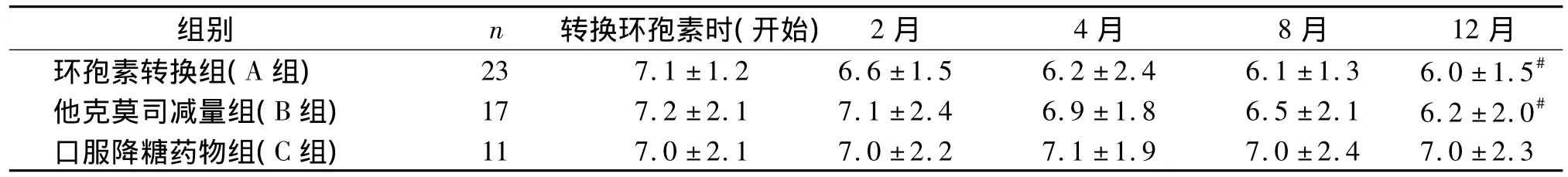
表3 肾移植后新发糖尿病患者不同治疗方案三组患者的糖化血红蛋白变化(±s,%)Table 3 Changes of glycosylated hemoglobin level of patients with new-onset diabetes mellitus after transplantation in three groups(±s,%)
与 C 组比较,#P <0.05
组别 n 转换环孢素时(开始) 2月 4月 8月 12月环孢素转换组(A 组) 23 7.1 ±1.2 6.6 ±1.5 6.2 ±2.4 6.1 ±1.3 6.0 ±1.5#11 7.0 ±2.1 7.0 ±2.2 7.1 ±1.9 7.0 ±2.4 7.0 ±2.3他克莫司减量组(B 组) 17 7.2 ±2.1 7.1 ±2.4 6.9 ±1.8 6.5 ±2.1 6.2 ±2.0#口服降糖药物组(C组)
表4 不同治疗方案随访12月后3组患者胰岛素需求量变化(IU/d,±s)Table 4 Changes of insulin requirement in patients with new-onset diabetes mellitus after transplantation in the three groups(IU/d,±s)

表4 不同治疗方案随访12月后3组患者胰岛素需求量变化(IU/d,±s)Table 4 Changes of insulin requirement in patients with new-onset diabetes mellitus after transplantation in the three groups(IU/d,±s)
与B组比较,*P<0.05
组别 n 转换环孢素时(开始) 2月 4月 8月 12月环孢素转换组(A组) 23 26±7 18±5 12±4 8±3 4±4*他克莫司减量组(B组) 17 24±6 20±4 16±8 16±4 15±4口服降糖药物组(C组)11 28±5 24±6 22±9 26±44 24±3
2.3 肾功能变化情况及人/肾生存生存率分析
2.3.1 肾功能变化情况 环孢素转换组相对于他克莫司减量组,肾功能无明显改变。环孢素转换组和他克莫司减量组3年后肌酐及胱抑素C与转换时变化不明显(P>0.05);C组患者3年后肌酐及胱抑素均明显上升(P<0.05,见表5),与A组比较有统计学差异。
表5 肾移植后新发糖尿病患者不同方案三组间血肌酐、胱抑素-C变化比较(±s)Table 5The serum creatinine,cystatin-C in patients with new-onset diabetes mellitus after transplantation(±s)
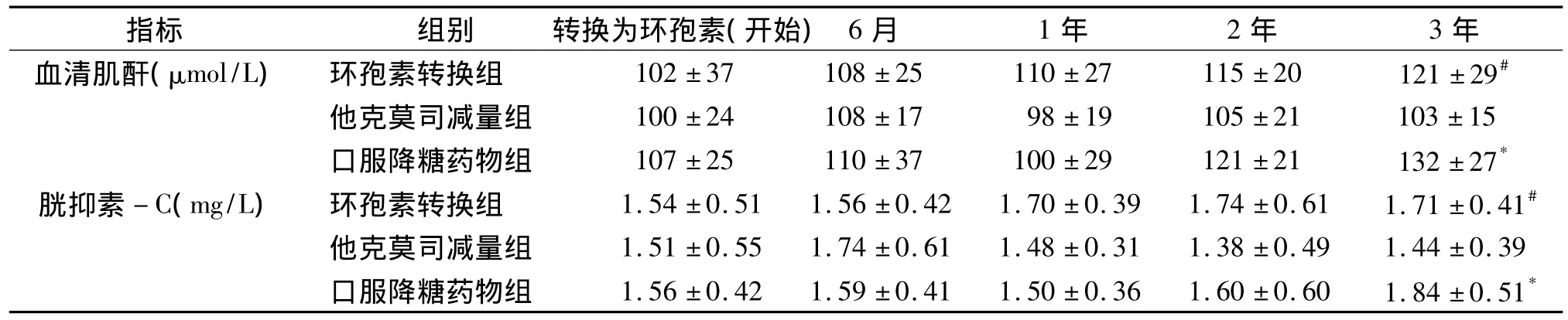
表5 肾移植后新发糖尿病患者不同方案三组间血肌酐、胱抑素-C变化比较(±s)Table 5The serum creatinine,cystatin-C in patients with new-onset diabetes mellitus after transplantation(±s)
与 C 组比较,#P <0.05;与开始时比较,*P <0.05
指标 组别 转换为环孢素(开始)6月 1年 2年 3年血清肌酐(μmol/L) 环孢素转换组 102±37 108±25 110±27 115±20 121±29#他克莫司减量组 100±24 108±17 98±19 105±21 103±15口服降糖药物组 107±25 110±37 100±29 121±21 132±27*胱抑素 -C(mg/L) 环孢素转换组 1.54 ±0.51 1.56±0.42 1.70 ±0.39 1.74±0.61 1.71±0.41#他克莫司减量组 1.51 ±0.55 1.74 ±0.61 1.48 ±0.31 1.38 ±0.49 1.44 ±0.39口服降糖药物组 1.56 ±0.42 1.59 ±0.41 1.50 ±0.36 1.60 ±0.60 1.84 ±0.51*
2.3.2 生存分析 入组的所有患者及移植肾的3年生存率分别是96.0%和90.1%。A组患者3年生存率人/肾分别是100%和95.6%,与B组患者人/肾生存率(100%和94.1%)无显著性差异(P >0.05),而C组患者3年生存率分别是81.8%和72.7%,明显低于A组和B组(P<0.05,见表6)。

表6 肾移植后新发糖尿病患者采用不同治疗方案随访3年的人/肾存活率 例(%)Table 6 The survival rate of patients and renal graft after followed up for three years in patients with newonset diabetes mellitus after transplantation cases(%)
3 讨论
肾移植后新发糖尿病是肾移植术后常见的并发症之一,是患者移植后发生心脑血管疾病的高危因素,可造成移植肾功能下降甚至丧失功能,直接影响患者的长期存活率。美国USRDS数据也表明,新发糖尿病是移植肾衰竭和受者死亡率增高的独立危险因素[10]。肾移植术后糖尿病的诱发因素和发病机制较为复杂,大量分子生物学方面研究显示[11],糖尿病与HLA抗原中的某些基因密切相关,具有糖尿病HLA易感基因者与具有保护性基因者之间的糖尿病发病率有明显差异,肾移植术后所用药物可使具有易感基因患者的糖尿病发病率升高。他克莫司及环孢素均为钙调磷酸酶抑制剂,主要用于预防实体器官移植手术后的排斥反应。美国肾脏病数据库(USRD)的数据显示,移植2年后,使用他克莫司的患者中新发糖尿病的发病率为30%,而使用环孢素A的仅18%发生新发糖尿病[7]。另有随机对照试验显示肾移植后6个月,新发糖尿病的发生率在应用环孢素 A 组为 8.9%,他克莫司组为 16.8%[12]。所以,部分学者建议将他克莫司转换为环孢素。许晓婷等[8]做了单中心回顾性分析发现是安全而有效的,而且转换组中有51.3%的新发糖尿病显著改善了糖代谢异常,停用降糖药物,达到临床治愈。
我院6年中规律随访的以他克莫司为基础免疫抑制剂的221例肾移植术后患者,其中51例在移植后8月左右诊断为移植术后新发糖尿病,发病率23%,与既往他克莫司致糖尿病的报道基本一致。我们将符合移植术后新发糖尿病的患者按治疗方案不同分为三组,经三种不同的方法治疗后观察治疗后反应,结果显示:经治疗4月后,A、B、C三组患者空腹血糖明显下降;治疗8个月后,A、B、C三组糖化血红蛋白明显改善,虽然B组空腹血糖和糖化血红蛋白下降与A组相似,但12月后B组日均胰岛素用量较A组却明显增加。这说明:移植后糖尿病患者三种不同治疗方法对于血糖的控制效果良好,尤其在糖尿病早期停用他克莫司换用环孢素后血糖控制更为理想,他克莫司对血糖的影响较环孢素明显且可逆;对于他克莫司减量患者,虽然空腹血糖及糖化血红蛋白较前下降,但后期需要胰岛素剂量明显增加,说明他克莫司致糖尿病因素并未完全祛除,故不如环孢素组血糖代谢改善明显。而C组患者在改善生活方式的同时,需要接受降糖药物治疗的患者例数逐渐增多,降糖药物剂量逐渐增加,12个月后所有患者均需接受胰岛素治疗,而且空腹血糖及糖化血红蛋白控制情况均不如A组和B组。说明他克莫司致糖尿病影响明显且呈剂量依赖性,与其他文献报道一致,于立新等[13]指出,他克莫司的胰岛毒性与其血药浓度呈正相关,采用小剂量低谷值的他克莫司时,对终末期糖尿病肾病肾移植患者安全且效果好。其他文献推荐[14]:肾移植术后患者第1个月FK506全血谷值浓度为10-12 ng/ml时,PTDM发病率明显低;术后6月他可莫司谷值浓度应维持在5-10 μg/L,且毒副作用的发生率随着血药浓度的增加而增加。
另外,为进一步了解三种治疗方法对肾功的影响,我们规律随访三组患者3年,分别观察患者血清肌酐、胱抑素-C及人/肾存活率的变化,依据观察结果可见:A组患者环孢素转换后血糖代谢改善,肾功稳定,人/肾存活率与B组无差异,说明环孢素转换后对于移植术后糖尿病患者安全且有效。环孢素的使用是免疫抑制剂在实体器官移植中的里程碑[15],它明显地改善了移植肾的存活时间,使移植受者受益,虽然环孢素的肝、肾毒性存在,但适时监测浓度,观察肝肾功能变化,及时地调整剂量后许多副作用可以避免。而未更换环孢素的C组患者中,3年后血清肌酐及胱抑素-C均明显升高,且人/肾存活率低于A组和B组,说明血糖异常对于移植物功能和生存率的影响随着时间的推移逐渐体现,这与其他文献报道一致,美国肾脏病数据库(USRD)报告了4 105例肾移植后3年内发生新发糖尿病的患者,他们发现新发糖尿病早期,平均中位时间1.8年就可以出现糖尿病并发症[7]。
移植后糖尿病已经被公认为是影响移植物和患者长期生存的第二大因素,仅次于急、慢性排斥反应。术前应常规行口服葡糖糖耐量试验检查以更好了解患者的糖代谢状况,减少可逆的高危因素,为患者制定适当的免疫抑制方案,降低术后新发糖尿病发病率,减轻糖代谢对移植物的影响是预防的关键。而对于发病后的治疗,根据改善全球肾脏病预后指南及国内外文献,传统的降糖治疗策略往往对药物引起的NODAT效果不佳[16]。调整抗排斥药物方案成为首选,其中CNI药物减量是常见的选择方案之一,但是CNI药物减量可增加发生急慢性排斥反应的风险,且排斥反应一旦发生很大程度上会损伤移植物,从而降低人/肾生存率。他克莫司对糖代谢的影响大于环孢素A,移植后如发生糖尿病时,最好采用低剂量或改换为环孢素A。另外部分文献报道将他克莫司更换为西罗莫司治疗移植术后糖尿病[21],但据我们的观察,西罗莫司的应用后的主要并发症是高脂血症和尿蛋白量增加,长期的血脂异常会加重尿蛋白,尿蛋白会直接造成移植肾损伤。而他克莫司转换为环孢素A对改善新发糖尿病不仅是有效的,而且是安全的。但转换后5年甚至10年患者的肾功能变化及人/肾存活率有无差异,则需要更大样本量、更长时间的随访和观察。
[1]李婕.肾移植术后新发糖尿病患病情况及相关危险因素分析[D].南昌:南昌大学,2009:1-29.
[2]Hjelmesaeth J,Hartmann A,Leivestad T,et al.The impact of early-diagnosed new-onset post transplantation diabetes mellitus on survival and major cardiac events[J].KIndey Int,2006,69(3):588-595.
[3]Kes P,Brunetta B,Basic'-Jukic'N.Cardiovascular diseases after kidney transplantation[J].Lijec Vjesn,2006,128(7-8):228-232.
[4]Farmer JA.Diabetic dyslipidemia and atherosclerosis:evidence from clinical trials[J].Curr Diab Rep,2008,8(1):71-77.
[5]余爱荣,范星,辛华雯,等.肾移植术后糖尿病发病率与危险因素[J].药物流行病学杂志,2011,20(4):169-172.
[6]Hur KY,Kim MS,Kim YS,et al.Risk factors associated with the onset and progression of posttransplantation diabetes in renal allograft recipients[J].Diabetes Care,2007,30:609-615.
[7]Batista F,Auyanet I,Torregrosa JV,et al.Long-term follow-up after conversion from Tacrolimus to Cyclosporin in renal transplant patients with new-onset diabetes mellitus after transplantation[J].Transplant Proc,2012,44(9):2582-2584.
[8]许晓婷,黄赤兵,范明齐.肾移植术后新发糖尿病患者的免疫抑制方案转换[J].中华内分泌外科杂志,2012,6(6):375-378.
[9]Wilkinson A,Davidson J,Dotta F,et al.Guidelines for the treatment and management of new-onset diabetes after transplantation[J].Clin Transplant,2005,19(3):291-298.
[10]Balla A,Chobanian M.New-onset diabetes after transplantation:a review of recent literature[J].Curr Opin Organ Transplant,2009,14(4):375-379.
[11]Staatz CE,Goodman Lk,Tett SE.Effect of CYP3A and ABCB1 single nucleotide polymorphisms on the pharmacokinetics and pharmacodynamics of calcineurin inhibitors:partⅡ[J].Clin Pharmacokinet,2010,49(4):207-221.
[12]Vincenti F,Friman S,Scheuermann E,et al.Results of an international,randomized trial comparing glucose metabolism disorders and outcome with cyclosporine versus tacrolimus[J].Am J Transplant,2007,7(6):1506-1514.
[13]于立新,单海涛,刘小友,等.糖尿病合并终末期肾病肾移植术后应用他克莫司与环孢素A的比较[J].中华器官移植杂志,2005,26(6):347-348.
[14]Ekberg H,Tedesco-Silva H,Demirbas A,et al.Reduced exposure to calcineurin inhibitors in renal transplantation[J].N Engl J Med,2007,357(25):2562-2575.
[15]Cook AM,Whitlow J,Hatton J,et al.Cyclosporine A for neuroprotection:establishing dosing guidelines for safe and effective use[J].Expert Opin Drug Saf,2009,8(4):411-419.
[16]Moe S,Drueke T,Cunningham J,et al.Kidney disease:improving global outcomes(KDIGO).definition and classification of chronic kidney disease:a position statement from kidney disease:improving global outcomes(KDIGO)[J].Kidney Int,2005,67:2089-100.
[17]YU Yi,NIE Haibo,WANG Wei,et al.Outcomes of conversion to sirolimus therapy for new-onset diabetes mellitus after kidney transplantation[J].South Med Univ,2014,34(5):690-693.
