双歧杆菌插入失活载体的构建
2015-01-02万翠香长治医学院微生物学教研室长治046000南昌大学食品科学与技术国家重点实验室通讯作者mailcuixiangwanncueducn
崔 佳,万翠香(长治医学院微生物学教研室,长治 046000;南昌大学食品科学与技术国家重点实验室;通讯作者,E-mail:cuixiangwan@ncu.edu.cn)
插入突变是研究功能基因组学的一种重要方法,可为确定基因的功能提供最直接的证据[1]。本文应用的是质粒介导的插入突变,它是研究微生物功能基因组学的一种常用方法,其原理是将不能自主复制的自杀性质粒转化入宿主,与宿主基因进行同源重组,达到对特定基因的改造或失活,进而开展基因功能的研究[2,3]。
自2006年雀巢公司发现在双歧杆菌NCC2705中存在丝氨酸蛋白酶抑制剂Serpin(serine protease inhibitor)以来,先后在短双歧杆菌210B中也发现Serpin蛋白[4],然而关于Serpin蛋白在原核生物特别是在双歧杆菌中的功能鲜见研究报道[5-7]。在本实验室前期工作中,叶若松等[8]通过PCR扩增和Southern印迹杂交的方法发现B.bifidum WBBI02中存在serpin,将其连接入克隆载体pMD18-T和表达载体pET22b(+),使serpin在大肠杆菌原核表达系统中表达,且进行了体外黏附功能研究。本实验利用前期构建的质粒pMD18-T/serpin在serpin基因片段的SacⅡ酶切位点插入氯霉素抗性基因cmr,构建出双歧杆菌pMD18-T/serpin-cmr插入失活质粒,为后续筛选双歧杆菌serpin突变株逆向研究serpin功能做准备。
1 材料与方法
1.1 菌株与质粒
菌株:E.coli.DH5α(南昌大学食品科学与技术国家重点实验室保藏)。质粒:pMD18-T/serpin质粒(南昌大学食品科学与技术国家重点实验室前期构建);pNZ44质粒(南昌大学食品科学与技术国家重点实验室保藏)
1.2 主要试剂与仪器
SacⅡ内切酶、CIAP去磷酸化酶均购自于TaKa-Ra大连宝生物有限公司;质粒提取试剂盒购自于北京全式金生物技术有限公司;PCR产物纯化试剂盒购自于北京赛百盛基因技术有限公司;PCR仪:德国Eppendorf公司;离心机:德国Thermo公司;凝胶成像系统:美国Bio-Rad公司。
1.3 提取pMD18-T/serpin和pNZ44质粒,克隆氯霉素抗性基因cmr
采用EasyPure Plasmid MiniPrep Kit(北京全式金生物技术有限公司)提取pMD18-T/serpin和pNZ44质粒。根据已发表的氯霉素抗性基因序列,本实验设计cmr基因引物,上游引物:GCCGCGGATGAACTTTAATAAAATTGATTTAGAC(SacⅡ)和下游引物:GCCGCGGTTTTATAAAAGCCAGTCATTAG(SacⅡ),对提取的pNZ44质粒的cmr基因进行PCR扩增。采用1.0%琼脂糖凝胶电泳检测PCR产物,并采用北京赛百盛基因技术有限公司的PCR产物纯化试剂盒,对PCR产物进行回收纯化。
1.4 单酶切pMD18-T/serpin和cmr,连接后筛选重组质粒pMD18-T/serpin-cmr
用SacⅡ对质粒pMD18-T/serpin进行单酶切,得到开环质粒,为防止质粒本身自连,单酶切后的质粒进行去磷酸化反应,将5'-P转化为5'-OH,再按照去磷酸化体系∶树脂=1∶1对去磷酸化后的质粒回收。同时将PCR扩增到的cmr产物也经SacⅡ酶切,酶切后回收并与pMD18-T-serpin载体进行连接,将连接体系转入DH5α感受态细胞中,经菌落PCR验证初步挑选出阳性克隆,再提取重组质粒pMD18-T/serpin-cmr,用SacⅡ作酶切验证,验证正确的质粒送往南京金斯瑞公司测序。
2 结果
2.1 pMD18-T/serpin质粒的提取和cmr的扩增结果
pMD18-T/serpin质粒提取后经琼脂糖凝胶电泳后结果见图1A;cmr扩增产物电泳后结果见图1B;在750 bp左右可见目的基因片段,与预期结果相符。

图1 pMD18-T/serpin质粒提取和PCR扩增cmr电泳图谱Figure 1 Electrophoresis of the plasmids extraction of pMD18-T-serpin and PCR amplification of cmr
2.2 载体pMD18-T/serpin酶切去磷酸化后回收检测
为了避免pMD18-T/serpin酶切后自连,将酶切回收后的pMD18-T/serpin磷酸化处理,0.5 h后树脂回收去磷酸化产物,电泳检测回收产物,结果显示,在约3 000-4 000 bp之间可见目的基因条带(见图2),与预期结果一致。

图2 去磷酸化后回收电泳图谱Figure 2 Electrophoresis of dephosphorylated products
2.3 菌落PCR验证阳性克隆子
挑取转化平板上的单菌落用cmr引物进行菌落PCR验证,结果显示,筛选的3个克隆在750 bp附近都扩增出了条带(见图3),与目的基因cmr的片段长度相符合,电泳结果初步判定筛选到的菌落为阳性克隆。
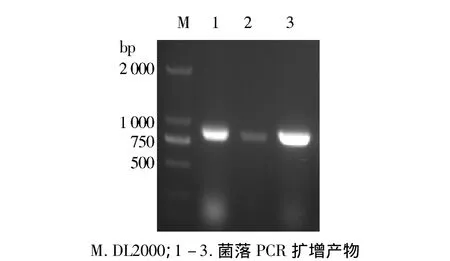
图3 菌落PCR电泳图谱Figure 3 Electrophoresis of colony PCR
2.4 酶切验证阳性克隆
菌落PCR验证显阳性的克隆再进行SacⅡ酶切验证,电泳结果(图4)显示,1号泳道的克隆酶切到cmr基因,而2号泳道的克隆酶切验证阴性。将1号泳道的阳性重组质粒测序,序列分析表明:克隆获得的cmr基因片段为768 bp(见图4),与 GenBank中序列完全一致。

图4 pMD18-T/serpin-cmr酶切鉴定电泳图Figure 4 Electrophoresisofrecombinantplasmid pMD18-T/serpin-cmr digested by enzymes
3 讨论
抗生素的广泛使用,使得双歧杆菌的抗药性越来越多样化。易发平等[9]研究报道,两歧双歧杆菌对氨基糖苷类和黄胺类抗生素具有抗性,而对氨苄类和氯霉素类抗生素敏感。而康小红等[10]的研究显示,双歧杆菌对青霉素类、喹诺酮类抗生素也具有抗性,而对氯霉素类敏感。石晶红[11]在对12株双歧杆菌的药敏性研究中发现,双歧杆菌对氯霉素类抗生素敏感。因此,我们选择以氯霉素类抗生素为标记构建插入失活载体,作为突变株的筛选标记。
功能基因组研究的一个重要内容是突变体的构建,这是因为突变体和相应的突变基因间有着直接的因果关系[12],构建突变体库的方法有物理和化学诱变、基因沉默、基因敲除以及插入突变等。插入突变与其他方法相比具有很多优点,该方法利用已知的插入序列作为标记基因,直接可对未知基因进行反向研究,不必事先确定基因表达和基因产物[1,13],且插入突变具有操作简便、快捷的特点。因此,在功能基因组学研究中插入突变已成为基因初步鉴定及功能研究的首选方法[14,15]。利用插入突变进行功能基因组学研究时主要采用T-DNA、转座子及质粒介导的插入突变等方法构建突变库[16],本研究即采用质粒介导的插入突变方法试图对长双歧杆菌中Serpin进行功能失活的研究。实验中我们成功构建了双歧杆菌serpin基因的插入失活载体pMD18-T/serpin-cmr,为后续通过同源重组获得serpin突变株提供了打靶载体,进而对逆向探究双歧杆菌Serpin蛋白的黏附功能改变奠定了工作基础[17-19]。
[1]孟凡立,张卫国,陈庆山,等.插入突变在功能基因组学研究中的应用[J].生物信息学,2006,3(4):38-40.
[2]周维,付喜爱,张德显,等.基因敲除技术的研究进展[J].中国兽医杂志,2015,51(3):67-69.
[3]陶果,信吉阁,肖晶,等.基因敲除技术最新研究进展及其应用[J].安徽农业科学,2013,41(29):11605-11608.
[4]Turroni F,Foroni E,Motherway MO,et al.Characterization of the serpin-encoding gene of Bifidobacterium breve 210B[J].Appl Environ Microbiol,2010,76(10):3206-3219.
[5]Alvarez-Martin P,O’Connell-Motherway M,Turroni F,et al.A twocomponent regulatory system controls autoregulated serpin expression in Bifidobacterium breve UCC2003[J].Appl Environ Microbiol,2012,78(19):7032-7041.
[6]Al-Horani RA.Serpin regulation of fibrinolytic system:implications for therapeutic applications in cardiovascular diseases[J].Cardiovasc Hematol Agents Med Chem,2014,12(2):91-125.
[7]Roberts TH,Hejgaard J,Saunders NF,et al.Serpins in unicellular Eukarya,Archaea and Bacteria:sequence analysis and evolution[J].J Mol Evol,2004,59(4):437-447.
[8]叶若松,黎鹏,章昭琳,等.两歧双歧杆菌中serpin基因的克隆、表达与功能分析[J].中国生物工程杂志,2011,32(2):38-42.
[9]易发平,马永平,钟贞,等.一株新分离的人两歧双歧杆菌耐药性研究[J].中国微生态学杂志,2005,17(2):92-93.
[10]康小红,柳翰凌.两株双歧杆菌药敏性及其质粒DNA的检测[J].食品工业科技,2008,29(8):124-126.
[11]石晶红.双歧杆菌对12种抗生素的敏感性[J].河套大学学报,2008,5(4):20-26.
[12]李今煜,陈健铭,彭振坤.几种常用的基因敲除技术[J].武夷科学,2007,23(1):187-189.
[13]苏红,印莉萍.插入突变在水稻功能基因组学中的研究进展[J].生物技术通报,2009(5):1-4.
[14]倪银芸,宋光艳,钱炳俊,等.枯草芽孢杆菌rocG基因插入失活突变株的构建[J].上海交通大学学报(农业科学版),2014,32(6):32-37.
[15]庞欢瑛,陈立明,黄郁葱,等.溶藻弧菌dldh基因突变株的构建及其生物学功能研究[J].生物技术通报,2014(10):161-167.
[16]Guglielmetti S,Mayo B,Alvarez-Martin P.Mobilome and genetic modification of bifidobacteria[J].Benef Microbes,2013,4(2):143-166.
[17]Sangrador-Vegas A,Stanton C,van Sinderen D,et al.Characterization of plasmid pASV479 from Bifidobacterium pseudolongum subsp.globosum and its use for expression vector construction[J].Plasmid,2007,58(2):140-147.
[18]Guglielmetti S,Ciranna A,Mora D,et al.Construction,characterization and exemplificative application of bioluminescent Bifidobacterium longum biovar longum[J].Int J Food Microbiol,2008,124(3):285-290.
[19]Efimov BA,Shkoporov AN,Khokhlova EV,et al.Bifidobacterial plasmids and their application to genetic engineering.Vestn Ross Akad Med Nauk,2008(2):16-21.
