胡杨小孢子母细胞减数分裂与花粉变异研究
2015-01-02张平冬康向阳
陈 欣,杨 倩,张平冬,康向阳
(北京林业大学 林木育种国家工程实验室 林木花卉遗传育种教育部重点实验室,北京100083)
减数分裂是生物有性生殖的重要过程,是遗传重组和物种进化的基础,也是细胞遗传学和生殖生物学领域长久不衰的研究课题[1-2]。在植物界,减数分裂需经历染色体复制、同源染色体联会、染色体片段交换、同源染色体分离、姊妹染色体单体分离以及细胞质分裂等一系列复杂的生物学现象,并最终形成大量具有活力的小孢子,参与有性生殖过程。现代分子遗传学研究表明,植物减数分裂是一个多基因在减数分裂不同时期和花器不同部位参与表达的精细过程,其中任何过程出现异常都可能导致花粉产生变异,甚至会致使小孢子败育。
胡杨(Populus euphratica)是我国西部干旱荒漠地区内陆河流域两岸天然分布的乔木树种之一,具有耐盐碱[3]、抗干旱等优良特性,在维护分布区内的生态平衡、保障绿洲区农牧业生产和为居民提供木材等方面发挥着重要作用[4],具有一定的育种价值。由于其无性繁殖困难,与杨属内其他派间树种杂交可配性差,严重制约了胡杨良种选育研究的进程[5]。20世纪80年代,李文钿[6]等对胡杨小孢子母细胞的发生发育开展了初步研究。张平冬[7]等利用醋酸洋红压片法和间接免疫荧光法,对胡杨小孢子发生过程中的微管骨架动态变化和染色体行为进行了研究,发现胡杨花粉中存在未减数2n花粉。至今还未见胡杨减数分裂进程与花芽外部形态、花药颜色以及花粉变异间相关关系的报道。本文利用醋酸洋红压片法对胡杨小孢子母细胞减数分裂进程与花芽外部形态以及花药颜色变化的关系、花粉形态多样性等开展了研究。该研究有助于理解杨属派间减数分裂行为差异和特异现象以及减数分裂异常与花粉变异的关系,为胡杨良种选育策略的制定提供理论参考。
1 材料与方法
1.1 试验材料
2011年12月中旬,课题组成员去往内蒙古自治区额济纳旗东河乌兰图格地区的胡杨天然林进行胡杨雄花枝采集。胡杨雄性样株的选取采用随机抽样法抽取,共计抽取了18个雄性样株。为了保证每样株属于不同的基因型,抽样时每样株间的间距至少50m以上。分单株采集花枝,塑料布包裹后快递运回北京林业大学。
1.2 试验方法
2011年12月底,将胡杨雄花枝移入北京林业大学林木育种国家工程实验室温室进行切枝水培,培养温度控制10~20℃。每隔3~4h随机摘取2~3个雄花芽,经卡诺固定液(乙醇∶乙酸=3∶1)固定后,利用醋酸洋红染色法制作临时压片,即时判别小孢子母细胞减数分裂时期。待小孢子母细胞发育至细线期时,每隔2h固定1次,每次固定3~5个花芽,直至花药成熟散粉为止。胡杨花药在-4℃的冰箱固定24h后,转移至70%的酒精中保存待用。
采用醋酸洋红染色压片法观察小孢子母细胞减数分裂染色体行为,永久制片参考康向阳[8]的方法:取经卡诺固定液充分固定的胡杨雄花芽,摘取中部小花,去除花盘后放置在洁净的载玻片上,滴加4、5滴醋酸洋红,用尖嘴镊子夹碎花药制作涂片,经火焰干燥后进行镜检、照相。
收集胡杨成熟花粉,经醋酸洋红染色后,放置于Olympus BX51光学显微镜下进行镜检,并采用O-lympus DP70显微照相系统进行数码拍照,花粉粒直径测量以及天然2n花粉比率的统计。每基因型测量2 000个以上的花粉粒。直径超过其平均值1.28倍的花粉粒被视为2n花粉[9]。2n花粉频率为2n花粉占观察花粉粒总数的百分比。
2 结果与分析
2.1 胡杨减数分裂进程与雄花芽外部形态变化的对应关系
胡杨减数分裂进程与雄花芽外部形态及花药颜色变化存在明显的对应关系(表1)。温室条件下水培至288h,小孢子母细胞进入第1次减数分裂前期,此时雄花芽略微膨大,花药颜色为嫩绿色(图1,A-B);随后,花芽进一步膨大,芽鳞出现微裂,花药颜色由微黄色转变成微红色(图1,C-H),小孢子母细胞减数分裂由中期Ⅰ发育至末期Ⅱ。水培至316h,小孢子母细胞减数分裂进入四分体时期,花芽仍在继续膨大,芽鳞裂口增大,花药颜色由微红色转变为浅红色(图1,I-J)。

表1 胡杨减数分裂进程与雄花芽形态以及花药颜色变化的对应关系Table 1 Relationship between meiotic stage of microspore mother cell and shapes of flower bud and anther color in Populus euphratica
2.2 胡杨减数分裂染色体行为观察
胡杨雄花枝经历约288h的水培后,小孢子母细胞发育至细线期,此时可观察到2个正在融合的核仁,一个大核仁和一个小核仁,染色体呈细线状,聚集成团,偏在核仁的一侧(图2-1);偶线期,染色体缩短变粗,同源染色体相互靠近,开始出现联会现象,2个核仁依然清晰可见(图2-2);粗线期,同源染色体联会结束,形成四合体,染色体明显变粗,核仁融合结束,形成一个核仁(图2-3);进入双线期后,四合体继续缩短变粗,同源染色体开始部分分离(图2-4),单价体偶尔可见,可观察到3对同源染色体与核仁相连(图2-5);终变期,染色体进一步缩短,呈颗粒状,核仁变小直至消失,是染色体计数最佳时期之一(图2-6)。紧接着,减数分裂进入中期Ⅰ,此时核仁完全消失,细胞内出现纺锤体,四合体逐渐移向赤道板,并整齐地定位于赤道板中央(图2-7),单价体清晰可见(图2-8);后期Ⅰ,由于纺锤体牵引,同源染色体逐步分离,向细胞两极移动(图2-9),常伴随有落后染色体,滞留在赤道板中央(图2-10);同源染色体抵达到细胞两极后,减数分裂进入末期Ⅰ(图2-11),此时染色体开始解螺旋,核仁重现(图2-12),每子核最多可见8个小核仁(图2-13),染色体恢复成线状,难以染色观察,标志着减数第一次分裂结束。
随着小核仁融合,染色体又一次缩短变粗,外形呈“X”型,表明减数分裂已进入前期Ⅱ(图2-14);至中期Ⅱ,核仁消失,染色体移向子细胞的赤道板中央,出现纺锤体,可以看见平行纺锤体(图2-15)、三极纺锤体(图2-16)以及融合纺锤体(图2-17)3种形态,偶尔还可看见减数分裂中期Ⅱ的不同步现象,其中一子细胞的染色体已表现出中期Ⅱ的特征,而另一子细胞的染色体还停留在晚前期Ⅱ(图2-18);后期Ⅱ,姊妹染色单体在纺锤体的牵引下彼此分离,移向子细胞的两极(图2-19),也能看见落后染色体(图2-20);分离的姊妹染色单体抵达子细胞的两极后,减数分裂进入末期Ⅱ(图2-21),此时姊妹染色体单体进行解螺旋,核膜核仁重新出现,标志着第二次减数分裂结束。与末期Ⅰ相似,末期Ⅱ也可观察到多核仁现象(图2-22),且每一子核内最多能观察到4个核仁。一般来说,小孢子母细胞经减数分裂会形成四分孢子,即四分体(图2-23)。但由于减数分裂中期Ⅱ纺锤体定位异常和胞质分裂异常的发生,通常可观察到三分体(图2-24)和二分体(图2-25)的存在。
2.3 胡杨花粉形态多样性
小孢子母细胞减数分裂的直接产物就是花粉。由于胡杨减数分裂Ⅱ平行纺锤体、三极纺锤体以及融合纺锤体的存在,胞质分裂异常,致使天然未减数2n花粉(图2-26)以及连体花粉(图2-27)的产生。18个胡杨雄株的平均花粉粒直径、2n花粉以及连体花粉频率的调查结果见表2。
一般认为,花粉粒直径大于该无性系或树种花粉粒平均直径1.28倍的花粉粒为未减数的2n花粉。在胡杨花粉中有未减数2n花粉的存在(图2-26),且在不同基因型之间2n花粉频率存在明显差异(表2)。在18个胡杨雄株中,基因型HY1等16个胡杨单株可以产生2n花粉,基因型HY17以及HY31不产生2n花粉。在产生2n花粉胡杨雄性单株个体中,不同单株间2n花粉频率具有一定的差异,其中以基因型HY25的2n花粉频率最高,达4.37%;基因型HY7以及HY28的2n花粉频率最低,仅为0.49%。通过统计四分体时期四分体、三分体以及二分体的产生频率,可以计算出理论2n花粉频率(表2)。经χ2检验发现2n花粉的理论值与实际观察值相符。
胡杨花粉中有时也可以看见连体花粉的存在(图2-27),也就是2个花粉粒在相接触部位只形成不完整的花粉壁,或虽形成花粉壁但仍由胼胝质粘连在一起的异常花粉。从表2可以看出,尽管连体花粉的发生频率较低,介于0.07%~0.55%之间,但连体花粉在胡杨不同单株间是普遍存在的。
从表2还可以看出,胡杨花粉的平均直径为(29.7±1.9)μm。不同胡杨基因型间花粉粒平均直径存在一定的差异,其中以基因型HY14的平均花粉粒直径最大,为(33.0±3.5)μm,基因型 HY28的平均花粉粒直径最小,仅为(26.5±2.9)μm。不同基因型间花粉粒直径的方差分析结果表明,基因型对胡杨花粉粒大小的影响达到了显著水平。基因型HY14、HY20、HY34、HY23、HY33以及 HY8的花粉粒平均直径显著大于基因型HY28、HY24以及HY25的平均直径。在同一基因型内,胡杨花粉粒直径也存在一定的差异,其中以基因型HY25花粉粒直径的差异最大,其标准差达5.1μm,基因型HY17花粉粒直径的差异最小,其标准差为2.2μm。
3 结论与讨论
研究发现,在温室10~20℃切枝水培316h,胡杨小孢子母细胞可完成减数分裂。随着减数分裂的发生、发展,雄花芽的外部形态和花药颜色也会发生相应变化。其中以花药颜色变化较为明显,由细线期的嫩绿色转变为四分体时期的浅红色,可作为即时判别胡杨小孢子母细胞减数分裂进程的外部形态学依据[10]。
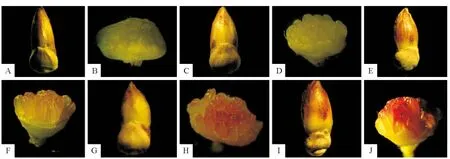
图1 胡杨小孢子母细胞减数分裂与花粉变异Fig.1 On meiosis of microspore mother cell and variations of pollen grains in P.euphratica

图2 胡杨小孢子母细胞减数分裂与花粉变异Fig.2 On meiosis of microspore mother cell and variations of pollen grains in P.euphratica
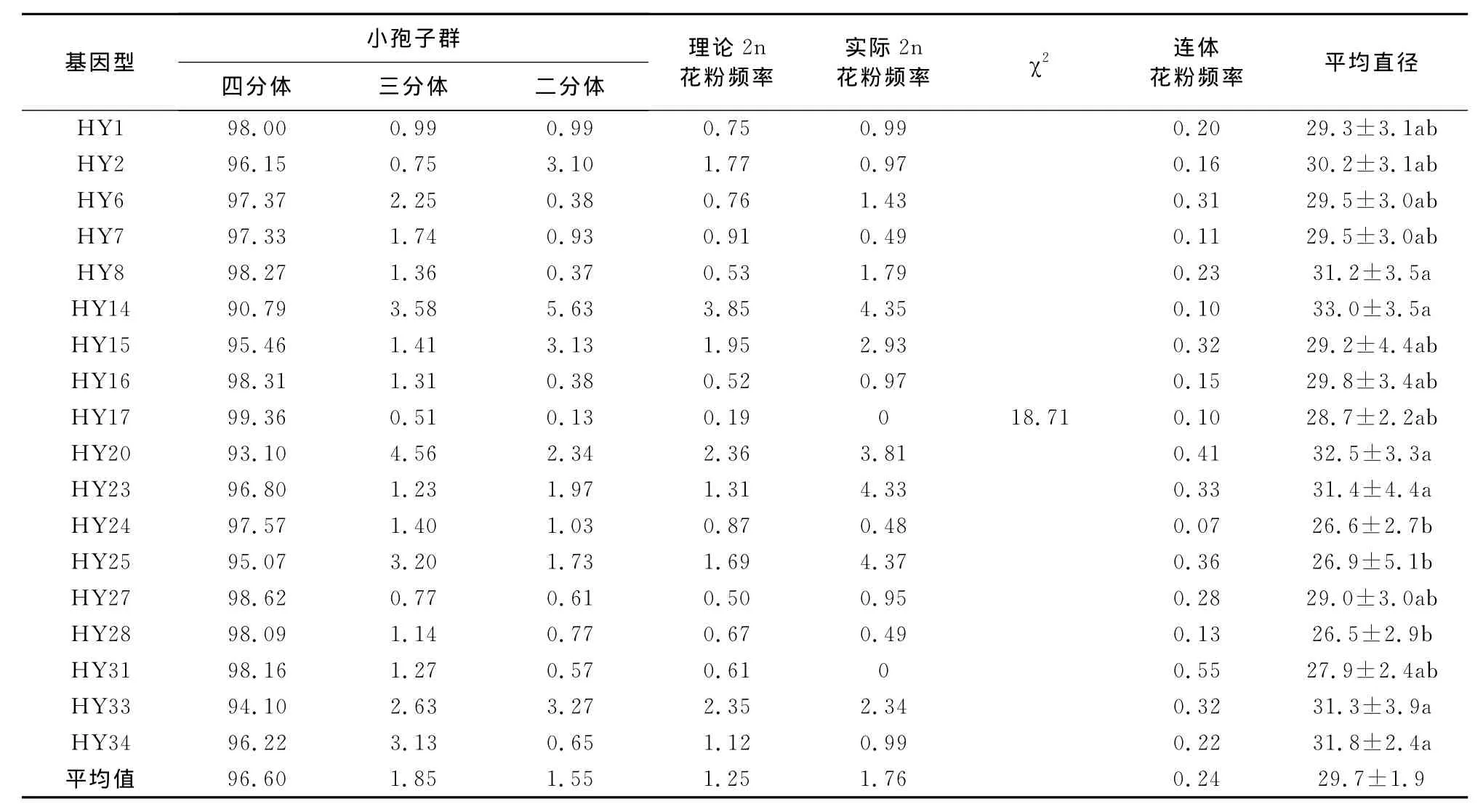
表2 胡杨小胞子母细胞减数分裂四分体时期的小孢子群以及花粉变异Table 2 Frequency of different sporads,expected and observed rates of 2npollen grains,and diameter of pollen grains in P.euphratica
从减数分裂过程中染色体行为变化来看,其减数分裂双线期和中期Ⅰ均有单价体存在,说明胡杨减数分裂偶线期联会的二价体结合松散;另外,后期Ⅰ、末期Ⅰ以及后期Ⅱ可观察到落后染色体,表明胡杨的19对同源染色体之间表现出了一定程度的异质性。这种异质性可能与胡杨花粉的部分败育现象(图2-28)有关。
胡杨小胞子发生过程中常常伴随有核仁形态和核仁数目的动态变化,在减数分裂末期Ⅰ以及末期Ⅱ的子核内,最多可见8个核仁。曾在‘中东杨’(Populus berolinensis)[11]、毛白杨(Populus tomentosa)[8,12]、响叶杨(Populus adenopoda)[10,13]、欧洲黑杨 (Populus nigra)[14]以 及 ‘通 辽 杨’(Populus mionii×Populus nigra ‘Tong liao’)[15]的小胞子母细胞减数分裂过程也发现了此现象,这表明多核仁现象可能是普遍存在于杨属植物减数分裂过程中。因核仁数目与植物的倍性关系密切,多核仁现象是多倍性的一种重要标志,据此推测,这种多核仁现象可能与杨属植物的古多倍体起源紧密相关[8,16]。另外,由于最多的核仁数目应与核仁组织者(NOR)区的数目相等[17],试验中观察到胡杨减数分裂末期Ⅱ的4个子细胞中核仁数目最多为8个,这与毛白杨[8]、响叶杨[10]以及通辽杨[15]的研究结果相似,据此推断胡杨染色体组中至少有8对具有核仁组织者区的染色体。
在杨属植物中,已在毛白杨[18-19]、响叶杨[13]、‘通辽杨’[15]、香脂杨(Populus balsamifera)[20]以及灰杨(Populus canescens)[21]等树种中均发现有天然未减数2n花粉的存在。有关研究表明,染色体联会、着丝粒分裂、中期Ⅱ纺锤体定位、胞质分裂等异常以及减数后加倍均可导致2n花粉发生[22-24]。其中纺锤体定位异常倍受植物遗传学家的关注[25]。一般认为,平行纺锤体和融合纺锤体可致使二分体的产生,三极纺锤体则可导致三分体的产生。据文献报道,毛白杨天然2n花粉发生主要是由于减数第二次分裂过程平行纺锤体极点融合所致[26]。在本研究中,减数分裂中期Ⅱ可以观察到一定比例的平行纺锤体、三极纺锤体以及融合纺锤体的同时,也可以观察到0~4.37%比例不等的天然2n花粉。这预示着胡杨小胞子母细胞减数分裂中期Ⅱ纺锤体定位异常可能与天然2n花粉的形成相关。
连体花粉是植物小孢子母细胞减数分裂后胞质分裂失败的产物。据文献记载,松香草(Silphium perfoliatum)、毛白杨、‘通辽杨’、白杨异源三倍体等树种中均存在一定比例的连体花粉[19,27-29],说明连体花粉的发生在植物界具有普遍性。有关连体花粉发生的遗传学机理有待进一步研究。
[1] MC CORMICK S.Male gametophyte development[J].Plant Cell,1993(5):1265-1275.
[2] MA H.Molecular genetic analysis of microsporogenesis and microgametogenesis in flowing plants[J].Annu Rev Plant Biol,2005,56:393-434.
[3] 陈彩霞,司瑞新,沈昕,等.转 Na+/H+逆向转运蛋白(PeN-haD1)基因派间杂种110杨的获得[J].西北林学院学报,2009,24(1):61-65.CHEN C X,SI X R,SHEN X,et al.Genetic transformation of PeNhaD1gene to the hybrid poplar 110 [J].Journal of Northwest Forestry University,2009,24(1):61-65.(in Chinese)
[4] 张昊,李景文,李俊清,等.额济纳绿洲胡杨地上部分建构模式的研究[J].西北林学院学报,2009,24(5):46-49.ZHANG H,LI J W,LI J Q,et al.Branching patterns of Populus euphraticain the Ejina Oasis of Inner Mongolia[J].Journal of Northwest Forestry University,2009,24(5):46-49.(in Chinese)
[5] 张平冬,康向阳,韩锦.胡杨嫁接繁殖研究初报[J].干旱区资源与环境,2005,19(4):197-200.
[6] 李文钿,朱彤.胡杨花粉和胚囊的发育[J].林业科学研究,1988,1(2):132-137.
[7] 张平冬,康向阳.胡杨小孢子发生及微管骨架变化与异常研究[J].西北植物学报,2013,33(11):2166-2177.ZHANG P D,KANG X Y.Organization of microtubule and its abnormities during microsporogenesis in Populus euphratica[J].Acta Botanica Boreali-occidentalia Sinica,2013,33(11):2166-2177.(in Chinese)
[8] 康向阳.毛白杨细胞遗传与三倍体选育[M].北京:中国环境科学出版社,2002.
[9] ORJEDA G,FREYRE R,IWANAGA M.Production of 2n pollen in diploid Ipomoea trifida,aputative wild ancestor of sweet potato[J].J.Hered,1990,81:462-467.
[10] 鲁敏,王君,王旭军,等.响叶杨小孢子母细胞减数分裂及染色体行为的研究[J].植物科学学报,2011,29(2):171-177.LU M,WANG J,WANG X J,et al.Meiosis and chromosome behavior of microsporocytes in Populus adenopoda Maxim [J].Plant Science Journal,2011,29(2):171-177.(in Chinese)
[11] 刘玉喜,张敩方,陆志华.中东杨小孢子的发生[J].东北林学院学报,1979(2):1-4.
[12] 康向阳,朱之悌,张志毅.毛白杨花粉母细胞减数分裂及其进程的研究[J].北京林业大学学报,2000,22(6):5-7.KANG X Y,ZHU Z T,ZHANG Z Y.Meiosis and its stages of pollen mother cells in Chinese white poplar[J].Journal of Beijing Forestry University,2000,22(6):5-7.(in Chinese)
[13] 鲁敏.响叶杨三倍体和四倍体诱导技术研究[D].北京:北京林业大学,2013.
[14] 许雯婷,赵健,赵楠,等.欧洲黑杨花粉母细胞减数分裂观察及其不同步性分析[J].西北植物学报,2011,31(10):1981-1987.XU W T,ZHAO J,ZHAO N,et al.Meiosis of pollen mother cells and their asynchrony in Populus nigra L.[J].Acta Botanica Boreali-occidentalia Sinica,2011,31(10):1981-1987.(in Chinese)
[15] 王君,康向阳,李代丽,等.通辽杨花粉母细胞减数分裂及其染色体行为研究[J].西北植物学报,2006,26(11):2231-2238.WANG J,KANG X Y,LI D L,et al.Meiosis and chromosome behavior of pollen mother cell in Populus simonii Carr.× P.nigra L.‘Tongliao’[J].Acta Botanica Boreali-occidentalia Sinica,2006,26(11):2231-2238.(in Chinese)
[16] VAN DILLEWIJN C.Cytology and breeding of Populus[J].Ned Boschb Tijdschr,1939,12:470-481.
[17] 李懋学,张赞平.作物染色体及其研究技术[M].北京:中国农业出版社,1996.
[18] 朱之悌,林惠斌,康向阳.毛白杨异源三倍体B301等无性系选育的研究[J].林业科学,1995,31(6):499-505.ZHU Z T,LIN H B,KANG X Y.Studies on allotriploid breeding of Populus tomentosa B301clones[J].Scientia Silvae Sinicae,1995,31(6):499-505.(in Chinese)
[19] 康向阳.毛白杨未减数2n花粉发生机制的研究[J].北京林业大学学报,2002,24(5/6):67-70.KANG X Y.Mechanism of 2npollen occurring in Chinese white poplar [J].Journal of Beijing Forestry University,2002,24(5/6):67-70.(in Chinese)
[20] MANZOS A M.Fastgrowing form of Populus balsamifera obtaied by polliating female flowers with fractionated pollen of the same species[J].DoklAkad Nauk S SSR,1960,130(2):433-435.
[21] SEITZ FW.The occurrence of triploids after self-pollination of anomalous androgynous flowers of a gray poplar[J].Z.Forstgenet,1954,3(1):1-6.
[22] VEILLEUX R.Diploid and polyploid gametes in crop plants:Mechanisms of formation and utilization in plant breeding[J].Plant Breed Rev.,1985,3:253-288.
[23] BRETAGNOLLE F,THOMPSON J.Gametes with the somatic chromosome number:mechanisms of their formation and role in the evolution of autopolyploid plants [J].New Phytol.,1995,129:1-22.
[24] RAMSEY J,SCHEMSKE D.Pathway,mechanisms,and rates on polyploid formation in flowering plant[J].Annu.Rev.Ecol.Syst.,1998,29:467-501.
[25] ZHANG J,WEI Z,LI D,et al.Using SSR markers to study the mechanism of 2npollen formation in Populus × euramericana(Dode)Guinier and P.×popularis [J].Ann.For.Sci.,2009,66(506):1-10.
[26] ZHANG Z,KANG X,ZHANG P,et al.Incidence and molecular markers o f 2npollen in Populus tomentosa Carr.[J].Euphytica,2007,154:145-152.
[27] 熊治廷,刘成运,黄仁煌,等.松香草花粉母细胞减数分裂及雄配子体发育-兼对某些异常花粉的观察[J].武汉植物学报,1989,8(3):297-300.XIONG Z T,LIU C Y,HUANG R H,et al.Pollen mother cell meiosis and pollen development in Silphium perfoliatum L.with observation on some abnormal pollen grains [J].Journal of Wuhan Botanical Research,1990,8(3):297-300.(in Chinese)
[28] 王君.青杨派树种多倍体诱导技术研究[D].北京:北京林业大学,2009.
[29] WANG J,KANG XY,ZHU Q.Variation in pollen formation and its cytological mechanism in an allotriploid white poplar[J].Tree Genetics &Genomes,2010(6):281-290.
