胃癌细胞中BNIP3基因CpG岛甲基化及其调控作用
2015-01-02
(沈阳医学院1.病理生理教研室;2.生理教研室;3.2012级医学影像专业,沈阳 110034)
胃癌细胞中BNIP3基因CpG岛甲基化及其调控作用
沈薇1,刘坤2,隋璐1,邹丹1,胡金瑶3
(沈阳医学院1.病理生理教研室;2.生理教研室;3.2012级医学影像专业,沈阳 110034)
目的观察胃癌细胞株MKN1中BNIP3基因启动子区的甲基化状态,探讨DNA甲基化调控BNIP3表达的机制。方法应用亚硫酸氢盐修饰后克隆测序法检测MKN1细胞中BNIP3基因启动子区的甲基化状态,应用甲基化抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-CdR)处理MKN1细胞,观察给药前后BNIP3mRNA表达及启动子区CpG岛甲基化状态的改变。应用染色质免疫沉淀技术检测BNIP3基因与DNA甲基化转移酶1(DNMT1)的结合。结果MKN1细胞中BNIP3基因启动子区呈高甲基化状态。应用5-Aza-CdR处理细胞后,药物处理组(5-Aza-CdR浓度为10 μmol/L)和对照组甲基化率和BNIP3mRNA表达的差异均有统计学意义(P<0.05)。5-Aza-CdR抑制MKN1细胞中DNMT1与BNIP3基因的结合。结论MKN1细胞中BNIP3基因表达受启动子区CpG岛甲基化调控,DNA甲基化的发生与DNMT1和BNIP3基因结合有关。
BNIP3基因;DNA甲基化;胃肿瘤;5-氮杂-2′-脱氧胞苷
胃癌是恶性程度较高的消化道肿瘤,其发生发展常涉及多个抑癌基因的异常表达。在胃癌癌变早期,抑癌基因的表观遗传学改变占有重要地位,尤其是抑癌基因启动子的异常甲基化[1,2]。Bcl-2腺病毒E1B 19 kDa相关蛋白3(Bcl-2/adenovirus E1B 19 kDa-interacting protein 3,BNIP3)属于缺氧诱导的线粒体促凋亡蛋白,在胃癌、胰腺癌、结直肠癌等多种消化道肿瘤中检测到BNIP3表达缺失[3~6]。甲基化酶抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)可以恢复BNIP3表达缺失的胃癌、结肠癌细胞中BNIP3 mRNA的表达水平[3,6]。但胃癌细胞中BNIP3基因启动子区甲基化的具体位点及DNA甲基化调控BNIP3表达的机制尚不完全清楚。亚硫酸氢盐修饰后克隆测序法(bisulfate sequencing polymerase chain reaction,BSP)为一种基于亚硫酸氢盐修饰的甲基化定量研究方法,可以对基因启动子区数十乃至数百个CpG位点的甲基化水平进行精确量化[7]。本研究拟通过BSP法检测胃癌细胞中BNIP3基因启动子区DNA甲基化状态,采用染色质免疫沉淀技术(chromatin immunoprecitation,ChIP)检测BNIP3基因与DNA甲基化转移酶1(DNA methyltransferase 1,DNMT1)的结合情况,分析BNIP3基因表达水平与启动子区异常甲基化的相关性,从表观遗传学角度对BNIP3基因的表达调控机制进行深入研究。
1 材料与方法
1.1 材料
人胃癌细胞系MKN1细胞来源于中国医科大学遗传学教研室,5-Aza-CdR购自美国Sigma公司,RPMI1640培养基购自美国Gibco公司,胎牛血清购自美国Hyclone公司,DNA提取试剂盒(Blood&Cell Culture DNA Mini Kit)购自美国Qiagen公司,亚硫酸氢盐修饰试剂盒(EZ DNA Methylation-Gold Kit)购自美国Zymo Research公司,琼脂糖凝胶DNA回收试剂盒、pGEM-T载体、T4 DNA连接酶、GoTaq Master Mix、感受态细胞JM109、RNA提取试剂盒(AxyPrep Total RNA Miniprep Kit)、逆转录酶均购自美国Promega公司,DNMT1单克隆抗体购自美国Santa Cruz公司,染色质免疫沉淀试剂盒购自美国Active Motif公司,引物合成及测序由上海Life Technologies公司完成。
1.2 方法
1.2.1 细胞培养及药物处理:MKN1细胞株用含10%胎牛血清的RPMI 1640培养液,于37℃、5%CO2饱和湿度条件下培养、传代。实验用对数生长期细胞。细胞培养至60%汇合度时,分别加入2 μmol/L或10 μmol/L的5-Aza-CdR处理液,对照组使用不含5-Aza-CdR的普通完全培养液。每隔24 h换液1次,培养72 h后处理细胞用于后续的相关检测。
1.2.2 亚硫酸氢盐修饰DNA和BSP反应:采用Blood&Cell Culture DNA Mini Kit试剂盒,按说明书步骤提取各组细胞基因组DNA。取500 ng DNA按照试剂盒说明进行亚硫酸氢盐修饰及纯化。使未甲基化的胞嘧啶(C)转化成胸腺嘧啶(T),而甲基化的Cm不变。以修饰后基因组DNA为模板,用GoT-aq DNA聚合酶进行BNIP3基因启动子扩增。用MethPrimer软件设计甲基化引物,上游:5′-TTAAAG TGTTGAGATGAAAGATATG-3′,下游:5′-AATCCA AATCCAAATATCAAAATAC-3′,产物长度为288 bp。反应条件为95℃10 min,95℃30 s、56℃30 s、72℃ 30 s进行35个循环,然后72℃延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳,应用胶回收试剂盒回收,纯化目的片段,连接pGEM-T载体,4℃孵育过夜。取6 μL连接产物转化JM109感受态大肠杆菌,蓝白筛选阳性克隆,送菌液测序。
1.2.3 RT-PCR检测BNIP3基因表达:采用Axy-Prep Total RNA Miniprep Kit试剂盒提取各组细胞总RNA,逆转成cDNA后进行PCR实验,BNIP3引物序列:上游:5′-CCACCTCGCTCGCAGACACCAC-3′,下游:5′-GAGAGCAGCAGAGATGGAAGGAAAAC-3′,长度为317 bp。作为内参的人β-actin引物序列:上游:5′-CCAGATCATGTTTGAGACCT-3′;下游:5′-TTGAAGGTAGTTTCGTGGAT-3′,长度为480 bp。扩增反应条件:95℃5 min变性,95℃复性30 s,55℃退火30 s,72℃延伸30 s,30个循环,72℃延伸10 min,4℃暂时保存。实验重复3次。产物行1.2%琼脂糖凝胶电泳,用凝胶成像系统(Tanon-2500R)拍照及分析表达情况。
1.2.4 染色质免疫沉淀:采用ChIP试剂盒按说明书进行如下操作:用1%甲醛PBS交联固定蛋白质-DNA复合物,加入交联终止液5 min,2 500 r/min、4℃离心10 min,PBS洗脱2次;加裂解液冰上裂解5 min,酶法消化切割至200~1 000 bp的染色质小片段;之后,染色质与DNMT1特异性抗体及DNA/Protein G Agorose 4℃颠转过夜,洗脱蛋白/DNA复合物,纯化回收DNA。针对BNIP3启动子区的引物序列:上游:5′-CCGCGCCGCCTCCTCCGCCTCAC-3′;下游:5′-GCTCCGACCTCCGCTTTCCCACCGCC-3′。PCR扩增条件:95℃5 min,95℃30 s,59℃30 s,72℃30 s,72℃10 min,30个循环。产物行1.2%琼脂糖凝胶电泳,用凝胶成像系统(Tanon-2500R)拍照及分析表达情况。
1.3 统计学分析
数据用x±s表示,采用SPSS 13.0统计软件,组间比较采用t检验,甲基化率比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 MKN1细胞中BNIP3基因启动子区的甲基化状态
2.1.1 BNIP3基因启动子区CpG岛序列分析:在ENSEMBLE上找到BNIP3基因启动子区的原始序列,利用MethPrimer分析,按照“长度超过200 bp,GC含量大于50%,CpG出现率(观察值/预测值比例)≥0.6”的参数定义[8],可以找到BNIP3基因启动子区自转录起始点上游966 bp至下游86 bp之间长度为1 052 bp的CpG岛。图1为BSP法拟分析其中长288 bp、含14个CpG位点的DNA片段。

图1 BNIP3基因Cp G岛分析Fig.1 Profile of CpG island within BNIP3gene promoter
2.1.2 BSP结果:以亚硫酸氢盐修饰后的DNA为模板行PCR,将PCR扩增产物连接T载体,转化增菌,PCR扩增鉴定阳性克隆。图2为随机挑取的5个克隆的菌液PCR鉴定结果,在约288 bp处可见理想的目的条带。
2.1.3 测序结果分析:阳性克隆进一步测序,将亚硫酸氢盐修饰后的序列与原序列进行对比,发现非CpG位点的“C”全部转化为“T”,证明亚硫酸氢盐修饰效果可信。扩增的BNIP3启动子区片段包含有14个CpG位点,与原始BNIP3基因序列比对,各CpG位点甲基化概率分别为100%、80%、100%、100%、 80%、100%、100%、100%、80%、100%、100%、80%、100%、100%。见图3及图4。

图2 BSP后目的DNA连T载体挑选阳性克隆电泳图Fig.2 Agarose gel electrophoresis of positive recombinants for target DNA with T carrier in MKN1 cells after BSP

图3 BSP部分测序结果Fig.3 Part of bisulfate sequencing results of BSP for MKN1 cells
2.2 5-Aza-CdR对MKN1细胞中BNIP3表达的影响
采用不同浓度5-Aza-CdR处理MKN1细胞,作用72 h后,对照组、2 μmol/L 5-Aza-CdR处理组和10 μmol/L 5-Aza-CdR组的BNIP3mRNA相对表达量分别为0.389±0.018,0.515±0.024,0.839±0.014。10 μmol/L 5-Aza-CdR组的BNIP3mRNA表达量较对照组明显增加,差异有统计学意义(P<0.05),见图5。
2.3 5-Aza-CdR对MKN1细胞中BNIP3基因启动子甲基化的影响
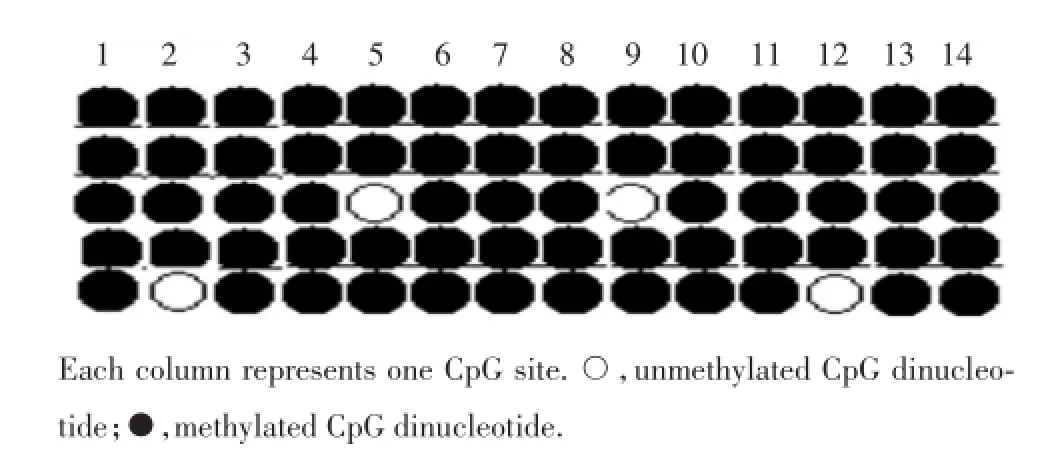
图4 BNIP3基因启动子区14个CpG位点甲基化状态Fig.4 Mehylation status of 14 CpG sites in BNIP3promoter

图5 5-Aza-CdR药物处理前后BNIP3mRNA表达Fig.5 Effect of 5-Aza-CdR on BNIP3 mRNA expression in MKN1 cells
10 μmol/L的5-Aza-CdR处理细胞72 h后,BNIP3基因启动子甲基化状态有所逆转(图6),启动子区CpG位点甲基化率(74.2%±9.37%)与对照组(图4)甲基化率(94.3%±19.80%)比较差异有统计学意义(P<0.05)。

图6 5-Aza-CdR处理后BNIP3基因启动子区CpG位点甲基化状态Fig.6 Methylation analysis of CpG site in BNIP3 promoter after 5-Aza-CdR treatment
2.4 BNIP3启动子与DNMT1蛋白的结合
用ChIP实验检测MKN1细胞中DNMT1与BNIP3启动子区DNA的结合。结果显示,在对照组可以检测到DNMT1与BNIP3启动子区DNA的结合,而10 μmol/L的5-Aza-CdR处理组与对照组相比DNMT1与BNIP3启动子区DNA的结合明显减少。见图7。
3 讨论

图7 5-Aza-CdR对DNMT1与BNIP3启动子结合的影响Fig.7 Binding ability of DNMT1 to the promoter of BNIP3after 5-Aza-CdR treatment by ChIP
DNA甲基化是表观遗传学修饰的重要作用方式之一,指在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5′碳位共价键结合一个甲基基团。越来越多的研究表明,DNA甲基化在癌症的发生机制中扮演重要角色。正常生理条件下,人类基因组中位于启动子区、富含CpG二核苷酸的CpG岛处于非甲基化状态,抑癌基因启动子区CpG岛过度甲基化可诱导基因转录失活、表达沉默[1,2]。BNIP3是Bcl-2家族中BH3-only亚家族的成员,具有BH3结构域和跨膜区,属于促凋亡蛋白,通过促进线粒体通透性、转运开放和线粒体的损伤诱导凋亡。Murai等[3]在66%的结直肠癌和49%的胃癌中检测到BNIP3表达缺失。Abe等[4]发现在几乎所有的胰腺癌组织和50%的胰腺癌细胞系中未检测到BNIP3的表达,其失活机制和DNA启动子区高度甲基化相关。
目前,国内关于BNIP3基因的甲基化研究基本都局限于甲基化特异PCR法[9,10],此方法的特点是灵敏度高,但只能对引物序列中少量CpG位点进行分析,具有一定的局限性。所以关于肿瘤细胞中BNIP3基因启动子区甲基化的具体位点还不清楚。BSP克隆测序法具有能明确目的片段中每一个CpG位点的甲基化状态的优势,是公认的DNA甲基化分析的金标准[7]。本研究利用MethPrimer软件分析了MKN1细胞中BNIP3基因CpG位点分布情况。结果显示,BNIP3基因启动子区自转录起始点上游966 bp至下游86 bp之间CpG位点分布密集,存在长度为1 052 bp的CpG岛。本研究中利用BSP克隆测序法对BNIP3基因启动子区中(+21 bp~-267 bp)长288 bp、包含14个CpG位点的DNA片段进行甲基化水平的检测,甲基化率为80%~100%。因此,首次明确了胃癌MKN1细胞中BNIP3基因启动子区的甲基化位点,并检测到这些CpG位点呈现高度的甲基化。
我们进一步用去甲基化药物处理MKN1细胞,以明确启动子甲基化与BNIP3基因表达的关系。5-Aza-CdR是一种高效的DNMT抑制剂,它可与DNMT不可逆性结合,具有较强去甲基化作用,使表观遗传学沉默的基因去甲基化,逆转其恶性表型[9,11]。本研究发现,对照组MKN1细胞中BNIP3表达缺失,10 μmol/L的5-Aza-CdR可诱导BNIP3mRNA表达明显增加,BNIP3基因的启动子区CpG位点甲基化概率较对照组明显下降,提示胃癌MKN1细胞中BNIP3基因表达缺失与启动子区高甲基化关系密切,该区域的CpG位点甲基化在调控基因转录中发挥重要作用。
DNA甲基化是由DNMT催化完成的。DNMT1催化甲基基团与胞嘧啶环的结合,维持DNA复制过程中的甲基化模式,在表观遗传修饰中发挥重要作用,其活性及表达水平与肿瘤发生密切相关。近年研究报道,DNMT1通过与靶基因启动子DNA序列结合,介导DNA甲基化,调节基因表达[12,13]。我们推测DNMT1是否参与介导BNIP3发生DNA甲基化的机制。我们利用ChIP技术检测DNMT1与BNIP3启动子区DNA的结合状态。结果显示,MKN1细胞中DNMT1能与BNIP3启动子区DNA结合。5-Aza-CdR能够明显抑制DNMT1与BNIP3启动子的结合。提示5-Aza-CdR降低DNMT1与BNIP3启动子区结合能力,部分逆转BNIP3的甲基化状态,是导致MKN1细胞中BNIP3表达上调的重要原因。
综上所述,本研究首次明确了胃癌MKN1细胞中BNIP3基因启动子区甲基化的具体位点,证实了MKN1细胞中BNIP3基因启动子区CpG位点存在高甲基化,BNIP3基因表达受启动子区DNA甲基化调控,甲基化的发生与DNMT1和BNIP3基因启动子结合有关。揭示了BNIP3基因启动子区DNA甲基化的机制,有助于从表观遗传学角度揭示胃癌的发病机制,为胃癌的基因治疗提供理论基础。
[1]Yan PS,Chen CM,Shi H,et al.Applications of CpG island microarrays for high-throughput analysis of DNA methylation[J].J Nutr,2002,132(8):2430S-2434S.
[2]Fukushige S,Horii A.DNA methylation in cancer:a gene silencing mechanism and the clinical potential of its biomarkers[J].Tohuku J Exp Med,2013,229(3):173-185.
[3]Murai M,Toyota M,Suzuki H,et al.Aberrant methylation and silencing of the BNIP3 gene in colorectal and gastric cancer[J].Clin Cancer Res,2005,11(3):1021-1027.
[4]Abe T,Toyota M,Suzuki H,et al.Upregulation of BNIP3 by 5-aza-2′-deoxycytidine sensitizes pancreatic cancer cells to hypoxia-mediated cell death[J].J Gastroenterol,2005,40(5):504-510.
[5]Sugita H,Iida S,Inokuchi M,et al.Methylation of BNIP3 and DAPK indicates lower response to chemotherapy and poor prognosis in gastric cancer[J].Oncol Rep,2011,25(2):513-518.
[6]Swiderek E,Kalas W,Wysokinska E,et al.The interplay between epigenetic silencing,oncogenic KRas and HIF-1 regulatory pathways in control of BNIP3 expression in human colorectal cancer cells[J].Biochem Biophys Res Commun,2013,441(4):707-712.
[7]Hayatsu H.The bisulfite genomic sequencing used in the analysis of epigenetic states,a technique in the emerging environmental genotoxicology research[J].Mutat Res,2008,659(2):77-82.
[8]Gardiner-Garden M,Frommer M.CpG islands in vertebrate genomes[J].Mol Biol,1987,196(2):261-282.
[9]张洪典,陈传贵,胡珊珊,等.5-Aza-CdR对人食管鳞癌Kyse-140细胞BNIP3基因甲基化生物学意义的研究[J].中华肿瘤防治杂志,2013,20(15):1132-1136.
[10]王银玲,王亿龙,王齐晖,等.腹腔冲洗液BNIP3基因甲基化与胃癌患者腹膜微转移及疾病的相关性研究[J].中国医科大学学报,2012,41(10):934-936.
[11]Lindner DJ,Wu Y,Haney R,et al.Thrombospondin-1 expression in melanoma is blocked by methylation and targeted reversal by 5-Aza-deoxycytidine suppresses angiogenesis[J].Matrix Biol,2013,32(2):123-132.
[12]Di Ruscio A,Ebralidze AK,Benoukraf T,et al.DNMT1-interacting RNAs block gene-specific DNA methylation[J].Nature,2013,503(7476):371-376.
[13]Venza I,Visalli M,Fortunato C,et al.PGE2 induces interleukin-8 derepression in human astrocytoma through coordinated DNA demethylation and histone hyperacetylation[J].Epigenetics,2012,7(11):1315-1330.
(编辑陈姜)
CpGIsland Methylation Regulates BNIP3Gene Expression in Gastric Cancer Cells
SHENWei1,LIUKun2,SUILu1,ZOUDan1,HUJin-yao3
(1.DepartmentofPathophysiology,Shenyang MedicalCollege,Shenyang 110034,China;2.DepartmentofPhysiology,Shenyang MedicalCollege,Shenyang 110034,China;3.Grade 2012 MedicalImaging,Shenyang MedicalCollege,Shenyang 110034,China)
Objective To detectthe methylation statusofthe promoterof BNIP3gene in gastric cancercelllines MKN1,and to explore the mechanism of DNA methylation regulating the expression of BNIP3in gastric cancer cells.MethodsThe methylation status of BNIP3promoter was detected by bisulfate sequencing PCR.Reverse transcription PCR was used to evaluate BNIP3mRNAexpression.MKN1 cells were treated with 5-Aza-2′-deoxycytidine(5-Aza-CdR),and after the treatment,the methylation status and BNIP3mRNA expression were observed.Chromatin immunoprecipitation(ChIP)was used to determine the combination of BNIP3 with DNA methyltransferase 1(DNMT1).ResultsThe promoter DNA of BNIP3in MKN1 cells was in state of hypermethylation.Compared to the control group,methylation status and mRNA expression of BNIP3in the drug treatment group(the 5-Aza-CdR concentration was 10 μmol/L)were reversed,which showed statistical differences(P<0.05).5-Aza-CdR inhibited the combination of BNIP3 with DNMT1.ConclusionCpG island methylation regulates BNIP3 gene expression in MKN1 cells.DNA methylation is related with the binding between the promoterof BNIP3and DNMT1.
BNIP3gene;DNA methylation;stomach neoplasms;5-Aza-2′-deoxycytidine
R735.2
A
0258-4646(2015)03-0221-05
辽宁省教育厅杰出青年学者成长计划(LJQ2012091);沈
阳医学院优秀人才启动基金(20123041)
沈薇(1976-),女,副教授,博士.
E-mail:shenwei1119@163.com
2014-12-15
网络出版时间:
