SUMO蛋白在体外培养的人晶状体上皮细胞内的表达及对氧化应激的调控作用
2015-01-02韩笑王欣玲吴迪张劲松阎启昌
韩笑,王欣玲,吴迪,张劲松,阎启昌
(1.中国医科大学附属第四医院眼科,沈阳 110005;2.辽宁省晶状体学实验室,沈阳 110005)
SUMO蛋白在体外培养的人晶状体上皮细胞内的表达及对氧化应激的调控作用
韩笑1,2,王欣玲1,2,吴迪1,2,张劲松1,2,阎启昌1,2
(1.中国医科大学附属第四医院眼科,沈阳 110005;2.辽宁省晶状体学实验室,沈阳 110005)
目的观察小泛素相关修饰物(SUMO)在体外正常培养的人晶状体上皮细胞系(SRA01/04)内的表达以及由高糖诱导的氧化应激条件下SUMO的变化,探讨其对氧化应激的调控作用。方法通过免疫细胞化学染色法,检测SUMO1,2/3,4蛋白在正常培养的SRA01/04内的表达及分布;通过RT-PCR法,观察不同浓度和时间高糖处理时SUMO1~4 mRNA的表达变化。按浓度实验分组:葡萄糖浓度分别为5.5、12.5、25、50 mmol/L作用24 h。按时间实验分组:葡萄糖浓度50 mmol/L作用0、6、12、24 h。将GFP-SUMO2质粒转入细胞后通过CCK8检测法和AV/PI双染流式细胞仪检测高糖(50 mmol/L)处理后,转染与非转染组的细胞存活率和细胞凋亡率。结果免疫细胞化学染色结果,SUMO 1~4蛋白在SRA01/04细胞内主要分布于细胞核,SUMO 2/3同时少量分布于胞质;RT-PCR结果可见,与低糖组比较,高糖组随着糖浓度增加SUMO1~SUMO4 mRNA表达增加(P<0.05);与50 mmol/L高糖处理0 h比较,随着处理时间增加SUMO1~SUMO4 mRNA表达增加(P<0.05)。与非转染组比较,转染GFPSUMO2的SRA01/04经高糖处理后存活率增加,凋亡率降低(P<0.05)。结论SUMO蛋白在SRA01/04内阳性表达,一定程度高糖诱导的氧化应激影响SUMO mRNA表达。
小泛素相关修饰物;人晶状体上皮细胞;白内障;高糖;氧化应激
白内障是一种常见且严重致盲疾病之一,一般认为氧化损伤是其重要致病途径,晶状体上皮细胞过度凋亡是其重要病理机制[1]。高浓度血糖易导致1型糖尿病患者并发糖尿病性白内障,并加速2型糖尿病患者年龄相关性白内障的形成[2,3],大量实验已证高糖诱导氧化损伤引起晶状体上皮细胞过度凋亡[4,5]。一定程度范围内的氧化应激损伤细胞的同时,会启动各种机制引起基因表达和蛋白翻译后修饰等细胞程序进行细胞保护[6]。小泛素相关修饰物(small ubiquitin-related modifiers,SUMO)介导的SUMO化作为蛋白翻译后修饰也参与氧化过程,保护底物蛋白稳定性并进行细胞保护[7~9]。哺乳动物的SUMO家族蛋白具有4个分型,以3种形式存在:SUMO1、SUMO2/3和SUMO4[10,11]。研究表明在体外培养的不同组织或细胞中SUMO蛋白受到氧化应激因素刺激时表达量会随之改变,如低氧[12]、热休克[13]、高糖[14]以及H2O2[15]等。为探索SUMO蛋白在人晶状体上皮细胞内的表达情况以及对氧化应激的调控作用,本实验以体外培养的人晶状体上皮细胞系(SRA01/04)为基础,研究SUMO蛋白在高糖诱导的氧化损伤过程中对细胞的生物学影响和可能机制,为进一步深入探讨SUMO化修饰在白内障疾病发病机制中的作用奠定重要基础。
1 材料与方法
1.1 细胞系和质粒
人晶状体上皮细胞系SRA01/04为中国医科大学附属第四医院,眼科晶状体学实验室提供。质粒GFP-SUMO2为德克萨斯A&M大学系统健康科学中心微生物与免疫学Van G.Wilson教授赠予。
1.2 主要试剂
兔抗SUMO1,4单克隆抗体和兔抗SUMO2/3多克隆抗体购自Abcam公司。即用型免疫组织化学SP试剂盒购自福州迈新生物科技有限公司。逆转录试剂盒(M-MLV First stand Kit)、PCR试剂盒(Taq DNA Polymerase Recombinant)、转染试剂(Lipofectamine 2000)和GFP空荧光质粒购自Invitrogen公司。CCK8试剂和Annexin V-FITC/PI双染试剂盒购自碧云天生物科技有限公司。
1.3 细胞培养
冻存SRA01/04细胞复苏后传代培养,第3代随机分组于培养皿中培养。用含有10%胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的低糖DMEM培养基(葡萄糖5.5 mmol/L),在5%CO2饱和湿度的细胞培养箱内37℃下培养。
1.4 免疫细胞化学
细胞悬液置于24孔板内的爬片上过夜贴片培养。次日细胞融合约70%~80%后去除培养基,4%多聚甲醛室温固定20 mim。依据即用型免疫组织化学SP试剂盒说明操作。兔抗SUMO 1、2/3、4抗体按说明稀释,4℃孵育过夜。苏木素核染,梯度乙醇脱水,二甲苯透明,中性树胶封闭于载玻片上,正像显微镜观察和照相。
1.5 逆转录PCR和实验分组
细胞悬液随机等量分组于培养皿中过夜贴壁。次日细胞融合约80%,用不同浓度(5.5,12.5,25,50 mmol/L)高糖处理24 h,以及用50 mmol/L高糖处理不同时间:0,6,12,24 h。按说明用Trizol试剂分别提取RNA,紫外分光光度计检测RNA纯度及浓度,逆转录合成cDNA,经DNA大量扩增,琼脂糖凝胶电泳,凝胶成像系统检测产物条带,图像分析系统计算目的基因条带的灰度值,以β-actin为内参获得相对比值。重复3次以上独立实验。目的基因引物序列见表1。
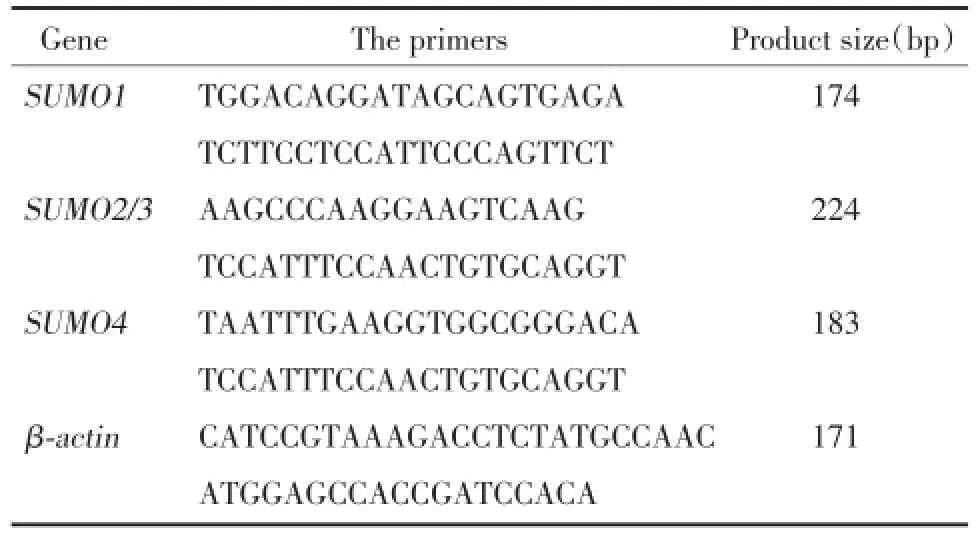
表1 各基因引物序列Tab.1 The sequences of primers
1.6 细胞转染和实验分组
细胞悬液随机等量以1×106/mL接种于6孔板中,用仅有血清无双抗低糖DMEM培养基过夜贴壁。换无血清无双抗培养基,依据Lipofectamine 2000转染试剂的操作步骤,将GFP-SUMO2质粒和GFP空质粒转入SRA01/04细胞内6 h后,换含有血清的培养基继续培养40 h。选取高效转染的细胞和未转染细胞,实验分组为未转染质粒组(对照组)、GFP空质粒组(empty-GFP组)、GFP-SUMO2组,分别用于CCK8检测和Annexin V-FITC/PI检测。
1.7 CCK8检测SRA01/04细胞存活
上述各组细胞随机等量以1×104/mL接种于96孔板用100 μL培养基贴壁培养,每组8复孔,用50 mmol/L高糖培养基处理各组细胞24 h。另设细胞空白对照组(仅有培养基无细胞无处理8复孔)。每孔换正常培养基加入CCK8试剂10 μL继续培养2 h。全自动酶标分析仪检测波长为450 nm的每孔光密度(optical density,OD)值。未转染质粒组为对照组,GFP空质粒组和GFP-SUMO2组为实验组。各组细胞存活率=(实验组OD值-细胞空白对照组OD值)/(对照组OD值-细胞空白对照组OD值)× 100%。重复3次以上独立实验。
1.8 Annexin V-FITC/PI检测SRA01/04细胞凋亡
各组细胞随机等量1×106/mL接种于6孔板贴壁培养,每组3复孔,用50 mmol/L高糖培养基处理各组细胞24 h,按Annexin V-FITC/PI双染试剂盒说明操作处理,另设Annexin V-FITC(-)PI(-),Annexin V FITC(+)PI(-)和Annexin V-FITC(-)PI(+)3组作为染料对照组,利用流式细胞仪检测各组细胞凋亡率。未转染质粒组为对照组,GFP空质粒组和GFPSUMO2组为实验组。各组细胞凋亡率相对比值=实验组凋亡率/对照组凋亡率×100%。重复3次以上独立实验。
1.9 统计学
实验数据以x±s表示,使用SPSS 19.0统计软件进行统计学处理,用单因素方差分析进行组间比较,P<0.05为差异具有统计学意义。
2 结果
2.1 SUMO蛋白在正常体外培养的人晶状体上皮细胞内表达
使用细胞免疫化学方法观察SUMO蛋白在体外正常培养的人晶状体上皮细胞内的表达情况。SUMO1蛋白主要表达于晶状体上皮细胞核内;SUMO 2/3蛋白主要表达于晶状体上皮细胞核内,部分表达于胞质内;SUMO4蛋白主要表达于晶状体上皮细胞核及核周胞质内,见图1。

图1 SUMO蛋白在人晶状体上皮细胞内的表达Fig.1 SUMO protein expression in human lens epithelial c ells
2.2 高糖处理SRA01/04细胞影响SUMO表达
随着一定范围内葡萄糖浓度的增加,SUMO1、SUMO2/3、SUMO4 mRNA表达增加,与5.5 mmol/L低糖组比较,12.5,25和50 mmol/L高糖组SUMO1~ 4 mRNA表达水平均增加(P<0.05)。用葡萄糖浓度为50 mmol/L培养基分别处理0,6,12,24 h,结果可见,随着高糖处理时间的增加,SUMO1、SUMO2/3、SUMO4mRNA表达增加(P<0.05)。见图2、图3。

图2 不同浓度高糖处理影响SUMO表达Fig.2 SUMO mRNA expression induced by different concentrations of high glucose

图3 不同时间高糖(50 mmol/L)处理SUMOmRNA表达比较Fig.3 SUMO mRNA expression induced by high glucose treatment(50 mmol/L)at different time points
2.3 转染SUMO2后改变高糖对SRA01/04细胞存活的影响
选取高效转染的SRA01/04细胞(图4)与未转染质粒SRA01/04分别以1×104/mL铺96孔板,并用50 mmol/L高糖处理细胞24 h后,观察SRA01/04细胞存活情况。结果可见,转染GFP-SUMO2的SRA01/ 04细胞抵抗高糖氧化损伤的能力增强,与未转染质粒组比较细胞存活增加(P<0.05),而转染GFP空质粒组的SRA01/04细胞抵抗高糖氧化损伤的能力未见明显改变,与未转染质粒组比较细胞存活未见统计学差异(P>0.05),见图5。

图4 GFP-SUMO2质粒转入SRA01/04细胞Fig.4 Transfection of GFP-SUMO2 into SRA01/04 cells
2.4 转染SUMO2后改变高糖对SRA01/04细胞凋亡的影响
选取高效转染的SRA01/04细胞(图4)与未转染质粒SRA01/04分别以1×106/mL铺6孔板,并用50 mmol/L高糖处理细胞24 h后,观察SRA01/04细胞凋亡情况。结果可见,转染GFP-SUMO2的SRA01/ 04细胞抵抗高糖氧化损伤的能力增强,与未转染质粒组比较细胞凋亡减少(P<0.05),而转染GFP空质粒组的SRA01/04细胞抵抗高糖氧化损伤的能力未见明显改变,与未转染质粒组比较细胞凋亡未见统计学差异(P>0.05),见图6。

图5 各组细胞存活率Fig.5 Survival rate of cells in different groups
3 讨论
SUMO蛋白介导SUMO化作为一种蛋白翻译后修饰正成为近年各疾病发病机制的研究热点,大量研究报道SUMO化修饰保护底物蛋白稳定并影响其生物学功能,参与调控氧化损伤等生理和病理过程[16,17]。SUMO蛋白参与蛋白翻译后修饰具有重要的作用,包括转录因子调控、DNA修复、影响蛋白分布和细胞外应激应答等[11,18~21]。

图6 各组细胞凋亡率Fig.6 Apoptotic rate of cells in different groups
本研究首先通过免疫细胞化学染色方法明确SUMO家族蛋白在体外正常培养的人晶状体上皮细胞表达及定位情况,SUMO1和SUMO4主要表达于细胞核,SUMO2/3则在细胞核及部分胞质均有表达。利用高糖构建氧化损伤所致的白内障模型,观察到在一定范围内增加高糖处理浓度或延长高糖处理时间,SUMO1、SUMO2/3、SUMO4在mRNA水平表达均增加,推测SUMO参与高糖诱导的人晶状体上皮细胞氧化损伤的生物学过程。Huang等[14]研究表明SUMO1~3在体外培养的大鼠肾小球系膜细胞受到高糖处理的影响在mRNA及蛋白水平上均呈现表达增加。Shao等[22]报道低氧处理小鼠后,心脏和脑组织内SUMO1蛋白表达增加。为进一步探讨氧化应激条件下SUMO改变发生的细胞生物学效应,将GFP-SUMO2质粒转入人晶状体上皮细胞内,结果发现过表达SUMO2后,转染细胞经高糖处理后表现出抑制高糖对细胞的氧化损伤,增加细胞的存活率并降低了细胞凋亡率。推测SUMO过表达,促进了其稳定多种底物蛋白,影响和调控转录因子等功能作用,进而产生对人晶状体上皮细胞的保护。Park等[23]研究发现过表达SUMO2/3调控DBC1的SUMO化,进而影响P53介导的DNA损伤和细胞凋亡。近年大量研究表明SUMO蛋白参与SUMO化及去SUMO化的修饰酶对于肿瘤、神经退行性病变、衰老等疾病的发生发展具有重要的影响和调控[24~28]。深入探索在人晶状体上皮细胞内SUMO蛋白对底物蛋白的修饰,调控转录因子以及SUMO化和去SUMO化修饰酶功能等与白内障发病机制的关系,将成为我们实验组未来的目标。
综上所述,SUMO表达于体外培养的人晶状体上皮细胞内,并受高糖诱导的氧化应激影响,在一定浓度和时间范围内的高糖环境中,SUMO在mRNA水平随高糖浓度或时间增加而表达增多。体外细胞内转染SUMO2质粒后,SUMO2过表达有助于保护受到氧化应激的晶状体上皮细胞,促进细胞存活并减少细胞凋亡,从而部分抑制高糖对人晶状体上皮细胞的损伤。这可能是SUMO蛋白参与众多蛋白的翻译后修饰,影响底物蛋白稳定性,调控底物蛋白发挥其生物学效应,因此SUMO蛋白及SUMO化修饰可能成为探索白内障发病机制及防治的新方向。
[1]Katta AV,Katkam RV,Geetha H.Lipid peroxidation and the total antioxidant status in the pathogenesis of age related and diabetic cataracts:a study on the lens and blood[J].J Clin Diagn Res,2013,7(6):978-981.
[2]Iafusco D,Prisco F,Romano MR,et al.Acute juvenile cataract in newly diagnosed type 1 diabetic patients:a description of six cases[J].Pediatr Diabetes,2011,12(7):642-648.
[3]Grauslund J.Eye complications and markers of morbidity and mortality in long-term type 1 diabetes[J].Acta Ophthalmol,2011,89(Thesis 1):1-19.
[4]Qi B,Ji Q,Wen Y,et al.Lycium barbarum polysaccharides protect human lens epithelial cells against oxidative stress-induced apoptosis and senescence[J].PloS One,2014,9(10):e110275.
[5]Wu ZM,Yin XX,Ji L,et al.Ginkgo biloba extract prevents against apoptosis induced by high glucose in human lens epithelial cells[J].Acta Pharmacol Sin,2008,29(9):1042-1050.
[6]Halliwell B.Oxidative stress and cancer:have we moved forward?[J].Biochem J,2007,401(1):1-11.
[7]Yang W,Sheng H,Warner DS,et al.Transient global cerebral ischemia induces a massive increase in protein sumoylation[J].J Cereb Blood Flow Metab,2008,28(2):269-279.
[8]Cimarosti H,Lindberg C,Bomholt SF,et al.Increased protein SUMOylation following focal cerebral ischemia[J].Neuropharmacology,2008,54(2):280-289.
[9]Sahin U,Ferhi O,Jeanne M,et al.Oxidative stress-induced assembly of PML nuclear bodies controls sumoylation of partner proteins[J].J Cell Biol,2014,204(6):931-945.
[10]Guo D,Li M,Zhang Y,et al.A functional variant of SUMO4,a new I kappa B alpha modifier,is associated with type 1 diabetes[J]. Nat Genet,2004,36(8):837-841.
[11]Dohmen RJ.SUMO protein modification[J].Biochem Biophys Acta,2004,1695(1-3):113-131.
[12]Li J,Xu Y,Long XD,et al.Cbx4 governs HIF-1 alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity[J].Cancer Cell,2014,25(1):118-131.
[13]Castorálová M,Bezinová D,Svéda M,et al.SUMO-2/3 conjugates accumulating under heat shock or MG132 treatment result largely from new protein synthesis[J].Biochem Biophys Acta,2012,1823(4):911-919.
[14]Huang W,Xu L,Zhou X,et al.High glucose induces activation of NF-kappaB inflammatory signaling through Ikappa Balpha sumoylation in rat mesangial cells[J].Biochem Biophys Res Commun,2013,438(3):568-574.
[15]Huang C,Han Y,Wang Y,et al.SENP3 is responsible for HIF-1 transactivation under mild oxidative stress via p300 de-SUMOylation[J].EMBO J,2009,28(18):2748-2762.
[16]Feligioni M,Nisticò R.SUMO:a(oxidative)stressed protein[J]. Neuromolecular Med,2013,15(4):707-719.
[17]Chung HS,Wang SB,Venkatraman V,et al.Cysteine oxidative posttranslational modifications:emerging regulation in the cardiovascular system[J].Circ Res,2013,112(2):382-392.
[18]Johnson ES.Protein modification by SUMO[J].Annu Rev Biochem,2004,73:355-382.
[19]Chen XL,Reindle A,Johnson ES.Misregulation of 2 microm circle copy number in a SUMO pathway mutant[J].Mol Cell Biol,2005,25(10):4311-4320.
[20]Sriramachandran AM,Dohmen RJ.SUMO-targeted ubiquitin ligases[J].Biochem Biophys Acta,2014,1843(1):75-85.
[21]Dou H,Huang C,Van Nguyen T,et al.SUMOylation and de-SUMOylation in response to DNA damage[J].FEBS Lett,2011,585(18):2891-2896.
[22]Shao R,Zhang FP,Tian F,et al.Increase of SUMO-1 expression in response to hypoxia:direct interaction with HIF-1alpha in adult mouse brain and heart in vivo[J].FEBS Lett,2004 569(1-3):293-300.
[23]Park JH,Lee SW,Yang SW,et al.Modification of DBC1 by SUMO2/3 is crucial for p53-mediated apoptosis in response to DNA damage[J].Nat Commun,2014,18(5):583.
[24]Lee L,Dale E,Staniszewski A,et al.Regulation of synaptic plasticity and cognition by SUMO in normal physiology and Alzheimer's disease[J].Sci Rep,2014,2(4):7190.
[25]Henley JM,Craig TJ,Wilkinson KA.Neuronal SUMOylation:mechanisms,physiology,and roles in neuronal dysfunction[J]. Physiol Rev,2014,94(4):1249-1285.
[26]Fu J,Yu HM,Chiu SY,et al.Disruption of SUMO-specific protease 2 induces mitochondria mediated neurodegeneration[J].PLoS Genet,2014,10(10):e1004579.
[27]Yates KE,Korbel GA,Shtutman M,et al.Repression of the sumospecific protease senp1 induces p53-dependent premature senescence in normal human fibroblasts[J].Aging Cell,2008,7(5):609-621.
[28]Oliveira Alves MG,da Mota Delgado A,Balducci I,et al.Study of MDM2 and SUMO-1 expression in actinic cheilitis and lip cancer[J].Arch Dermatol Res,2014,306(9):837-841.
(编辑武玉欣)
SUMOExpression and Regulation in Oxidative Stressin Cultured Human Lens EpithelialCells
HANXiao1,2,WANGXin-ling1,2,WUDi1,2,ZHANGJin-song1,2,YANQi-chang1,2
(1.DepartmentofOphthalmology,The Forth Affiliated Hospital,China MedicalUniversity,Shenyang 110005,China;2.Laboratory ofLens Research ofLiaoning Province,Shenyang 110005,China)
ObjectiveTo observe the expression of small ubiquitin-related modifiers(SUMO)protein in normal cultured human lens epithelial cells(SRA01/04)and discuss regulation effects of SUMO protein on oxidative stress induced by high glucose.MethodsThe expression and localization of SUMO 1,2/3,4 was detected in normal cultured SRA01/04 cells through immunocytochemistry.The mRNA expression levels of SUMO 1 -4 were examined by RT-PCR after the SRA01/04 cells treated with high glucose media at different concentrations and time points.Samples were grouped by medium concentrations(glucoses 5.5 mmol/L,12.5 mmol/L,25 mmol/L,50 mmol/L respectively for 24 h)and by treatment time(0 h,6 h,12 h and 24 h respectively).Afterhighly efficienttransfection ofGFP-SUMO2 into SRA01/04 cells,the survivaland apoptotic rates oftransfected and un-transfected cellstreated with high glucose was detected by CCK8 method and AV/PIdouble staining flow cytometry.ResultsThe immunocytochemistry results showed that SUMO1,2/3,4 proteins were mainly located in the nucleus of SRA01/04 cells and part of SUMO2/3 was in the cytoplasm.RT-PCR results showed thatcompared with the low-glucose group,the mRNAexpression of SUMO1-4 was increased along the increasing glucose concentration in the high-glucose group(P<0.05).Compared with 0 h,the mRNA expression of SUMO1-4 wasenhanced at6 h,12 h and 24 h(P<0.05)in the high-glucose group treated at 50 mmol/L concentration.Compared with the un-transfected cells,the survival rate was increased and the apoptotic rate was decreased in GFP-SUMO2 transfected cells in oxidative stress induced by high glucose(P<0.05).ConclusionSUMO protein was positively expressed in SRA01/04 cells and the expression of SUMO mRNA was affected by oxidative stress induced by high glucose.
small ubiquitin-related modifiers;human lens epithelial cells;cataract;high glucose;oxidative stress
R776.1
A
0258-4646(2015)03-0193-06
国家自然科学基金(81170836);辽宁省自然科学基金(201202260;2013021016)
韩笑(1986-),女,博士研究生.
阎启昌,E-mail:cmu4h_yqc@163.com
2014-11-02
网络出版时间:
