盐和过氧化氢胁迫下交替氧化酶调节根生长和细胞死亡
2015-01-01刘金亮王庆文冯汉青贾凌云
刘金亮,王庆文,冯汉青,梁 烨,贾凌云
(西北师范大学生命科学学院,甘肃兰州 730070)
与动物线粒体相比,植物线粒体存在两条电子传递途径:细胞色素途径(CP)和交替途径(AP),其中交替途径也称抗氰呼吸途径,该途径是一条以交替氧化酶(alternative oxidase,AOX)为末端氧化酶,把电子从泛醌库传递给O2而生成水的非磷酸化电子传递途径[1]。已有研究表明,交替呼吸路径在植物抵抗病原菌侵染、低温、干旱及氧化压力等多种胁迫因素中扮演着重要的角色[2-3]。然而,目前在上述胁迫下对交替氧化酶生理学功能的研究主要集中在光合组织中,而事实上,胁迫对植物的根部也有影响。由于植物的根不仅对植物起支持和固着的作用,更是植物吸收水分和矿物营养的主要器官[4]。因此植物整体对胁迫的耐受程度在很大程度上是由植物的根部在胁迫下的生理状态决定着。而目前植物根部对于胁迫耐受性是否与交替氧化酶有关则报道较少,这在一定程度上制约了人们在胁迫条件下对交替氧化酶的生理学功能更加全面的认知。基于此,本文我们利用野生型和交替氧化酶基因(AOX1a)缺失的拟南芥(Arabidopsis thaliana)为材料,研究并比较了盐胁迫(NaCl)和氧化压力(H2O2)对这两种拟南芥植物根生长的影响。
1 材料与方法
1.1 拟南芥的种植
本实验所用材料为野生型(WT)拟南芥(Arabidopsis thaliana)和编码交替氧化酶AOX1a反义抑制拟南芥突变体(AS-12)[5]。实验材料由Arabidopsis Biological Resource Center at Ohio State U-niversity(Columbus,OH,USA)提供,经实验室培养并鉴定。将野生型和突变型拟南芥种子利用1%的NaClO溶液浸泡10min进行消毒处理,离心后弃掉NaClO,用无菌蒸馏水洗涤种子5-6遍,时间间隔为1min。将处理后的种子分别点到已灭菌的MS固体培养基(含0.8%琼脂和2.4%蔗糖)的表面,用封口膜密封后在4℃下春化4d,然后转移到光周期为16h光照/8h黑暗、温度为20℃的生长条件下,竖直放置培养皿,使植株幼根能够垂直向下生长,在此条件下培养生长7d。
1.2 拟南芥的胁迫处理
盐胁迫处理:将生长7d后的植株转出原来的培养基,转移到含有不同 NaCl浓度(0,50,100,150 mM)的MS固体培养基表面,在上述生长条件下继续垂直生长8d;过氧化氢处理:将生长7d后的植株从原来的培养基取出,将根部分别置于不同浓度的 H2O2溶液中(0,50,100,200 mM),于黑暗中放置8 h,温度为20℃。
1.3 根生长速率的测量和计算
每个处理条件下随机选取若干株幼苗(不少于8株),在处理前测量植株幼苗根长度,在处理后再次测量根长度(精确到0.1mm)。植株主根生长速率R=(处理后根长度-处理前根长度)/处理时间。使用Origin 6.1软件对不同条件处理下根的相对生长速率进行t检测,以P<0.05为有统计学上的显著性差异。
1.4 根尖细胞死亡程度观察和测量
根据组织细胞的死亡程度采用伊文思蓝染色法[6]测定,利用伊文思蓝染色颜色的深浅来判断细胞死亡程度的大小,当染色颜色越深,表明细胞死亡程度越严重。室温下,将处理后的拟南芥植株的根部浸没在0.25%伊文思蓝水溶液中,染色20 min,之后用蒸馏水漂洗两次(每次10 min)以去除未结合的伊文思蓝染液,放置过夜后,使用Olypus显微采集系统进行观察和拍照。
1.5 交替呼吸途径的测量
称量植物组织后,用刀片将其切成小段,放置到缓冲液(20 mM Hepes,0.2 mM CaCl2,pH 7.2)中浸泡10 min。之后将其转移到密闭的测量杯中,利用Clark氧电极(SP-2型,中国科学院上海植物生理生态研究所制)检测缓冲液中氧气含量变化,依照Bingham和Farrar[7]的方法检测。
1.6 数据分析
结果以平均值±标准误差来表示,采用Origin 6.0进行显著性差异分析(P<0.05)并作图。
2 实验结果和分析
2.1 两种拟南芥植株交替呼吸途径的鉴定
利用Clark氧电极法[7]测量和比较实验室中培养的AOX基因反义抑制突变体(AS-12)和野生型(WT,Col-0)拟南芥植株的交替途径容量(Valt),实验结果表明,AS-12植株交替途径的容量显著低于野生型 (图1)。
2.2 胁迫前两种拟南芥幼根生长和细胞活力比较
WT和AS-12两种拟南芥在MS培养基中生长7d后,WT和AS-12拟南芥的根长之间没有显著性差异(图2A),将以上两种拟南芥的根用伊文思蓝染色后也没有观察到明显的区别(图2B)。表明在正常生长下,交替氧化酶基因的反义抑制不会对拟南芥幼根的生长和细胞活力造成影响。
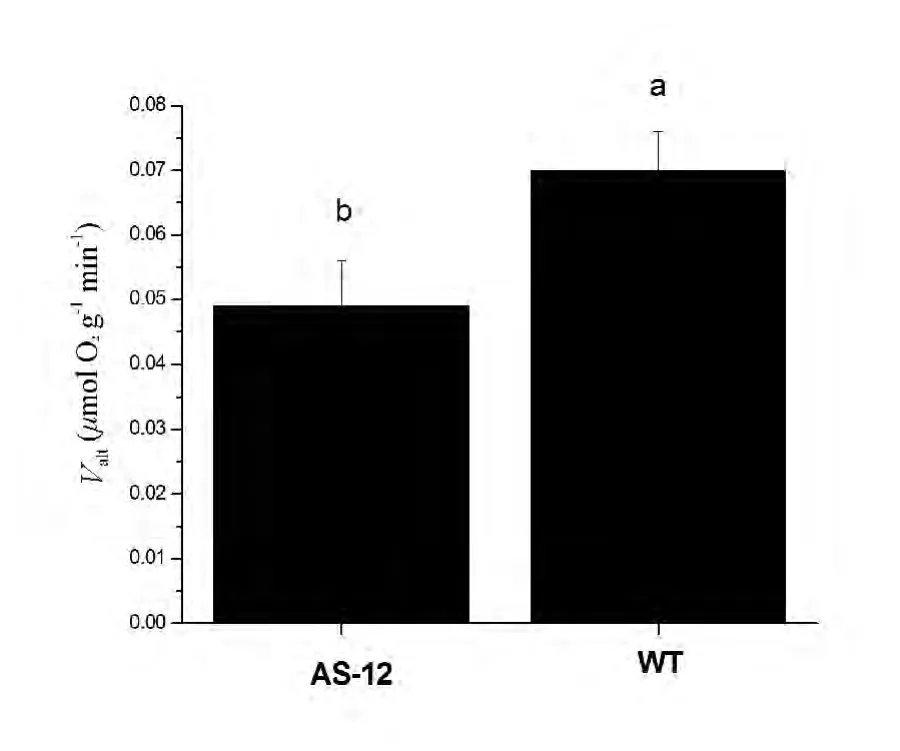
图1 不同基因型拟南芥交替途径容量(Valt)进行测量和比较对比观察Fig.1 The measurement and comparison of the alternative pathway capacity of AS-12 and WT Arabidopsis plants

图2 胁迫处理前WT和AS-12两种拟南芥幼根生长和细胞活力对比观察Fig.2 The length(A)and cell viability(B)of seedling roots of wild-type(WT)and AOX1a anti-sense(AS-12)lines of Arabidopsis before salt stress and H2O2treatment
2.3 盐胁迫对两种拟南芥幼根生长和细胞活力的影响
将WT和AS-12两种拟南芥幼苗分别转移到含有 0,50,100,150 mM NaCl的 MS 培养基中生长8d后进行观察,结果表明,在不含NaCl的MS培养基中,WT与AS-12拟南芥根的生长速率没有显著性差别(图3),也说明了在正常生长下,交替氧化酶基因的反义抑制不会对拟南芥幼根的生长造成影响。随着培养基中NaCl浓度的上升,拟南芥幼根的生长呈现下降趋势。在50 mM NaCl浓度条件下,AS-12拟南芥幼根的生长速率低于WT型拟南芥,但差异并不显著;在100 mM NaCl浓度条件下,AS-12拟南芥幼根的生长速率已显著低于WT型拟南芥。在150 mM NaCl浓度下,AS-12与WT拟南芥幼根几乎停止生长,在这个NaCl浓度下,AS-12与WT根的生长速率没有显著性差异(图3)。
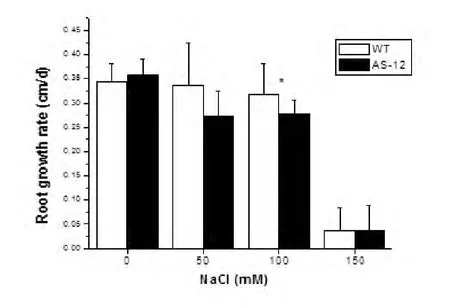
图3 不同NaCl浓度下WT和AS-12拟南芥根生长速率比较Fig.3 The comparison of the rate of root growth between wild-type(WT Col-0)and AOX anti-sense(AS-12)Arabidopsis seedlings under NaCl stresses
在0 mM NaCl浓度条件下,WT和AS-12拟南芥幼根均没有出现明显的细胞死亡现象(图4)。在50 mM NaCl浓度下,在WT根中仍然没有观察到细胞死亡现象。但是,AS-12已经出现轻微的细胞死亡现象(图4);而在100 mM NaCl浓度下,WT与AS-12根中均出现细胞死亡现象,但AS-12拟南芥根染色较之WT拟南芥更深。在含有150 mM NaCl的培养基中,AS-12和WT拟南芥均着色较深,且没有明显的区别(图4)。
2.4 过氧化氢对两种拟南芥幼根生长和细胞活力的影响
将WT和AS-12两种拟南芥的幼根分别置于不同浓度的H2O2溶液中,发现在0 mM H2O2浓度条件下,两种拟南芥根的生长速率没有出现明显差别,随着外源H2O2浓度的增加,两种拟南芥根的生长速率呈现下降趋势。在50 mM H2O2浓度条件下,AS-12拟南芥根的生长速率低于WT,但尚无显著性差异。在100和200 mM H2O2浓度条件下,AS-12与WT的生长速率均进一步降低,但两者之间基本处于同一水平(图5)。
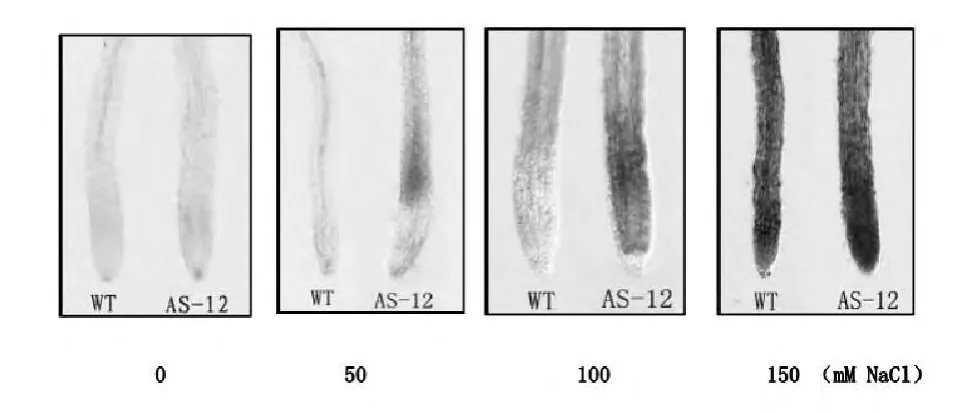
图4 不同NaCl浓度处理下,WT和AS-12根细胞伊文思蓝染色程度对比,从左至右分别表示为0,50,100,150 mM NaCl处理后根染色程度对比Fig.4 Visible observations of root of wild-type(WT)and AOX anti-sense(AS-12)Arabidopsis seedlings when stained by Evans blue under different NaCl treatments.The roots were exposed to 0 mM,50 mM,100 mM,or 150 mM NaCl

图5 不同外源过氧化氢处理下WT和AS-12拟南芥根生长速率比较Fig.5 The comparison of the rate of root growth between wild-type(WT Col-0)and AOX anti-sense(AS-12)Arabidopsis seedlings treated with exogenousH2O2
在50 mM H2O2处理下,WT和AS-12根细胞均出现了明显的细胞死亡,但AS-12细胞死亡程度严重,随着H2O2浓度递增,AS-12与WT细胞死亡程度均逐渐增加,但在100和200 mM H2O2处理下拟南芥细胞死亡程度基本相似(图6)。
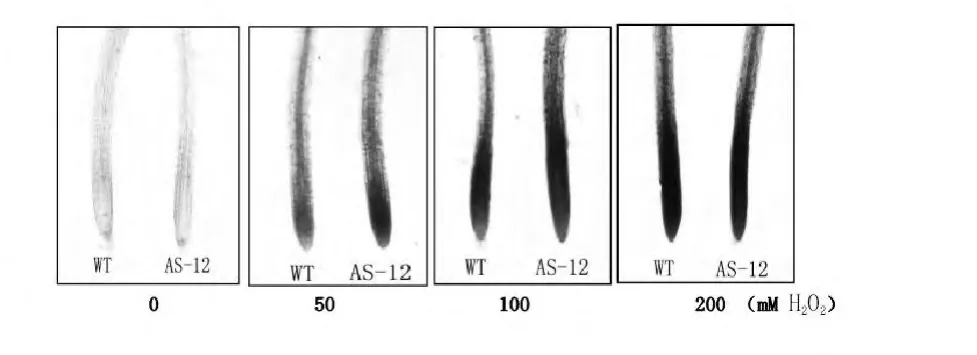
图6 不同H2O2浓度处理下,WT和AS-12根细胞伊文思蓝染色程度对比,从左至右分别表示为0,50,100,200 mM H2O2处理后根染色程度对比Fig.6 Visible observations of root of wild-type(WT Col-0)and AOX anti-sense(AS-12)Arabidopsis seedlings when stained by Evans blue under different H2O2treatments.The roots were exposed to 0 mM,50 mM,100 mM,or 200 mM H2O2
3 讨论
本实验中,WT和AS-12两种拟南芥在没有受到盐胁迫时,其生长速率没有显著差异(图2A)。盐胁迫导致了两种拟南芥根的生长抑制(图3)。在50或100 mM NaCl盐胁迫下,AS-12拟南芥根的生长速率低于WT拟南芥(图3),说明在一定水平的盐胁迫下,交替氧化酶编码基因表达的缺失会造成植株根生长的进一步抑制,表明了交替氧化酶能够在一定程度上抵抗盐胁迫所造成的根的生长抑制。
在未遭盐胁迫情况下,WT和AS-12两种拟南芥根细胞的活力并没有明显差别(图2B),然而,在含有50或100 mM NaCl的培养基上生长的AS-12根细胞死亡程度较之WT更加明显(图4),这说明了交替氧化酶在一定的盐胁迫条件下可以缓解盐胁迫所引起的细胞死亡。该结果与根的生长速率实验结果相吻合;且研究表明,盐胁迫所导致的植物根生长抑制主要和根部细胞死亡有关[8-9]。这提示了在盐胁迫下交替氧化酶基因的缺失所导致的拟南芥根生长速率减缓很可能是细胞活力降低的结果。
目前,很多研究发现在盐胁迫下活性氧含量的增加是造成细胞死亡的主要因素[9]。结果发现,50 mM H2O2处理拟南芥幼根仅8 h就造成了幼根的生长抑制和明显的细胞死亡(图4和5)。在50 mM H2O2处理拟南芥幼根8 h后,AS-12拟南芥根的生长速率低于WT拟南芥,而细胞死亡程度高于WT拟南芥(图5和图6)。说明活性氧也可以诱导根的生长抑制和细胞死亡,而交替氧化酶也可以在一定程度上减缓这种诱导作用。
如前文所述,盐胁迫下细胞中活性氧含量的增加能够引起组织的细胞死亡[10]。外源过氧化氢处理也被报道能够引起细胞死亡,其原因也被认为是引起细胞内过氧化氢含量上升的结果[11]。而细胞内活性氧上升造成细胞死亡的内在原因可能包括了活性氧对蛋白质等生物分子的损伤以及所引发的基因表达的改变等[12]。交替氧化酶目前被确认的功能之一是降低细胞活性氧的生成[13]。因此,在盐胁迫或外源过氧化氢处理下交替氧化酶编码基因的缺失所造成的更为明显的细胞死亡现象应被归结于交替氧化酶降低活性氧能力。而根的生长抑制是根组织细胞死亡的必然结果,所以交替氧化酶编码基因缺失的拟南芥在盐胁迫或外源过氧化氢处理下出现了更为低速的生长。
但应该注意到,在较高水平的盐胁迫或过氧化氢处理下(如150 mM NaCl或200 mM H2O2),野生型和交替氧化酶基因缺失型拟南芥根的细胞死亡程度均达到了较高水平,且生长速率也均受到较大抑制,拟南芥的根的细胞死亡和生长速率均无明显区别,猜测这种高水平的胁迫压力可能已经超出了交替氧化酶维持细胞活力的能力。
综上,在一定的盐胁迫或外源过氧化氢处理下,交替氧化酶能够在一定程度上缓解细胞死亡和根的生长抑制,其作用机理可能与交替氧化酶降低体内的活性氧的能力有关。
[1] VANLERBERGHE G C,MELNTOSH L.Alternative oxidase:from gene to function[J].Annu Rev Plant Physiol Plant Mol Biol,1997,48:703-734.
[2] VAN AKEN O,GIRAUD E,CLIFTON R,et al.Alternative oxidase:a target and regulator of stress responses[J].Physiol Plant,2009,137(4):354-361.
[3] HASEGAWA P M,BRESSAN R A,ZHU J K,et al.Plant cellular and molecular responses to high salinity[J].Annu Rev Plant Physiol Plant Mol Biol,2000,51:463-499.
[4] 张司南,高培尧,谢庆恩,等.镉诱导拟南芥根尖过氧化氢积累导致植物根生长抑制[J].中国生态农业学报,2010,18(1):136-140.
[5] FIORANI F,UMBACH A L.,SIEDOW J N.The alternative oxidase of plant mitochondria is involved in the acclimation of shoot growth at low temperature A study of Arabidopsis AOX1a transgenic plants[J].Plant physiol,2005,139:1795-1805.
[6] HUNG W C,HUANG D D,CHIEN P S,et al.Protein tyrosine dephosphorylation during copper-induced cell death in rice roots[J].Chemosphere,2007,69:55-62.
[7] BINGHAM I J,FARRAR J F.Activity and capacity of respiration pathways in barley roots deprived of inorganic nutrients[J].Plant Physiol Biochem,1989,27(6):847-854.
[8] TAMS L,IMONOVIOV M,HUTTOV J,et al.Changes in the composition of cell wall proteins in barley roots during germination and growth in aluminium presence[J].Plant Soil Environ,2003,49:327-331.
[9] OGAWA A,KITAMICHI K,TOYOFUKU K,et al.Quantitative analysis of cell division and cell death in seminal root of rye under salt stress[J].Plant Prod Sci,2006,91:56-64.
[10] LIN J,WANG Y,WANG G.Salt stress-induced programmed cell death in tobacco protoplasts is mediated by reactive oxygen species and mitochondrial permeability transition pore status[J].Plant Physiol,2006,163:731-739.
[11] HOUOT V,ETIENNE P,PETITOT A S,et al.Hydrogen peroxide induces programmed cell death features in cultured tobacco BY-2 cells,in a dose-dependent manner[J].J Exp Bot,2001,2(361):1721-1730.
[12] RHOADS D M,UMBACH A L,SUBBAIAH C C,et al.Mitochondrial reactive oxygen species.Contribution to oxidative stress and interorganellar signaling[J].Plant Physiol,2006,141:357-366.
[13]MAXWELL D P,WANG Y,MCLNTOSH L.The alternative oxidase lowers mitochondrial reactive oxygen production in plant cell[J].Proc Natl Acad Sci USA,1999,96:8271-8276.
