XPG 基因多态性与胃癌发病风险研究
2014-12-31李湘楚熊建光程正位刘启胜
李湘楚,熊建光,程正位,吴 娟,刘启胜
咸宁市中心医院消化内科,湖北 咸宁437000
胃癌是消化道最常见的恶性肿瘤之一,据统计在2008 年全球共有988 000 例新发胃癌患者,其中70%的胃癌发生在发展中国家,约一半发生在中国[1]。流行病学研究发现幽门螺杆菌(H.pylori)感染是胃癌发生的一个重要危险因素,全球约有50% 的人感染H.pylori,但感染者中只有1%的人发展为胃癌[2]。因此,可认为有遗传和环境因素对胃癌的发生和发展也起重要作用。DNA 损伤修复系统对修复致癌因素所致的DNA 损伤起重要作用,当内源和外源致癌物引起的DNA 损伤不能够得到及时修复,导致细胞发生突变,增加了细胞癌变的可能性。核苷酸切除修复(nucleotide excision repair,NER)是DNA 损伤修复系统的重要途径之一,主要作用是修复大分子DNA 的损伤,临床研究表明NER 途径中较低的DNA 修复能力可能会增加肿瘤的易感性[3-4]。着色性干皮病基因G(xeroderma pigmentosum group G,XPG)是NER 途径的重要基因之一,该基因所编码的蛋白主要功能是识别和切除DNA 损伤部位。临床研究发现XPG 基因多态性与多种肿瘤易感性相关,如大肠癌、食管癌和肺癌[5-7]。目前仅有一个关于XPG 基因多态性和胃癌风险的研究[8]。本研究将评价本地区XPG His1104Asp 和XPG His46His 基因多态性与胃癌风险的相关性。
1 对象与方法
1.1 研究对象 纳入2008 年1 月-2010 年10 月在咸宁市中心医院就诊均由病理检查确诊的新发胃癌患者218 例,其中男136 例,女82 例。平均年龄(55.7 ±8.3)岁。采用性别和年龄匹配方法,在同一时间纳入在咸宁市中心医院进行体检的非肿瘤健康人群作为对照,共218 例。平均年龄(56.3 ±8.5)岁。所纳入的对照者均无肿瘤病史。通过问卷调查收集胃癌组和对照组的人口学特征。
1.2 DNA 提取及分型 所有研究对象采取空腹静脉血5 ml,在2 h 内12 000 r/min 离心2 min,提取血清冷冻于-20 ℃保存备用。采用TIANamp blood DNA kit(天根生化科技有限公司,北京,中国)试剂盒提取DNA。SNP 分型采用聚合酶反应-限制性片段长度多态性分析(PCR-RFLP)方法,进行XPG His1104Asp 和XPG His46His 的基因分型。XPG His1104Asp 和XPG His46His 引物采用Sequenom Assay Design 3.1 software软件设计引物。XPG His1104Asp 正向引物为5'-TTACGTCTTTGCGACAAATTCATT-3',反向引物为5'-CATTAAAGATGAACTTTCAGCAT-3'。XPG His46His正向引物为5'-AGCCTCGCCTTTGCCGAT-3',反向引物为5'-CTTCTGACCCATGCCCACC-3'。PCR 反 应 体 系为25 μl 包括Primer F(10 pmol/L)1.0 μl,Primer R(10 pmol/L)1.0 ml,dNTP 2 μl,Taq DNA polymerase(0.2 U/μl)0.2 μl,10 ×Ex Taq Buffer 5 μl,DNA 模板1.0 μl。反应条件为94 ℃预变性2 min,94 ℃变性30 s、64 ℃退火30 s、72 ℃延伸1 min,一共重复35 个循环。产物在4 ℃情况下保存,经过2%琼脂糖凝胶电泳后,采用溴乙锭染色检测PCR 扩增反应结果。
1.3 H.pylori 检测 病例组和对照组均提取静脉血2 ml,分离血清,-20 ℃低温保存。采用酶联免疫吸附法(ELISA)测定血清H.pylori IgG,实验结果判定均按照试剂盒说明书进行。
1.4 统计学处理 采用SPSS 16.0 统计学软件(SPSS Inc.Chicago.IL. USA)进行统计分析。计量资料采用x±s表示,计数资料采用频数和百分比表示。病例组和对照组临床资料比较采用χ2检验和t 检验。基因型频率采用频数和百分比表示,对照组基因型是否符合Hardy-Weinberg 平衡采用卡方检验。OR 和95% CI 用于评估XPG His1104Asp 和XPG His46His 基因多态性与胃癌风险的相关性。在调整混杂因素后,采用多变量条件Logistic 回归分析模型评价XPG His1104Asp 和XPG His46His 基因多态性对胃癌风险的影响。
2 结果
2.1 人口学特征比较 性别、吸烟、饮酒与胃癌风险无相关性(P >0.05,见表1);胃癌家族史和H. pylori感染的研究对象患胃癌的风险均较对照组显著升高,差异有统计学意义(P <0.05,见表1)。
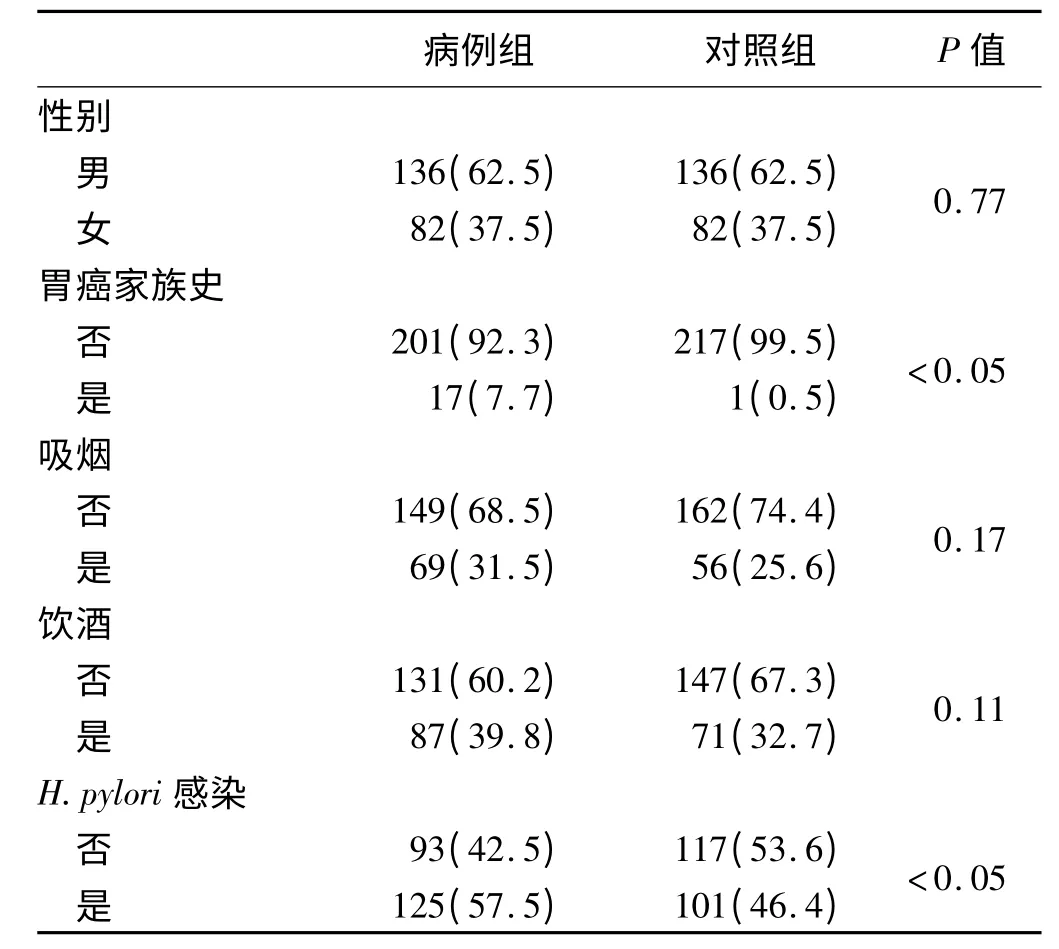
表1 各组人口学特征比较[例数(%)]Tab 1 Comparision of the demographic characteristics in different groups[n(%)]
2.2 XPG His1104Asp 和XPG His46His 基因频率分布及Hardy-Weinberg 平衡情况 XPG His1104Asp 的CC、CG 和GG 基因型在病例组和对照组中的分布差异有统计学意义(P <0. 05)。而XPG His46His 的CC、CT 和TT 基因型在病例组和对照组中的分布差异无统计学意义(P >0.05)。XPG His1104Asp 和XPG His46His 符合Hardy-Weinberg 平衡(HWE),P 值分别为0.13 和0.79(见表2)。
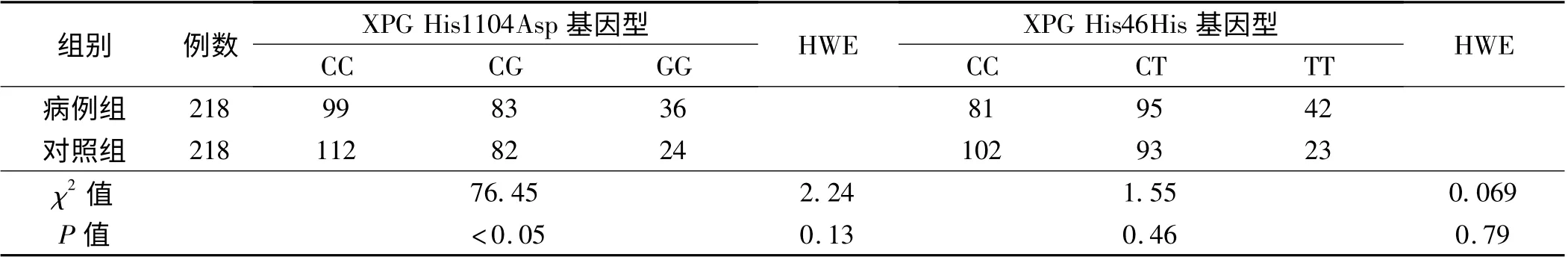
表2 XPG His1104Asp 和XPG His46His 基因频率分布及Hardy-Weinberg 平衡Tab 2 Gene frequency distribution and Hardy-Weinberg balance between XPG His1104Asp and XPG His46His
2.3 XPG His1104Asp 和XPG His46His 基因多态性与胃癌发病相关性 与携带XPG 1104CC 基因型相比,携带XPG 1104GG 基因型的患者患胃癌的风险显著增加,调整年龄、胃癌家族史、吸烟、饮酒和H.pylori 感染因素后的OR(95%CI)为1.82(1.03 ~3.34)。未发现XPG His46His 基因多态性与胃癌有相关性(见表3)。
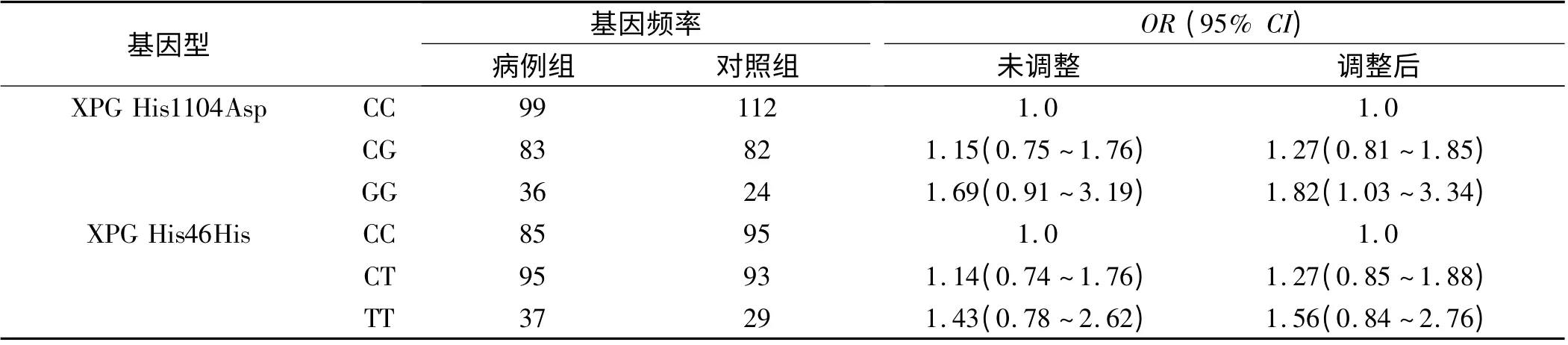
表3 XPG His1104Asp 和XPG His46His 基因多态性与胃癌发病相关性Tab 3 Correlation between gene polymorphism and gastric cancer
2.4 基因多态性与H.pylori 感染和胃癌发病的相关性 XPG His1104Asp 和XPG His46His 基因多态性按H.pylori感染情况进行分层分析。携带XPG 1104CG和GG 基因型的H.pylori 阳性感染者患胃癌的发病风险高于携带CC 基因型的研究对象,OR(95%CI)分别为1.53(1.05 ~2.16)和2.16(1.37 ~3.75)。而在H.pylori 阳性感染者中,XPG His46His 基因多态性与胃癌发病风险无相关性(见表4)。
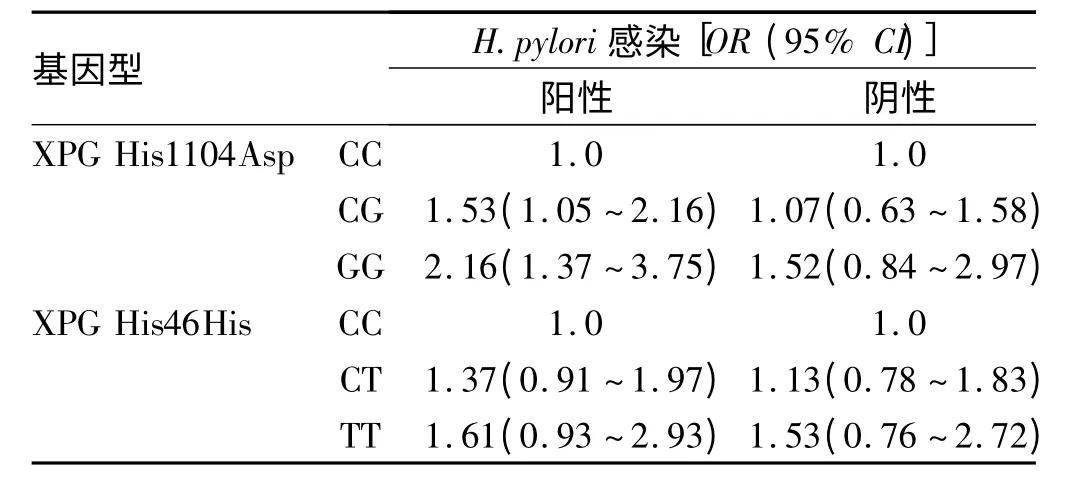
表4 XPG His1104Asp 和XPG His46His 基因多态性与H.pylori 感染和胃癌发病相关性Tab 4 Relationaship of gene polymorphism,H. pylori infection with gastric cancer
3 讨论
XPG 基因位于染色体13q33,编码含1 186 个氨基酸的蛋白质。XPG 蛋白的主要作用是作为核酸内切酶,对于DNA 损伤的片段,从3'端切除DNA 损伤片段,并对维持DNA 结构的稳定性起到了至关重要的作用。XPG 作为DNA 修复基因中的核心基因,其高表达能够使肿瘤细胞具有更高的DNA 修复活性,DNA修复能力强的肿瘤细胞还具有更强的侵袭和增殖能力[9-10]。XPG 基因的第15 外显子第1 104 位密码子的C 到G 多态性可以引起His 氨基酸替代Asp 氨基酸。XPG His1104Asp 位点位于XPG 蛋白的C'端,而该位点与其他DNA 修复基因XPB、XPD、p62 和p44 存在交互作用,XPG His1104Asp 的基因多态性会导致这种交互作用缺陷,最终影响NER 途径的修复功能[11]。
临床研究发现XPG His1104Asp 基因多态性与黑色素瘤、乳腺癌、膀胱癌、肺癌和宫颈癌有相关性,但研究结论不一致[5-7,10,12-14]。韩国的研究发现携带XPG 1104 GG 基因型的研究对象患肺癌的风险显著低于携带CC 基因型[10]。而在非洲裔美国人中的研究表明,携带XPG 1104GG 基因型患肺癌的风险显著高于携带CC 基因型,OR 值为1.78[5]。在瑞士的研究携带XPG 1104CG 和GG 基因型的研究对象患乳腺癌的风险显著高于携带CC 基因型,OR(95%CI)值为1.5(1.04 ~2.16)[6]。目前中国只有一个关于XPG 与胃癌相关性的研究[8],共纳入了400 例胃癌患者和对照者,研究发现XPG rs751402 AA 基因型与GG 基因型相比,能显著性增加患胃癌的风险,OR 值为2. 17,携带XPG rs2296147 CC 基因型与CT +TT 基因型相比,也能显著增加患胃癌的风险,OR 值为2.33。目前尚无研究探讨XPG His1104Asp 和XPG His46His 基因多态性与胃癌风险的相关性。本研究第一次评价本地区XPG His1104Asp 和XPG His46His 基因多态性与胃癌发病风险的相关性,发现携带XPG 1104GG 基因多态性能够增加胃癌发病的风险。
H.pylori 感染是胃癌发病的一个重要因素,本研究显示H.pylori 感染阳性患者中,XPG His1104Asp 基因多态性与胃癌风险相关性更强,提示该基因与H.pylori 感染有一定的交互作用。原因可能是由于H.pylori 感染能够导致在特定基因转录失活,增加了DNA 的损伤或突变,导致染色体不稳定,最终使癌变的可能性增大。
以上结果表明,XPG His1104Asp 基因多态性可能会改变个体的DNA 修复能力,造成遗传不稳定性增加了胃癌的发病风险。但该研究也有几个局限性,首先,该研究所纳入的研究对象仅限于本地区,其他地区的人群虽有涉及,但是人数相对较少,并不能代表中国该基因多态性与胃癌的相关性。其次,肿瘤是一个多因素作用引起的疾病,环境因素和遗传因素之间也有交互作用,仅分析少数几个基因来分析肿瘤发病风险的准确性并不高,我们需要进一步研究才能够准确分析胃癌的危险因素。最后,该研究的样本量相对较小,统计检验效能较低,需要进一步大样本量的研究才能准确地评价XPG His1104Asp 基因多态性与胃癌的相关性。
总之,本研究结果证实了XPGHis1104Asp 位点的遗传变异与胃癌发病风险的相关性,并表明携带XPG 1104GG 基因多态性能够增加胃癌发病的风险,该研究结果有助于评价健康人群患胃癌的风险,筛选出高危人群及早进行预防。
[1] Ferlay J,Shin HR,Bray F,et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008 [J]. Int J Cancer,2010,127(12):2893-2917
[2] Parsonnet J,Friedman GD,Orentreich N,et al. Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection[J]. Gut,1997,40(3):297-301.
[3] Friedberg EC. How nucleotide excision repair protects against cancer[J].Nat Rev Cancer,2001,1(1):22-33.
[4] Wood RD,Mitchell M,Sgouros J,et al. Human DNA repair genes[J].Science,2001,291(5507):1284-1289.
[5] Chang JS,Wrensch MR,Hansen HM,et al. Base excision repair genes and risk of lung cancer among San Francisco Bay Area Latinos and African-Americans[J]. Carcinogenesis,2009,30(1):78-87.
[6] Kumar R,Höglund L,Zhao C,et al. Single nucleotide polymorphisms in the XPG gene:determination of role in DNA repair and breast cancer risk[J]. Int J Cancer,2003,103(5):671-675.
[7] Cui Y,Morgenstern H,Greenland S,et al. Polymorphism of Xeroderma Pigmentosum group G and the risk of lung cancer and squamous cell carcinomas of the oropharynx,larynx and esophagus[J]. Int J Cancer,2006,118(3):714-720.
[8] Duan Z,He C,Gong Y,et al. Promoter polymorphisms in DNA repair gene ERCC5 and susceptibility to gastric cancer in Chinese [J].Gene,2012,511(2):274-279.
[9] Doherty JA,Weiss NS,Fish S,et al. Polymorphisms in nucleotide excision repair genes and endometrial cancer risk[J]. Cancer Epidemiol Biomarkers Prev,2011,20(9):1873-1882.
[10] Jeon HS,Kim KM,Park SH,et al. Relationship between XPG codon 1104 polymorphism and risk of primary lung cancer[J]. Carcinogenesis,2003,24(10):1677-1681.
[11] Schärer OD. XPG:its products and biological roles[J]. Adv Exp Med Biol,2008,26(11):83-92.
[12] Gu J,Zhao H,Dinney CP,et al. Nucleotide excision repair gene polymorphisms and recurrence after treatment for superficial bladder cancer[J]. Clin Cancer Res,2005,11(4):1408-1415.
[13] Gonçalves FT,Francisco G,de Souza SP,et al. European ancestry and polymorphisms in DNA repair genes modify the risk of melanoma:a case-control study in a high UV index region in Brazil[J]. J Dermatol Sci,2011,64(1):59-66.
[14] He X,Ye F,Zhang J,et al. Susceptibility of XRCC3,XPD,and XPG genetic variants to cervical carcinoma[J]. Pathobiology,2008,75(6):356-63.
