GLP-1 对非酒精性脂肪肝大鼠TNF-α、TGF-β1 及氧化应激的影响
2014-12-31陈五一田邦妮
陈五一,黄 盖,田邦妮,雷 蕾
1.湖北省恩施州来凤县人民医院消化内科,湖北 恩施445700;2.湖北省恩施州中心医院消化内科
非酒精性脂肪肝性肝病(non-alcoholic fatty liver disease,NAFLD)是慢性肝病中最常见类型,在西方国家发病率可达20% ~30%[1],如患者合并有2 型糖尿病和肥胖则NAFLD 的发病率会更高[2],在我国NAFLD 的发病率低于病毒性肝炎,是第二大肝病[3]。研究发现NAFLD 的发生与遗传易感性、胰岛素抵抗等原因有关[3],其中炎症反应和氧化应激在NAFLD 发生及发展中均起到了一定的作用[4-5]。因而对NAFLD的治疗可通过增加对胰岛素的敏感性、改善胰岛素的功能来达到治疗作用,胰高血糖素样肽-1(GLP-1)研究发现具有改善胰岛素功能[6],利拉鲁肽为GLP-1 的类似物,有报道[7]采用利拉鲁肽能改善NAFLD 的脂代谢紊乱及胰岛素抵抗,本研究通过建立NAFLD 大鼠模型,观察了利拉鲁肽干预后大鼠肝组织的肿瘤坏死因子-α(TNF-α)、转换生长因子-β1、(TGF-β1)、超氧化物歧化酶(SOD)、丙二醛(MAD)的变化,以探讨GLP-1 对NAFLD 肝大鼠TNF-α、TGF-β1 及氧化应激的影响。
1 资料与方法
1.1 一般资料
1.1.1 实验动物:购得清洁级雄性SD 大鼠30 只,周龄6 周龄,体质量118 ~134 g,平均(120.5 ±10.0)g,大鼠均为上海斯莱克试验动物公司提供。
1.1.2 试剂:RIPA 细胞裂解液,购自上海申能博彩公司Abcam 公司生产的JNK1 及P-JNK1 大鼠多克隆抗体,丹麦诺和诺德公司长效人胰升糖素样肽-1(GLP-1),胆固醇及甘油三酯试剂盒、SOD、MDA 试剂盒购自南京建成生物技术研究所。
1.1.3 大鼠模型的建立及分组:将大鼠先使用普通饲料喂养1 周,随机抽取10 只大鼠为正常对照组(ND组),此组大鼠继续普通饲料喂养,剩余的20 只大鼠给予高脂饲料喂养(造模组),均喂养至12 周末,然后随机抽取ND 组与造模组的大鼠各1 只,检测肝功能、血脂等指标,处死大鼠后取得肝组织性HE 染色确认有肝脂肪变性、造模组大鼠升高肝功能、血脂则为造模成功。将造模组剩余的19 只大鼠再随机分为高脂饮食组(HFD 组,9 只)和GLP-1 干预组(GLP-1 组,10只),造模组的19 只大鼠继续高脂饮食4 周,GLP-1 组给予利拉鲁肽0.6 mg·kg-1·d-1腹腔注射,HFD 组给予等体积的生理盐水腹腔注射,在16 周末后禁食12 h,处死全部大鼠,取得下腔静脉血分离血清。
1.2 方法
1.2.1 肝指数的测定:在实验结束时测量大鼠的体质量及肝湿重,肝指数=肝湿重/体质量×100%。
1.2.2 血清血脂及肝功能指标测定:将取得的下腔静脉血液进行离心处理10 min(3 000 r/min),室温下静置,分离出血清,以全自动生化分析仪测定甘油三酯(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT),以免疫酶联吸附法测定TGF-β1。
1.2.3 肝组织TNF-α、TG、TC、SOD、MAD 测定:将大鼠肝组织精确称重200 mg,取1.8 ml 匀浆介质,肝组织在匀浆介质中混匀匀浆3 ~5 min(2 000 r/min),采用免疫酶联吸附法测定TNF-α,以化学法测定TG 及TC,以分光光度法测定SOD、MAD。
1.3 统计学处理 数据采用SPSS 16.0 统计学软件包进行统计处理,计数资料采用卡方检验,计量资料采用均数±标准差表示,两组间比较采用t 检验,多组间比较采用方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠体质量及肝指数、血清学相关指标比较
体质量、肝指数、ALT、TG、TC、TGF-β1 HFD 组明显高于ND 组和GLP-1 组,差异有统计学意义(P <0.05),ND 组与GLP-1 组比较,差异无统计学意义(P>0.05,见表1)。

表1 各组大鼠体质量、肝指数、血清ALT、TG、TC、TGF-β1 的比较(x- ±s)Tab 1 Comparison of BMI,the liver index,serum ALT,TG,TC,TGF-β1 of mice in each group(x- ±s)
2.2 各组大鼠肝组织匀浆相关指标检测结果比较HFD 组肝组织匀浆中TG、TC、SOD、MDA、TNF-α 显著高于ND 组和GLP-1 组,差异有统计学意义(P <0.05),GLP-1 组与ND 组比较稍有升高,但差异无统计学意义(P >0.05,见表2)。
3 讨论
NAFLD 是指非酒精影响、其他因素所致的肝脏损伤,其主要表现为弥漫性肝细胞大泡性脂肪变,包括单纯性脂肪肝、脂肪性肝炎、肝硬化。NAFLD 的具体发病机制迄今尚未完全研究清楚,目前认为氧化应激、胰岛素抵抗、脂质过氧化、细胞因子的炎症反应等参与了NAFLD 的发生过程[3-5],是引起肝脏发生脂肪变的主要原因之一,在于脂质过氧化、氧化应激及炎症反应能使得肝脏受到二次打击[8]。在发生NAFLD 时,过剩的FFAs 可在肝细胞内发生脂质过氧化,在过氧化过程中会发生氧化应激,产生大量的ROS,而ROS 能促使TNF-α 的大量释放及TGF-β1 的启动,通过抑制线粒体的呼吸、增加肝脂肪变及坏死等到这肝脏受损。
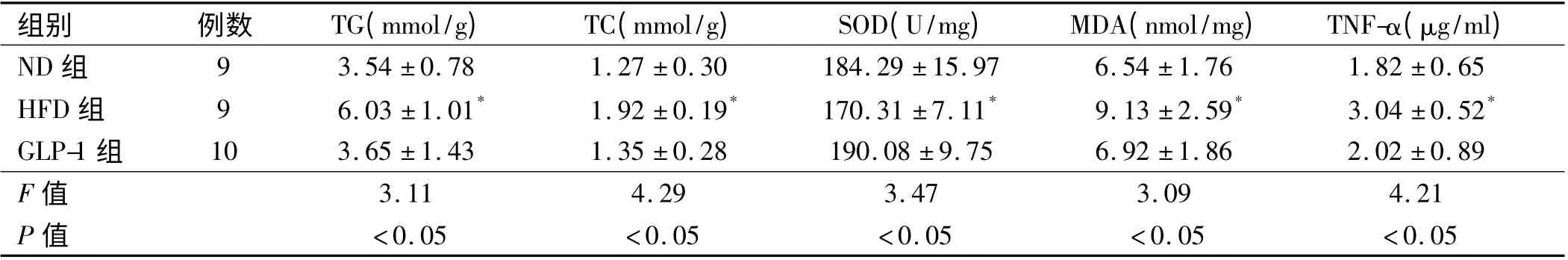
表2 各组大鼠肝组织匀浆TG、TC、SOD、MDA、TNF-α 的比较(x- ±s)Tab 2 Comparison of TG,TC,SOD,MDA,TNF-α in liver homogenate of mice in each group(x- ±s)
GLP-1 为葡萄糖依赖性肠促胰素,主要为小肠内的L-细胞分泌,在进食的刺激下才能出现分泌,其生理作用是刺激葡萄糖依赖的胰岛素分泌,抑制餐后胰高血糖素的释放。临床研究发现外源性的GLP-1 类似物能改善小鼠及离体人肝细胞的肝脂肪病变及改善胰岛素的敏感性[9],可能是通过激活了MAPK 途径而起到逆转肝细胞变性、促使脂肪酸氧化[10],而且还能通过减轻体质量而改善脂代谢。SOD 是体内最重要的抗氧化酶,能对自由基进行清除,而MDA 是脂质氧化过程中产生的氧化产物,能反应出自由基对组织细胞的损伤程度,因而临床上常通过检测SOD 及MDA而了解氧化应激损伤情况。本实验研究对大鼠分别给予不同饮食,形成不同的大鼠模型,对GLP-1 组大鼠在高脂饮食同时给予GLP-1 进行干预治疗,结果显示GLP-1 大鼠较单纯高脂饮食大鼠的体质量、肝指数及血脂、ALT 均下降,表明了GLP-对NAFLD 大鼠的脂代谢紊乱有改善作用,观察肝匀浆中TG、TC 及SOD、MDA、TNF-α 的水平、血清TGF-β1 变化,结果显示单纯高脂饮食大鼠以上指标高于TGF-1 干预的大鼠及普通饮食大鼠,提示NAFLD 状态下氧化应激及炎症反应明显增强,SOD 活力增加,采用GLP-1 干预可对NAFLD 大鼠肝变性程度及炎症反应起到抑制作用[11]。
综上所述,GLP-1 能减轻NAFLD 的脂肪变性,降低TNF-α 及TGF-β1 含量,改善氧化应激及脂质过氧化,提示使用GLP-1 类似物利拉鲁肽等药物可作为治疗NAFLD 的有效药物。
[1] Das K,Das K,Mukherjee PS,et al. Nonobese population in a developing country has a high prevalence of nonalcoholic fatty liver and significant liver disease[J]. Hepatology,2010,51(5):1593-1602.
[2] Williamson RM,Price JF,Glancy S,et al. Prevalence of and risk factors for hepatic steatosis and non-alcoholic fatty liver disease in people with type 2 diabetes:the edinburgh type 2 diabetes study[J]. Diabetes Care,2011,34(5):1139-1144.
[3] Kumashiro N,Erion DM,Zhang D,et al. Cellular mechanism of insulin resistance in nonalcoholic fatty liver disease[J]. Proc Natl Acad Sci U S A,2011,108(39):16381-16385.
[4] Tilg H,Moschen AR. Evolution of inflammation in non-alcoholic fatty liver disease:the multiple parallel hits hypothesis[J]. Hepatology,2010,52(5):1836-1846.
[5] Nobili V,Parola M,Alisi A,et al. Oxidative stress parameters in paediatric non-alcoholic fatty liver disease[J]. Int J Mol Med,2010,26(4):471-476.
[6] Pols TW,Auwerx J,Schoonjans K. Targeting the TGR5-GLP-1 pathway to combat type 2 diabetes and non-alcoholic fatty liver disease[J]. Gastroenterol Clin Biol,2010,34(4):270-273.
[7] Mells JE,Fu PP,Sharma S,et al. Glp-1 analog,liraglutide,ameliorates hepatic steatosis and cardiac hypertrophy in C57BL/6J mice fed a Western diet[J]. Am J Physiol Gastrointest Liver Physiol,2012,302(2):G225-G235.
[8] Tessari P,Coracina A,Cosma A,et al. Hepatic lipid metabolism and non-alcoholic fatty liver disease [J]. Nutr Metab Cardiovasc Dis,2009,19(4):291-302.
[9] Gupta NA,Mells J,Dunham RM,et al. Glucagon-like peptide-1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosis in vitro by modulating elements of the insulin signaling pathway[J].Hepatology,2010,51(5):1584-1592.
[10] Ben-Shlomo S,Zvibel I,Shnell M,et al. Glucagon-like peptide-1 educes hepatic lipogenesis via activation of AMP-activated proteininase[J]. J Hepatol,2011,54(6):1214-1223.
[11]Gao HT,Xu LS,Li DF,et al. Effects of glucagon-like peptide-1 on liver oxidative stress,TNF-α and TGF-β1 in rats with non-alcoholic fatty liver disease[J]. J South Med Univ,2013,33 (11):1661-1664.
